Саркопения. Лечение саркопении. Физическое, нутритивное и медикаментозное лечение саркопении.
Раздел: Статьи
/
Общая врачебная практика.
/
Геронтология и гериатрия.
/
Саркопения. Лечение саркопении. Физическое, нутритивное и медикаментозное лечение саркопении.
Содержание
Физическая коррекция саркопении
Нутритивная коррекция саркопении
Медикаментозная коррекция саркопении
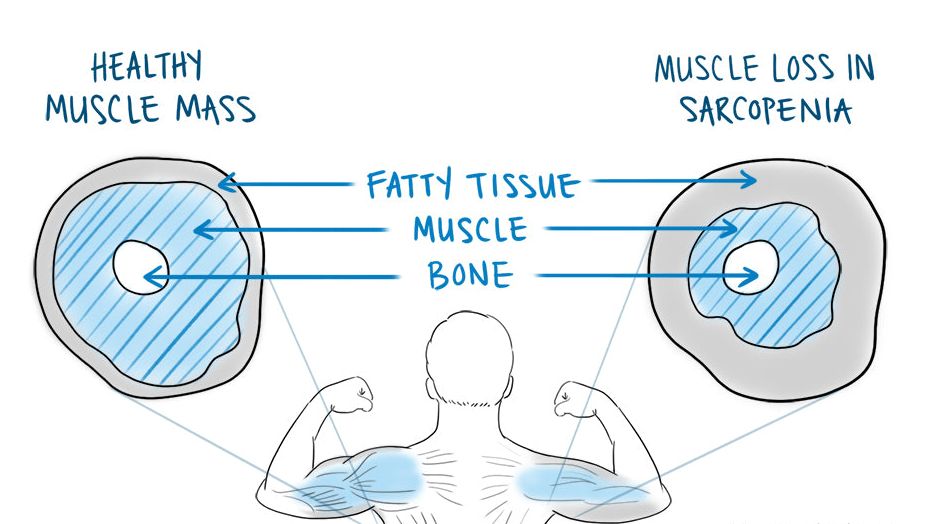
Лечение саркопении - новая концептуальная стратегия современной медицины, направленная на продление активной старости, повышение качества жизни, снижение зависимости пожилого пациента от окружающих и потребности в их помощи. При вторичной саркопении ее коррекция приведет к стабилизации состояния, продлению ремиссии, снижению количества госпитализаций. Несмотря на четкость поставленных целей, лечение саркопении в реальной практике - трудная задача. Медикаментозный арсенал интерниста сформирован на основе результатов разрозненных, подчас противоречивых исследований. Отсутствие исследований, результаты которых подтверждены жесткими конечными точками, затрудняет формирование стратегии и тактики лечения. В сложившейся ситуации данные метаанализов и систематических обзоров позволят сформулировать наиболее важные, обоснованные и, по-видимому, наиболее вероятные положения, действительные на современном этапе лечения саркопении. В настоящее время сформировалось два подхода к коррекции саркопении: немедикаментозное (физические упражнения и адекватная нутритивная поддержка) и медикаментозное (терапия гормональными препаратами и витамином D).
Влияние физических нагрузок на выраженность и прогрессию саркопении. Общий принцип заключается в том, что регулярное ежедневное выполнение программы физических нагрузок приведет к увеличению у пациентов с саркопенией аппендикулярной мышечной массы, развиваемой мышцами силы при разгибании колена, мышечной силы всех вовлеченных в упражнения групп мышц, к сохранению/увеличению скорости ходьбы. Поэтому регулярные физические нагрузки рекомендованы пациентам с саркопенией, однако уровень доказанности этого утверждения для повседневной практики остается невысоким и основан на результатах непродолжительных клинических исследований. Крупный систематический анализ был выполнен в 2014 г. (Cruz-Jentoft A.J., 2014). В обзор вошло всего семь контролируемых исследований, в которые были включены пациенты в возрасте от 60 до 95 лет. В исследованиях использовались методики, позволявшие оценить динамику мышечной силы и мышечной массы (тест вставания со стула, 12-минутный тест ходьбы, тест «встань- иди-повернись-вернись-сядь», тест подъема по лестнице). Наибольшее влияние на изучаемые параметры оказали тренировки на выносливость продолжительностью не менее 3 мес (3-18 мес). Следует отметить, что интенсивность нагрузок превосходила стандартный объем нагрузок, рекомендуемых для самостоятельно выполняемой программы реабилитации; прирост силы мышц был более выражен, чем прирост массы мышц. Значимо возросла выносливость по данным теста 12-минутной ходьбы. Влияние комбинированных нагрузок (аэробические, на выносливость, свободный режим) продолжительностью 3-18 мес привело к увеличению мышечной массы только в одном исследовании (246 пожилых женщин), а увеличение мышечной силы зарегистрировано в двух исследованиях. Суммарно, анализируя все режимы нагрузок и все исследования, включенные в обзор, отмечено, что только в трех из семи исследований возросла мышечная масса.
По-видимому, это объясняется исходной неоднородностью включенных пациентов и их способностью выполнять нагрузку большего, чем обычный, объема, неоднородностью протоколов исследования и в подавляющем большинстве случаев - короткой продолжительностью исследования. Систематический обзор 2017 г. (Yoshimura Y., 2017) подтвердил положительное влияние физических нагрузок на функциональное состояние мышечной системы и увеличение выносливости у пациентов после тренировок на выносливость, но статистический анализ не подтвердил влияния на прирост мышечной силы. Основополагающими работами в этом обзоре были исследования H.K. Kim (2012, 2013, 2016), в которых изучалось влияние тренировок (60-минутные тренировки на выносливость 2 раза в неделю в течение 3 мес) на массу и мышечную силу, а также на скорость ходьбы. Группа сравнения была сформирована из пациентов, получавших нутри-тивную поддержку и прошедших школу пациентов по навыкам реабилитации. Количество участников исследования в группах - от 59 до 74 пациентов. Тренировки (в сравнении с группой контроля) привели к приросту аппендикулярной массы на 0,38 кг, увеличению скорости ходьбы на 0,11 м/с, увеличению силы мышц-разгибателей колена на 0,11 Nm/кг. Важно отметить, что в группе контроля через 3 мес результаты не отличались от исходных. Представляет интерес сравнение средних уровней изучаемых параметров в двух группах. Масса аппендикулярных мышц в группе тренировок - 13,89±1,45 кг, в группе контроля - 13,35±1,11 кг; различие между группами составило 0,38 (95% CI 0,01, 0,74) (для сравнения: масса аппендикулярных мышц менее 17 кг у мужчин и менее 15 кг у женщин - диагностический критерий саркопении). Скорость ходьбы в группе тренировок составила 1,466±0,26 м/с, в группе контроля - 1,29±0,21 м/с; различие между группами достоверно 0,11 (95% CI 0,04, 0,19). Таким образом, по данным этого метаанализа, интенсивные регулярные тренировки у больных саркопенией привели к росту массы мышц и скорости ходьбы. К ограничениям этого метаанализа относится выраженная неоднородность пациентов, включенных в исследования (диагноз «саркопения» устанавливался не по критериям. EWGSOP или AWGS, а по наличию только сниженной массы мышц, что привело к исходной разнородности пациентов). Вызывает вопросы и переносимость интенсивных нагрузок пациентами с выраженной саркопенией (процент выбывших из исследования не указан). В систематическом обзоре Renato Gorga Bandeira de Mello, выполненном в 2019 г., из пяти проанализированных исследований только в одном отмечено влияние 12-недельных тренировок на выносливость на прирост аппендикулярной массы мышц (примерно на 1 кг), в других работах такой эффект не подтвержден. Подтверждено положительное влияние на увеличение скорости ходьбы и достоверное влияние тренировок на выносливость на качество жизни (опросник SF-36, различие между группами 13,62 (6,47, 20,76); р <0,001). Анализ 14 систематических обзоров и метаанализов (Beckwée D., 2019) позволил сравнить четыре типа физических нагрузок у пациентов с саркопенией: упражнения на выносливость, упражнения на выносливость + нутритивная поддержка, комбинированные упражнения и тренинг с ограничением кровотока (тренировка с применением жгутов, обвязываемых вокруг конечностей на время выполнения упражнений, возникающее снижение оксигенации группы мышц стимулирует рост быстрых волокон, а повышенный уровень мочевой кислоты стимулирует синтез мышечного белка. Ожидаемый эффект - быстрый прирост мышечной силы. Метод малоизучен и требует осторожности, так как может увеличить риск венозного тромбоза). Данные обзора позволяют выделить особую роль тренировок на выносливость, приводящих к максимальному эффекту по приросту мышечной массы и скорости ходьбы. Сравнение интенсивных и менее интенсивных программ показало достоверное преимущество интенсивных тренировок по влиянию на функциональное состояние мышечной системы. Комбинация тренировки + нутритивная поддержка не привела к достоверно большему влиянию на динамику мышечной массы и скорость ходьбы по сравнению с влиянием только тренировок.
Обобщая итоги четырех крупных систематических обзоров, можно отметить, что регулярные физические тренировки на выносливость позволяют увеличить скорость ходьбы и качество жизни (однозначно положительное влияние во всех обзорах), повлиять положительно на прирост мышечной силы и мышечной массы (данные подтверждаются не во всех исследованиях, однако негативного влияния на эти параметры не отмечено ни в одном исследовании). Имеющиеся данные позволяют считать, что рекомендуемые пациентам с саркопенией физические упражнения по программе тренировок на выносливость окажут положительное влияние на выраженность и прогрессию саркопении.
С другой стороны, следует учесть, что в реальной практике большое количество больных с выраженной саркопенией демонстрирует низкую способность выполнять регулярные упражнения, даже по программе малой интенсивности. Гистохимические, структурные, метаболические изменения в скелетной мускулатуре становятся непреодолимой проблемой и причиной исходно низкой толерантности к физическим нагрузкам. Вполне возможно, что сформировавшиеся структурные изменения не позволят пациенту даже приступить к выполнению стартового объема нагрузок. Но, с другой стороны, всегда остается надежда на то, что особая стартовая программа нагрузок позволит пациенту адаптироваться, изменив в оставшихся и еще функционирующих быстрых мышечных волокнах способ получения энергии (окис-лительно-гликолитический) и, следовательно, улучшив исходные показатели состояния мышечной ткани, приступить к тренировкам на выносливость. Тогда для реальной клинической практики становятся стратегически важными вопросы, как преодолеть стартовый период, как повысить исходно низкий уровень переносимых нагрузок и каким должен быть стартовый комплекс физических нагрузок для пациента с выраженной саркопенией. К сожалению, для такой группы пациентов практически не разработаны программы стартовых физических нагрузок, более того, такие пациенты не включаются в исследования. В нашей клинике именно для этой группы пациентов разработаны упражнения по тренировке дыхательной мускулатуры, так как изменения, приводящие к снижению выносливости и мышечной силы, развиваются в том числе и в дыхательных мышцах, и в диафрагме больных ХСН и саркопенией. Функциональная неполноценность дыхательных мышц приводит к неспособности создавать нормальное давление во время вдоха и выдоха. Оценка силы дыхательных мышц проводится путем измерения давления, создающегося в полости рта во время максимального вдоха (максимальное инспираторное давление (MIP)) и во время максимального выдоха (максимальное экспираторное давление (MEP)). Эти показатели достоверно снижаются у пациентов с ХСН и саркопенией. Снижение MIP до 70% и менее от должной величины (стандартизация по возрасту и полу) типично для больных выраженной саркопенией, коррелирует с пиковым потреблением О2 и свидетельствует о системном снижении аэробной выносливости пациентов. Серия работ, выполненная доцентом кафедры Е.А. Колесниковой, позволяет с оптимизмом смотреть на перспективы этого метода у пациентов с выраженной саркопенией.
Тренировки дыхательной мускулатуры у пациентов с манифестом тяжелой НК впервые в клинической практике были применены 25 лет назад D.M. Mancini. У пациентов с исходно низкой фракцией выброса левого желудочка (ФВ ЛЖ) (22±9%) тренировка дыхательных мышц (3 раза в неделю по 1,5 ч) привела к росту давления вдоха и выдоха (с 64±31 до 78±33 см H2O, р <0,01 и с 94±30 до 133±53 см H2O, р <0,01), VO2 peak (с 11,4±3,3 до 13,3±2,7 мл/ кг в минуту, р <0,05) и дистанции теста «6-минутная ходьба» с 110,1±351 до 142,1±328 м, р <0,001.
Метаанализ A. Neil (2013) выявил положительное влияние тренировок дыхательной мускулатуры на показатели общей физической выносливости и вентиляционной эффективности: VO2 peak увеличилось на 1,83 мл/кг в минуту (9,2% по сравнению с исходным уровнем); прирост дистанции шестиминутного теста ходьбы был близок к результатам применения традиционных аэробных или силовых упражнений с отягощениями. Эти данные свидетельствуют о том, что изолированные тренировки дыхательной мускулатуры приводят к увеличению толерантности к физической нагрузке и, по-видимому, выносливости. В нашей клинике доцент Колесникова Е.А. проводила тренировки дыхательной мускулатуры у пациентов с острым ИМ и признаками сердечной недостаточности (СН). В исследование были включены 93 пациента 68,3±4,5 года с СН II-IV ФК по NYHA (ФВ ЛЖ 34,3±4,43%). Рандомизация (на 5-7-е сутки от начала ИМ) в две группы: а) медикаментозная терапия + ЛФК (согласно национальным рекомендациям по реабилитации пациентов с острым ИМ) + тренировки дыхательной мускулатуры (с использованием дыхательных тренажеров 2 раза в день по 20 мин); б) (контрольная группа) медикаментозная терапия + ЛФК. Через 12 мес в группе пациентов, продолживших дыхательные тренировки после выписки из стационара, отмечался достоверный рост потребления О2 при физической нагрузке (на 53%), в среднем VO2 peak увеличился до 4,56±1,97 мл/кг в минуту (р <0,01), а в группе контроля - на 24%, среднее значение - 3,72±1,12 мл/кг в минуту. Различие между группами достоверно (р <0,01). Положительные изменения толерантности к физическим нагрузкам отразились и на качестве жизни пациентов по опроснику SF-36.
Виды и режимы тренировок дыхательных мышц. Тренировки дыхательных мышц направлены на увеличение их силы и/или выносливости. К настоящему времени разработаны различные протоколы тренировок дыхательной мускулатуры, например тренировки с использованием пороговых, резистивных нагрузок, изокапнические тренировки и др. Для увеличения силы дыхательных мышц применяются тренировки с пороговыми и резистивными нагрузками. При использовании метода пороговой нагрузки рекомендуется предварительно определить порог нагрузки (измеряется максимальное давление, которое могут развить дыхательные мышцы во время вдоха и выдоха с сопротивлением). В процессе тренировок постоянное сопротивление должно поддерживать давление вдоха/выдоха на уровне, составляющем не менее 30% порогового. Для тренировок могут быть использованы дыхательные тренажеры с созданием дополнительного сопротивления на вдохе и выдохе Threshold IMT® (Трешолд ТДМ) и Threshold PEP® (Трешолд ПДВ) (Healthscan Products Inc., New Jersey, USA). Тренажер Threshold IMT® оснащен клапаном, создающим постоянное сопротивление вдоху. Тренажер Threshold PEP® предназначен для проведения тренировок дыхательных мышц в режиме положительного давления на выдохе. Резистивные тренировки, в отличие от пороговых, основаны на принципе прогрессивного увеличения сопротивления во время вдоха. Этот принцип использован в серии дыхательных тренажеров POWERbreathe для тренировки инспираторных мышц. Изокап-нические тренировки - тренировки выносливости дыхательной мускулатуры. С этой целью применяется тренажер SpiroTiger, используемый спортсменами, работающий по принципу форсированного дыхания. В настоящее время недостаточно данных о возможности использования его в медицинской практике.
Начальная интенсивность тренировок дыхательных мышц должна составлять 30% MIP и увеличиваться каждые 7-10 дней до максимальной, составляющей 60% MIPmax. Продолжительность тренировки ограничивается 20-30 мин/сут с частотой 3-5 сеансов в неделю в течение как минимум 8 нед.
Новые направления по подбору оптимального режима тренировок. Изучение морфологических особенностей диафрагмы и ее роли в нарушении дыхания позволили предложить новый подход к назначению тренировок дыхательных мышц. Известно, что толщина диафрагмы менее 4 мм коррелирует с величиной максимального давления на вдохе. Снижение максимальной толщины диафрагмы в конце вдоха до уровня менее 3,9 мм (определение толщины помощью ультразвукового исследования (УЗИ) ассоциируется с достоверно меньшей дистанцией 6-минутного теста ходьбы и худшим прогнозом. Формирующиеся уже в дебюте заболевания морфофункциональные изменения диафрагмы с течением времени начинают играть самостоятельную роль, приводя к снижению толерантности к физическим нагрузкам из-за невозможности поддерживать адекватное внешнее дыхание. Таким образом, морфофункциональное состояние диафрагмы вносит существенный вклад в прогрессирование болезни. Доминирующая роль в перестройке диафрагмы принадлежит снижению количества мышечной массы и увеличению количества коллагена. Следствием этих изменений становятся хроническая усталость оставшейся в диафрагме мышечной массы и нарастание ее функциональной недостаточности. Сопоставление морфологических изменений в диафрагме, выявленных в ходе посмертного исследования, с прижизненными параметрами внешнего дыхания, в частности с величиной MIP, выявило наличие связи между ними. Выраженное уменьшение объема мышечной ткани и увеличение объема соединительной ткани не позволят пороговым тренировкам повлиять на прирост или сохранение MIP. По-видимому, в такой ситуации наибольший успех, а именно максимально долгое сохранение существующего уровня внешнего дыхания пациента, можно предполагать при применении тренировок по преодолению сопротивления на вдохе и выдохе, то есть тренировок на выносливость. Механизм влияния тренировок на выносливость на морфологические изменения диафрагмы не известен, однако в проспективном исследовании H. Souza (2014) показано, что такие тренировки приводят к увеличению максимальной толщины диафрагмальной мышцы при ее сокращении так же, как и у здоровых пожилых людей. Можно предполагать, что наиболее вероятный механизм развития таких изменений обусловлен развивающейся гипертрофией оставшихся и функционирующих мышечных волокон. Кроме того, тренировки на выносливость могут изменить способ получения энергии, приводя к переходу быстрых мышечных волокон из гликолитических в промежуточные, для которых характерен окислительно-гликолитический способ получения энергии.
Проведенное нами исследование по определению оптимального режима нагрузок при различном состоянии мышечной ткани диафрагмы у пациентов с ХСН позволило сформулировать следующие рекомендации:
• при MIP <20 см Н2О - глубокое дыхание без сопротивления;
• MIP 20-60 см Н2О - тренировки на выносливость;
• MIP >60 см Н2О - сочетание тренировок на увеличение силы и выносливости.
Общий принцип заключается в том, что нутритивная поддержка пациента с саркопенией, в частности прием аминокислот, может привести к увеличению мышечной силы, в том числе к улучшению функционального состояния мышц-разгибателей колена. Поэтому нутритивная поддержка рекомендована пациентам с саркопенией, однако уровень доказанности этого утверждения для повседневной практики остается невысоким и основан на результатах обсервационных исследований либо непродолжительных клинических исследований. В основном эти исследования посвящены оценке влияния отдельно взятого нутриента, например протеина, ω-3 ПНЖК, витамина D, на какой-то параметр функционального состояния мышечной системы (мышечная сила, скорость ходьбы, суммарный балл теста «короткая батарея»).
Начиная с конца 1990-х годов большое количество исследований было посвящено влиянию различных доз потребляемого протеина на функцию мышечной системы. Не углубляясь в отдельные исследования, рассмотрим результаты метаанализа Robert W. Morton (2017) (включено 49 контролируемых, рандомизированных исследований продолжительностью >6 нед; 1863 пациента). Данные анализа позволили установить, что увеличение дозы потребляемого протеина приводит к увеличению мышечной силы (+2,49 кг 95% CI 0,64-4,33); увеличению ТМТ (+0,30 кг 95% CI 0,09-0,52); увеличению площади поперечного сечения мышечного волокна (+7,2 mm2 95% CI 0,20-14,30). Все изменения достоверны p <0,05. Прирост мышечной массы был достоверно меньшим у более пожилых пациентов. Тренировки на выносливость приводили к самому выраженному приросту мышечной массы на фоне увеличенного потребления протеина + 0,75 кг (95% CI 0,09-1,40, p=0,03) по сравнению с любой другой программой тренировок. Таким образом, простое увеличение потребляемого суточного количества протеина приводило к росту как мышечной силы, так и размера отдельного мышечного волокна.
Представляет практический интерес анализ доз протеина, изученных в клинических исследованиях. Так, в исследовании D.K. Houston (2008) уровень употребляемого белка в верхнем квинтиле составил ≥1,2 г/кг в день, а в нижнем - ≤0,8 г/кг в день. Употребление белка более 1,2 г/кг в день ассоциировалось с меньшим снижением величины ТМТ, различие между верхним и нижним квинтилями составило 40%. В исследовании S. Kobayashi (2013) рассчитывали дневную дозу белка (в нижнем квинтиле она составила ≤62,9, а в верхнем - 76,1-84,3), что в пересчете на 1 кг массы тела 60-килограммового человека составит уровни от 1,05 до 1,4 г/кг. В этом исследовании уровни потребляемого белка выше 1,16 г/кг достоверно снижали риски развития старческой немощности. Уровень потребления белка ≥1,2 г/кг в день, достоверно повышающий величину мышечной массы, подтвержден в исследовании Genaro Pde S. (2015).
Таким образом, уровень потребления белка для пожилых пациентов с саркопенией составляет 1,0-1,2 г/кг в день (60-72 г белка в день).
Обсуждая с пациентом его ежедневное питание, важно помнить, сколько граммов белка содержится в обычных продуктах. Так, в одном яйце содержится 6 г белка (80 ккал); куриное мясо белое содержит 30,7 г белка на 100 г продукта (170 ккал); говядина, свинина, баранина соответственно 28,6 г (170 ккал), 20 г (298 ккал), 22 г (243 ккал); мясо рыбы - от 17,7 г на 100 г продукта (минтай) до 23,1 г на 100 г продукта (горбуша); молоко - 3 г на 100 г продукта; творог - 18 г на 100 г продукта; каша геркулес - 3 г на 100 г продукта, гречневая каша - 3 г на 100 г продукта; сыр голландский - 27 г на 100 г продукта, сыр брынза - 18 г на 100 г продукта. Даже беглый опрос пациента позволит сформировать ориентировочное суждение об уровне суточного потребления белка и калорий.
В метаанализе (Yoshimura Y., 2017) исследовано влияние добавления в ежедневный рацион 3 г аминокислот × 2 раза в день; 540 мг катехина (активный ингредиент чая) × 1 раз в день; 3 г аминокислот + 540 мг катехина × 1 раз в день; 12 г протеина + 7 г аминокислот ежедневно. Из всех исследуемых параметров только сила мышц-разгибателей колена увеличилась на 0,11 Nm/кг на фоне приема аминокислот. Не отмечено влияния добавок к питанию пациентов на другие параметры функционального состояния мышц. A. Granic (2020) исследовала у 757 пациентов в возрасте 85+, проживающих в северо-восточном районе Великобритании, влияние различных диет, а также низкого (<1 г белка на 1 кг массы тела в день) и высокого (>1 г белка на 1 кг массы тела в день) потребления белка на выраженность саркопении и риск ее прогрессии. Для реальной практики ценность именно таких исследований очень высока, поскольку учитывает влияние всего комплекса продуктов в рационе пациента, а не одного, наслаиваемого на традиционное питание продукта в произвольно выбранной дозе. Можно предполагать, что преимущественный тип питания, традиционный для пациента и его семьи на протяжении многих лет, а не отдельные продукты в измененных пропорциях, оказывает решающее влияние на риск развития саркопении. В цитируемой работе сформировано три когорты пациентов на основе преимущественного принципа питания: 1) мало красного мяса (преимущественно рыба, яйца, цельные зерна, но мало красного мяса и картофеля); 2) традиционно английский тип питания (большое потребление сливочного масла, красного мяса, жирных соусов и подливок, картофеля, овощей, сладостей и сладких десертов, то есть высокое потребление жиров и в целом высокоэнергетическое питание); 3) мало масла (малый процент жиров в ежедневном рационе). Самый высокий уровень встречаемости саркопении при скрининге и рандомизации пациентов был в группе № 2 (традиционно английский тип питания) (OR=2,14, 1,01-4,53, p=0,05) vs группа № 3, где превалировало потребление полиненасыщенных жирных кислот (91% пациентов потребляли растительное масло), а суточный каллораж в основном достигался за счет употребления белков. В этой же группе (№ 2) через 3 года был самый высокий риск развития новых случаев саркопении (OR=5,45, 1,81-16,39, p=0,003), даже несмотря на высокий уровень потребления белка. Таким образом, тип питания «мало насыщенных жиров и больше белков» привел к наименьшему количеству новых случаев саркопении. Соотношение насыщенных и ненасыщенных жирных кислот в рационе пациента предопределяет соотношение жирных кислот в мембране миоцитов. В исследовании A. Andersson (2002) 25 здоровых добровольцев, находившихся на диете с избытком насыщенных жирных кислот, рандомизировали на группу получающих капсулы с ω-3 ПНЖК 3,6 г, группу получающих ω-3 ПНЖК 2,4 г и группу плацебо. Всем участникам исследования выполняли биопсию мышц. Установлено, что содержание ω (омега) ПНЖК (преимущественно за счет ЭПК в мембране клеток мышечной системы участников исследования, получавших ПНЖК, было в 2,5 раза выше, чем у участников, получавших плацебо. Интересно, что сравнение влияния кукурузного масла и добавок ω-3 ПНЖК на уровень синтеза белков в мышечной клетке у 16 здоровых пожилых людей показало достоверное влияние именно ω-3 ПНЖК как усиливающего синтез белка фактора (Smith G.I., 2011). Сравнение традиционно английского типа питания (избыток НЖК - насыщенных жирных кислот) и описанного выше типа питания «мало масла» (малый процент НЖК и высокий уровень ПНЖК в ежедневном рационе) показало положительное влияние именно второго типа питания на частоту развития новых случаев саркопении. Во многом такое влияние объясняется способностью ПНЖК, в отличие от НЖК, снижать выраженность системного воспаления и уровень эндотоксинов, положительно влияя на микробиоту кишки. Бесспорно, исследование A. Granic, подробно разобранное выше, имеет ряд ограничений, но, что очень важно для практикующего интерниста, позволяет определиться с качественным составом нутриентов в повседневном рационе пациента как с принципиальным фактором, влияющим на риск развития и прогрессии саркопении.
Влияние диет - «средиземноморской диеты» и «диеты Балтийского моря» - на риск развития саркопении и динамику функционального состояния мышечной системы было изучено в OSPTRE-FPS study. В исследование включены 554 женщины в возрасте 65-72 года. Все участницы исследования отвечали на вопросы анкеты, позволяющие оценить преимущественные продукты в привычном ежедневном рационе. Приверженность девяти продуктам позволяла включить участницу в когорту «диета Балтийского моря», приверженность восьми продуктам позволяла включить участницу в когорту «средиземноморская диета». «Диета Балтийского моря» включает в себя до 65% фруктов и овощей, произрастающих в этом регионе: ягоды, тыкву, брюкву, картофель, капусту, свеклу, огурцы, помидоры, зелень. Жиры преимущественно растительные - льняное, конопляное и рапсовое масло. Животный белок - мясо рыбы. Минимизировано потребление жирного красного мяса. Обработка продуктов - методом запекания или варки. Приготовленные блюда употребляются без усилителей вкуса. Одно из существенных отличий от средиземноморской диеты - источник жира: в «средиземноморской диете» это оливковое масло, а в «балтийской диете» - рапсовое (также конопляное и льняное), отличающееся по содержанию ω-3 ПНЖК. У участниц исследования оценивали скорость ходьбы (10-метровая дистанция), проводили тест вставания со стула, оценивали мышечную силу как в начале исследования, так и через 3 года наблюдения. Установлено, что женщины из верхнего квартиля приверженности «балтийской диете» и «средиземноморской диете» уже в начале исследования имели большую величину мышечной массы, большую скорость ходьбы и более высокий суммарный балл в тесте «короткая батарея», чем участницы из нижнего квартиля. Преимущество участниц из верхнего квартиля сохранилось на протяжении 3 лет наблюдения и проявилось в достоверно меньшем снижении мышечной массы и сохраненной скорости ходьбы по сравнению с участницами из нижнего квартиля (OR=0,40; 95% CI: 0,17-0,97; p=0,04).
Таким образом, высокая степень приверженности к паттерну питания «мало насыщенных жиров, больше ПНЖК и больше белков» имела обратную корреляционную связь с прогрессией саркопении и возникновением новых случаев саркопении. Поддержание приверженности такому паттерну питания становится ключевой и трудновыполнимой задачей. L.M. León-Muñoz (2014), в течение 9 лет наблюдавший за пожилыми здоровыми людьми, установил, что высокая степень приверженности паттерну «средиземноморской диеты» позволяет сохранять показатели теста «короткая батарея» достоверно более высокими, чем у пациентов с низкой приверженностью. Так, через 3 года показатель был выше на 0,9 балла, через 6 лет - на 1,1 балла и через 9 лет - на 0,9 балла. Практически во всех исследованиях высокая приверженность средиземноморскому типу питания улучшала прогноз у больных саркопенией, однако в большом проспективном когортном исследовании, выполненном в китайской популяции (2724 пожилых китайца, старше 65 лет в течение 4 лет), не удалось подтвердить положительное влияние высокой приверженности к этому типу питания на риск развития мышечной слабости. Означают ли эти данные, что существует региональная эффективность этого паттерна питания, пока неясно. Нет также ясности в вопросе, влияет ли этот паттерн питания на жесткие конечные точки у пожилых пациентов (риск смерти).
Важный аспект проблемы нутритивной поддержки пациентов с саркопенией - это количественная оценка ежедневного рациона пациента и расчет его каллоража. 24-36 ккал/кг в день - это нормальный ежедневный уровень для любого пациента. Вопрос, получает ли их пациент в возрасте старше 65 лет, как правило, имеет отрицательный ответ. Проблема жевательных мышц, состояние зубов, возрастная анорексия (anorexia of aging) приводят к снижению суточного каллоража питания, а уровень мальнутриции в этой возрастной группе достигает 5-20%. Существенное влияние на течение саркопении оказывает нарушение всасывания в кишечнике (мальабсорбция) вследствие венозного застоя, фиброза и воспаления в стенке тонкой кишки. Морфологическая перестройка тонкой кишки включают в себя: атрофию и снижение высоты ворсин слизистой оболочки, увеличение толщины криптального слоя за счет клеточной инфильтрации и отека, увеличение количества бокаловидных клеток, увеличение расстояния от базальной мембраны энтероцита до стенки капилляра за счет увеличения отложения коллагена и отека. Структурные изменения кишечной стенки предопределяют развитие эпителиальной дисфункции и приводят к мальабсорбции жира и белка. Потери нутриентов могут достигать 30%. По-видимому, введение в рацион пациента олигомерных смесей позволит снизить негативное влияние мальабсорбции за счет облегченного процесса абсорбции. В нашей клинике изучалась эффективность длительной нутритивной поддержки сбалансированной олигомерной смесью «Пептамен» у пациентов с ХСН III-IV ФК и саркопенией. В исследование включены 74 пациента (36 в группу нутритивной поддержки, 32 - в контрольную). Пациенты получали питательную смесь в количестве 25% суточной потребности на протяжении 24 нед, что привело к достоверному приросту ТМТ в среднем на 8,9% (против снижения в контроле на 4,9%). Дистанция 6-минутной ходьбы увеличилась на 29,6% (в контрольной группе отмечено снижение на 19%). Также нутритивная поддержка привела к достоверному снижению общего количества госпитализаций на 22,2%. Некоторые олигомерные смеси обладают противовоспалительным влиянием, в частности олигомерная смесь «Модулен». Эффективность нутритивной поддержки питательной смесью с противовоспалительным эффектом «Модулен IBD» исследовалась у пациентов с ХСН и саркопенией (сниженной ТМТ и высоким уровнем системного воспаления - С-реактивный белок >5 мг/дл.) В исследование (Костюкевич О.И., 2005) включены 69 пациентов (37 - основная группа, 32 - контрольная). Через 4 нед терапии уровень СРБ в группе больных, получавших «Модулен IBD», снизился на 16,4%. ТМТ в группе нутритивной поддержки увеличилась в среднем на 3,4% (в контрольной группе было отмечено снижение ТМТ в среднем на 2,9%). Результаты многоцентрового рандомизированного исследования САТУРН-II (33 центра, 24 города РФ), включающего 576 пациентов с ХСН и сниженной ТМТ, получавших нутритивную поддержку (сипинг) на протяжении 8 нед, показали достоверное увеличение ТМТ в среднем на 1,7 кг (в контрольной группе ТМТ снизилась на 0,8 кг) и дистанции 6-минутной ходьбы - на 21,3% (в контрольной группе - на 4,5%).
Таким образом, на нашем уровне знаний нутритивная поддержка, бесспорно, является важным самостоятельным методом лечения саркопении.
Пути медикаментозной коррекции саркопении интенсивно изучаются в настоящее время, хотя нет устоявшихся схем лечения. Как правило, обсуждается воздействие витамина D, ω-3 ПНЖК, гормона роста, тестостерона на функциональные показатели состояния мышечной системы (мышечная сила, скорость ходьбы, показатели тестов, входящих в комплекс «короткая батарея). Именно с этими препаратами выполнены проспективные и популяционные исследования, обобщенные в метаанализах, позволяющие учитывать доказанное влияние этой терапии на «суррогатные» показатели в повседневной практике.
Терапия витамином D. Жирорастворимый витамин поступает с пищей или синтезируется в коже под воздействием ультрафиолетовых лучей. Функция - участие в регуляции фосфорно-кальциевого обмена, врожденного и приобретенного иммунитета и некоторых других функций организма. В реальной практике полезно помнить ориентировочное содержание витамина в продуктах на 100 г: лосось - 100-250 МЕ, рыбий жир - 500-1000 МЕ на 1 столовую ложку; сливочное масло - 52 МЕ; яичный желток - 20 МЕ; сметана - 50 МЕ; сыр - 44 МЕ. Интернист должен знать, что у пациентов, живущих в северных широтах выше 35-й параллели (острый угол падения солнечных лучей с ноября по март), в коже практически не вырабатывается витамин D; у пациентов с ожирением происходит депонирование витамина в подкожной жировой клетчатке, что затрудняет или исключает его попадание с кровотоком в другие органы; у пациентов с ХБП или циррозом печени нарушается процесс активации молекулы. Превращение молекулы витамина в физиологически активную происходит в два этапа: в печени с образованием 25-гидроксивита-мин D (кальцидиол) и в почках (2-й этап) с образованием физиологически активного D-гормона - 1,25-дигидроксивита-мина D. Оптимальный уровень концентрации витамина D в крови взрослого человека равен 30-100 нг/мл. Недостаточный уровень соответствует 20-30 нг/мл. Дефицит витамина D диагностируется при уровне менее 20 нг/мл (Российская ассоциация эндокринологов). В России в Северо-Западном регионе определяли уровень витамина D в крови у пожилых пациентов (65-84 года) (Safonova Yu., 2019). Оптимальный уровень зарегистрирован у 3% больных саркопенией и 14% пожилых без признаков саркопении. Средний уровень витамина D у пожилых с саркопенией составил 18,2±3,04 ng/ml. У лиц старше 85 лет уровень составил 15,1±6,43 ng/ml. Примерно 8 из 10 пациентов с низким уровнем витамина D имели достоверное снижение мышечной силы и показателей тестов «короткой батареи». В исследовании (систематический обзор) P. Anagnostis (2015) оценивался эффект введения витамина D пожилым женщинам. Отмечен недостоверный прирост мышечной массы (кг) 0,058 (95% CI -0,118, -0,233); невыраженное, но достоверное влияние на мышечную силу 0,25 (95% CI 0,01-0,48); и достоверное влияние (сокращение времени) на показатель теста «встань-иди-повернись-вернись- сядь» = -0,19 (95% CI -0,35, -0,02). Выраженный эффект наблюдался только в группе пациенток с исходно низким уровнем витамина D (<25 nmol/L) и у женщин, получавших витамин D совместно с препаратами кальция.
В метаанализе C. Beaudart (2017) получены идентичные результаты: нет влияния на мышечную массу, умеренное влияние на мышечную силу, в основном отмечено улучшение показателей тестов, входящих в «малую батарею». В метаанализ M. Abshirini (2020) включено 29 клинических исследований, посвященных изучению влияния витамина D на течение саркопении у женщин в постменопаузальном периоде. Установлено, что введение витамина не приводило к усилению мышечной силы сжатия кисти (MD (медиана) = 0,656; 95% CI -0,037-1,350, p=0,06) и не повлияло на продолжительность выполнения теста «встань-иди-повернись-вернись-сядь» (MD = 0,118; 95% CI -0,655-0,892, p=0,76). Только в субгрупповых анализах удалось выявить достоверное влияние введения витамина D: в субгруппе, получавшей дозы >1000 IU/сут (p=0,016); и в субгруппе, имевшей исходно уровень в плазме крови <30 ng/мл (p=0,033). Таким образом, по-видимому, таргетной группой может считаться группа с исходно низким уровнем витамина в плазме крови. Американская ассоциация гериаторов [American Geriatrics Society (AGS)] рекомендует прием витамина D в ежедневной дозе 1000 IU/сут как для мужчин, так и для женщин. Поскольку внешние признаки дефицита витамина D неспецифичны (ломкость ногтей, низкоэнергетические переломы, выпадение волос, депрессия, частые простуды), интернисту необходимо включить в план обследования всех пожилых людей (в первую очередь - из-за большей частоты встречаемости дефицита витамина D - женщин, начиная с постменопаузального периода) определение уровня витамина D в крови (концентрация 25(ОН)D в сыворотке крови является индикатором уровня витамина D). При исходно низком уровне целесообразно начать терапию витамином D в суточной дозе 1000 IU (при лечении дефицита витамина D предпочтение отдается форме D3 - колекальциферолу). Лечение дефицита витамина D требует параллельного введения кальция в дозе 1000-1500 мг для взрослых. Назначение препарата - компетенция эндокринолога. Критерии эффективности лечения больных саркопенией неясны, по-видимому, это снижение риска переломов костей. Использовать параметры, отражающие функциональное состояние мышечной системы, можно с оговорками из-за наличия противоречивых данных в исследованиях. Общие рекомендации по применению витамина D у пациентов с саркопенией разрешают назначение витамина с целью улучшения функционального состояния мышечной системы у пожилых (в первую очередь пожилых женщин) с исходно низким уровнем витамина в крови. Контроль уровня кальция в крови на весь период лечения обязателен. Уровень доказанности этих положений очень низкий.
Гормон роста. Необходимо учесть:
• большое количество побочных эффектов в ходе терапии гормоном роста;
• отсутствие прироста мышечной силы, несмотря на прирост мышечной массы, на фоне терапии гормоном роста.
Этот вид терапии не рекомендован для широкого применения.
Тестостерон (общий). Уровень гормона в крови в норме: у мужчин - 4,94-32,01 нмоль/л, у женщин - 0,38-1,97 нмоль/л. С 30-летнего возраста у мужчин уровень тестостерона начинает снижаться на 1-2% ежегодно. Единицы измерения: нмоль/л и нг/дл (нг/дл × 0,0347 = нмоль/л).
Тестостерон (свободный). Единицы измерения: пг/мл и пмоль/л (пмоль/л × 0,288 = пг/мл). Внешние проявления низкого уровня гормона, кроме снижения либидо и эрекции, неспецифичны и имеют широкий спектр проявлений: утомляемость, слабость, снижение работоспособности, потливость, приливы жара, повышение АД, ожирение, уменьшение мышечной массы, снижение мышечной силы, развитие саркопенического ожирения, синдром «уставших ног», остеопороз, замедление скорости роста волос, частые обострения простатита. У больных саркопенией уровень гормона снижен (<200-300 нг/дл = 6,94-10,4 нмоль/л). В мета-анализ A.B. Araujo (2012) включено 11 исследований (16 184 пациента) для проверки возможной связи низкого уровня тестостерона с общей смертностью и 7 исследований (11 831 пациент) для проверки возможной связи низкого уровня тестостерона с СС-смертностью. Возраст пациентов - старше 61 года, продолжительность наблюдения - 9,7 года. Установлено, что при уровне тестостерона менее 487 нг/дл (<16,89 нмоль/л) достоверно возрастает риск как общей смерти, так и СС-смерти. В исследовании Framingham Offspring Study у 1445 мужчин (возраст 61±9,5 года) проанализирована (6,5 года наблюдения) взаимосвязь низкого уровня свободного и общего тестостерона с показателями функционального состояния мышечной системы. Установлено, что исходный уровень общего тестостерона составил 583±227 нг/дл, а свободного - 86±32 пг/мл; у 15,4% исследуемых был низкий уровень общего тестостерона и у 31,6% низкий уровень свободного тестостерона. Уровни свободного тестостерона выше 70 пг/мл ассоциировались с достоверно большей скоростью ходьбы и мышечной силы (OR=0,72; p=0,01); увеличение уровня свободного тестостерона на уровень, равный одному квадратичному отклонению, снижал риск прогрессии ухудшения функционального состояния мышечной системы на 22% (OR=0,78; 95% CI 0,62-0,97). У мужчин с исходно низким уровнем тестостерона (<70 пг/мл) риск развития дисфункции мышечной системы возрастал на 57% (p=0,03).
Назначение пациенту с саркопенией и исходно низким уровнем общего тестостерона [<249 нг/дл (=8,6 нмоль/л)] и свободного тестостерона (<131 пмоль/л) физических упражнений и терапии вводимым тестостероном приводило к достоверному увеличению ТМТ (увеличению площади поперечного сечения мышечных волокон 1-го и 2-го типов) и мышечной силы. В систематическом обзоре и метаанализе (O'Connell M.D., 2011; 2006) подтверждено, что терапия тестостероном у пациентов с саркопенией приводит к росту мышечной массы, менее выражено влияние на мышечную силу, что, возможно, объясняется короткой продолжительностью исследований и отсутствием градации пациентов по степени исходного снижения уровня тестостерона. В двух крупных проспективных исследованиях (Traish A.M., 2017; Elagizi A., 2018) было доказано, что назначение тестостерона пожилым пациентам с исходно низким уровнем гормона в крови приводит к снижению риска СС-событий.
Таким образом, целевой аудиторией для лечения тестостероном стали пациенты с исходно низким уровнем гормона в крови (<200-300 нг/дл). Терапия гормоном требует контроля уровня гематокрита и состояния предстательной железы, хотя риски негативного влияния на предстательную железу невелики. Ряд авторов рекомендуют отменять терапию тестостероном через 6 мес, если за этот период не отмечено очевидного положительного влияния.
Терапия тестостероном рекомендована пациентам-мужчинам с саркопенией с целью увеличения мышечной массы и мышечной силы при исходно низком уровне гормона в крови (<200-300 ng/dL) и очевидных проявлениях дисфункции мышечной системы. Контроль уровня гематокрита, уровня липидов и состояния предстательной железы обязателен. Уровень доказанности этих положений высокий.
Источник: Внутренние болезни: избранные лекции: учебное пособие / Г. П. Арутюнов, А. Г. Арутюнов. - Москва: ГЭОТАР-Медиа, 2022
Материал по теме:
Саркопения. Диагностика саркопении.
Саркопения. Общие сведения, причины саркопении. Немощность. Первичная и вторичная саркопения. Влияние гормонов на мышечную ткань.
02.05.2022 | 16:32:30