Риск фибрилляции предсердий. Риск инсульта, тромбоэмболий, риск кровотечений. Интегральная оценка рисков. Шкала CHA2DS2-VASc, шкала ATRIA, шкала HAS-BLED и другие.
Раздел: Статьи
/
Общая врачебная практика.
/
Кардиология.
/
Риск фибрилляции предсердий. Риск инсульта, тромбоэмболий, риск кровотечений. Интегральная оценка рисков. Шкала CHA2DS2-VASc, шкала ATRIA, шкала HAS-BLED и другие.
Содержание
- Введение
- Риск фибрилляции предсердий
- Краткосрочный прогноз
- Эффект кардиоверсии
- Риск инсультов и тромбоэмболий
- Риск кровотечений
- Интегральная оценка рисков
- Выбор антикоагулянта
- Эффективность катетерной абляции
Частота фибрилляции предсердий (ФП) в последние годы значительно возрастает, например в США за 10 лет число госпитализаций пациентов с этой аритмией увеличилось на 23% (Patel N. et al., 2014). Проблема ФП связана с прогрессирующим течением аритмии и повышением тромбообразования в ушке плохо сокращающегося левого предсердия. Как следствие возникают системные тромбоэмболии с поражением мозга, нижних конечностей, почек, сердца и других органов.
Шкала CHARGE-AF разработана на данных крупных американских исследований ARIC, CHS и FHS, валидизирована авторами на европейских данных исследований AGES и RS (табл. 1.1) (Alonso A. et al., 2013). Шкала позволяет выделить пациентов высокого риска ФП, часто бессимптомной, и включать их в программу активного мониторинга аритмии.
Хотя сама шкала CHARGE-AF не очень различала группы риска фибрилляции предсердий среди пациентов с острым инсультом, ее рекалибровка с построением обновленной модели Re-CHARGE-AF заметно улучшила прогностические возможности с С-статистикой 0,74 (Ashburner J. et al., 2021).
Таблица 1.1. Шкала CHARGE-AF

Другие шкалы. Известная фремингемская шкала FHS-AF в сравнительных исследованиях показала близкие, но чуть худшие результаты разграничения групп риска (Schnabel R. et al., 2009; Shulman E. et al., 2015; Himmelreich J. et al., 2020).
Шкала HATCH первоначально была создана для оценки риска прогрессирования пароксизмальной фибрилляции предсердий в ее постоянную форму (de Vos C. et al., 2010). Шкала была проверена в длительных исследованиях и выяснилось, что она может быть полезной для оценки появления ФП (Suenari K. et al., 2017).
Шкала C2HEST, включающая возраст ≥75 лет, наличие коронарной болезни, ХОБЛ, АГ, систолической СН и гипертиреоза, предложена для оценки риска развития ФП у лиц азиатской расы (Li Y. et al., 2019).
Модель EHR, построенная на электронных картах пациента, показала лучшее разграничение риска ФП на группе валидизации, чем шкалы CHARGE-AF и C2HEST (Hulme O. et al., 2019).
Для оценки вероятности ФП у пациентов с криптогенными инсультами предложены шкалы MrWALLETS и HAVOC (Muscari A. et al., 2017; Kwong C. et al., 2017). Ценность информации обусловлена необходимостью использования дорогостоящих устройств длительного мониторирования ЭКГ. Вместе с тем нужно убедиться в надежности этих шкал (Ntaios G. et al., 2020).
Оценить риск развития ФП после коронарного шунтирования и назначить профилактическое лечение можно с помощью шкалы, включающей возраст, анамнез АГ, ИМ и СН (Chen L. et al., 2018).
Сравнение шкал. Сравнение 14 шкал прогнозирования ФП продемонстрировало, что шкалы CHARGE-AF и MHS показали наиболее высокую частоту аритмии (1,6%) в группе с 10% пациентов высокого риска, что почти в 4 раза выше, чем общая распространенность ФП в анализируемой группе и в 25 раз выше, чем в группе с наиболее низким риском (Poorthuis M. et al., 2021). Чтобы выявить один случай ФП требуется провести скрининг 63 пациентов.
Применение шкал. Учитывая тесную связь фибрилляции предсердий и риска кардиоэмболического инсульта, эффективно предупреждаемого приемом антикоагулянтов, высокую частоту малосимптомных форм, оценка риска появления фибрилляции предсердий может иметь клиническое значение у отдельных пациентов, например, после ишемических инсульта или транзиторной ишемической атаки (ТИА) неуточненной природы.
В этих случаях представляется целесообразным выявление фибрилляции предсердий с помощью более частых регистраций ЭКГ, суточного и длительного мониторирования ЭКГ, использования мобильных электрокардиографов (например, CardioQVARK или Kardia Mobile). Таким образом, можно повысить эффективность диагностических исследований и снизить затраты.
Шкала RED-AF. Почти 40–70% пациентов, обратившихся в отделения неотложной помощи с ФП, госпитализируются. Вместе с тем лечение в стационаре мало влияет на прогноз заболевания, зато при таком подходе у пациентов пожилого и старческого возраста увеличивается риск госпитальной инфекции и делирия, снижаются когнитивные функции (Wilson R. et al., 2012).
Для более точной оценки краткосрочного риска неблагоприятных событий при ФП предложена шкала RED-AF, представленная в табл. 1.2 (Barrett T. et al., 2011). Позднее в валидизирующем исследовании авторы определили оптимальный порог в 87 баллов, выше которого высока вероятность развития неблагоприятного события в ближайший месяц (Barrett T. et al., 2015).
Таблица 1.2. Шкала RED-AF

Другие шкалы. Возможно, шкала TrOPs-BAC точнее оценивает краткосрочный риск у пациентов с фибрилляцией предсердий, нежели шкала RED-AF, поскольку основана на оценке 30-дневной смертности и учитывает большое число причин обращений в отделение неотложной помощи и повторных госпитализаций, не связанных с тахиаритмией (Atzema C. et al., 2015). Разработано два варианта шкалы — полный с 12 переменными и упрощенный с 6 переменными.
Позднее авторы на данных исследования AFTER2 предложили более привлекательную шкалу с 11 предикторами, которая позволяет прогнозировать 30-дневную смертность и сердечно-сосудистые госпитализации (Atzema C. et al., 2018).
Шкала 2MACE может обеспечить долгосрочный прогноз ССЗ (ИМ, реваскуляризация, сердечно-сосудистая смерть) у пациентов без коронарной болезни (Polovina M. et al., 2017).
Применение шкал. Пациенты группы низкого риска могут быть выписаны из отделения неотложной помощи для амбулаторного наблюдения и лечения. Целесообразность такого подхода обусловлена также необходимостью достаточного времени для титрования и подбора антиаритмической или контролирующей ЧСС терапии.
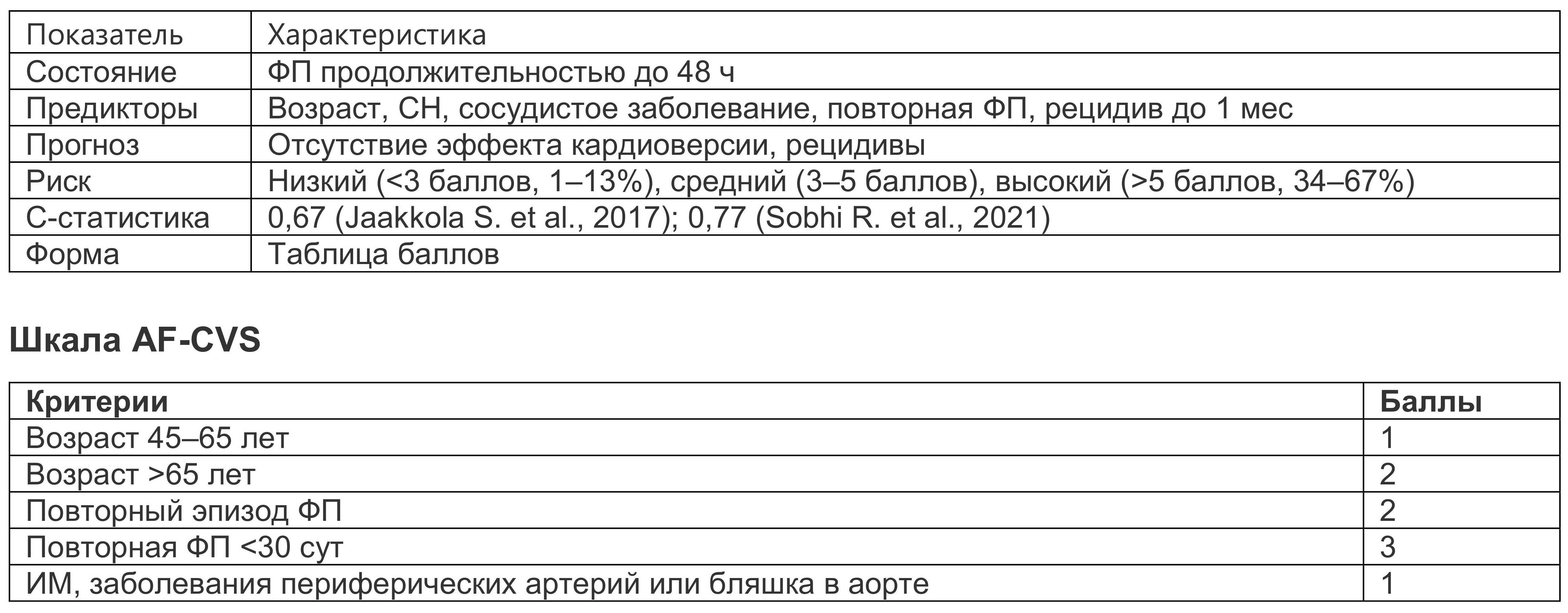
Шкала AF-CVS. Наиболее эффективным методом восстановления синусового ритма является электрическая кардиоверсия, которая требует наркоза и может сопровождаться осложнениями. Шкала AF-CVS, представленная в табл. 1.3, позволяет оценить эффективность кардиоверсии у пациентов с ФП до 48 ч и принять более точное клиническое решение ( Jaakkola S. et al., 2017).
Таблица 1.3. Шкала AF-CVS
Применение шкал. У пациентов с ФП нередко (до 60%) происходит спонтанное восстановление синусового ритма в период до 48 ч, и в таких случаях целесообразно не торопиться с проведением кардиоверсии, а ограничиться контролированием ЧСС. В случаях низкого прогнозируемого эффекта кардиоверсии может быть разумной тактика постоянного контроля ЧСС или лечение наиболее активными антиаритмическими препаратами, например амиодароном.
Шкала CHA2DS2-VASc. С целью определения риска тромбоэмболий у пациентов без митрального стеноза, искусственных клапанов и гипертрофической кардиомиопатии рекомендована и широко используется шкала CHA2DS2-VASc, включающая простые и легко определяемые показатели, представленная в табл. 1.4 (Lip G. et al., 2010). Шкала немного улучшила дискриминацию пациентов группы низкого риска по сравнению с предшествующей шкалой CHADS2 и увеличила число пациентов, которым рекомендуется терапия антикоагулянтами (Winkle R. et al., 2014).
Таблица 1.4. Шкала CHA2DS2-VASc

В последних европейских рекомендациях критерий «Н» («сердечная недостаточность») был дополнен гипертрофической кардиомиопатией наряду с клинической картиной СН и ФВЛЖ ≤40%. Вместе с тем есть основания рекомендовать оральные антикоагулянты всем пациентам с фибрилляцией предсердий и гипертрофической кардиомиопатией, независимо от возраста и шкалы CHA2DS2-VASc (Tsuda T. et al., 2019; Guttmann O. et al., 2015).
Исследование показало, что наличие коронарной болезни (стеноз ≥50%, число пораженных сосудов) увеличивает риск тромбоэмболий на 25%, независимо от других предикторов (Steensig K. et al., 2018). Поэтому в критерии «VASc» («сосудистые заболевания») включили ангиографически значимую коронарную болезнь наряду с перенесенным ИМ, заболеванием периферических артерий, сложными бляшками в аорте (≥4 мм толщиной, изъязвленные или с мобильными тромбами по данным чреспищеводной эхокардиографии).
Согласно клиническим рекомендациям, при наличии ≥2 баллов, независимо от пола, рекомендуют прием оральных антикоагулянтов, а при 0 баллов можно не назначать противотромботическое лечение.
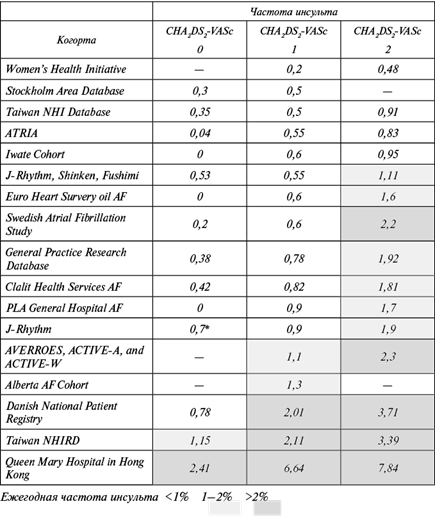
Серьезной проблемой является существенное варьирование границ повышения риска инсульта в различных группах пациентов. Например, предложенная изначально градация риска инсультов у пациентов с ФП на низкий (<1% в год), средний (1–2%) и высокий (>2%) не соответствовала реальному положению во многих исследованиях (Quinn G. et al., 2017; Shah S. et al., 2018) (рис. 1.1).
Рис. 1.1. Ежегодная частота инсульта в зависимости от шкалы CHA2DS2-VASc (Quinn G. et al., 2017)
При 1 балле оценки риска тромбоэмболий, эффективности антикоагулянтов достаточно противоречивы, что проявляет недостатки шкалы CHA2DS2-VASc (Friberg L. et al., 2015; Lip G. et al., 2015). Отличия могут быть связаны с особенностями популяции, различным прогностическим весом факторов риска (Quinn G. et al., 2017).
В китайском наблюдательном исследовании при наличии одного предиктора шкалы CHA2DS2-VASc риск инсульта варьировал от небольшого (СН, или СД, или сосудистые заболевания) до высокого — почти в 10 раз больше у пациентов с АГ (Huang D. et al., 2014). При этом риск инсульта у 60-летнего пациента с АГ был заметно ниже такового у 70-летнего без гипертензии при одинаковой величине по шкале CHA2DS2-VASc в 1 балл.
Предсказание инсульта с помощью шкалы было сопоставимым у пациентов после декомпенсации СН с сохраненной и сниженной ФВЛЖ (Berkovitch A. et al., 2019).
Показано, что возрастной порог для назначения прямых антикоагулянтов может существенно различаться в зависимости от наличия одного фактора риска: 35, 50 и 55 лет для СН, АГ и СД, сосудистых болезней (Chao T. et al., 2019).
Следует также учитывать, что артериальная гипертензия повышает риск инсульта независимо от наличия ФП. Влияние АГ, как и других факторов, может существенно различаться в зависимости от степени их контроля. Например, одна ситуация, когда у пациента с длительным анамнезом АГ имеются частые подъемы АДс более 170 мм рт.ст., и другая, когда недавно возникшее повышение АД до 142/90 мм рт.ст. хорошо контролируется малой дозой одного препарата или даже немедикаментозно. Однако шкала CHA2DS2-VASc эти вариации не учитывает. Порог возраста для повышенного риска инсульта в некоторых группах азиатов может быть ниже 65 лет (Chao T. et al., 2015).
Хотя шкала не рекомендована для пациентов с ФП и выраженными болезнями клапанов сердца, в наблюдательном исследовании показана возможность предсказывать тромбоэмболии с С-статистикой 0,62 и 0,63 соответственно для болезней клапанов 1-го и 2-го типов по Европейской ассоциации сердечного ритма (European Heart Rhythm Association) (Lip G. et al., 2019).
Следует учитывать, что митральная регургитация способна почти наполовину снизить риск образования тромбов в левом предсердии у пациентов (Van Laer S. et al., 2021).
В шкале CHA2DS2-VASc используются далеко не все факторы риска тромбоэмболий. Например, выявлена связь повышенного риска тромбоэмболий с нагрузкой (длительностью) ФП, структурой ушка левого предсердия (узкая конусовидная форма и неровный рельеф), объемом и дисфункцией левого предсердия, феноменом плотного спонтанного эхоконтрастирования в левом предсердии, синдромом обструктивного апноэ сна, показателями коагулограммы, нарушенной функцией почек и т.д.
Важно отметить, что шкала одинаково предсказывала риск ишемического инсульта как у пациентов с ФП, так и без таковой: С-статистика 0,63 и 0,67 соответственно (Siddiqi T. et al., 2022). В то же время у пациентов с имеющимся ишемическим инсультом шкала предсказывает повторный инсульт плохо с С-статистикой 0,56 (Yu I. et al., 2021).
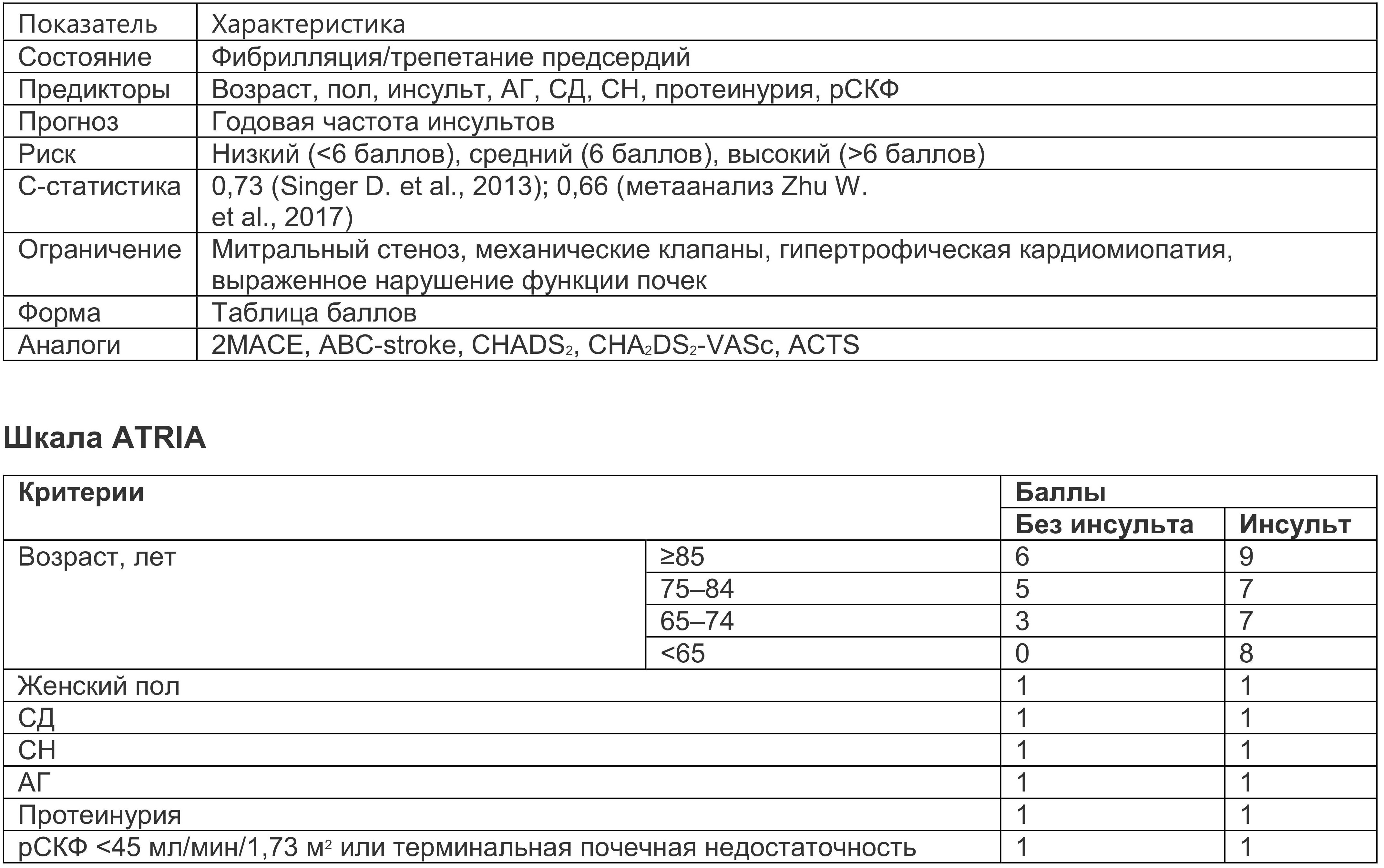
Шкала ATRIA. В ряде исследований эта показала лучшие результаты прогнозирования инсульта, чем шкала CHA2DS2-VASc (табл. 2.24) (Singer D. et al., 2013).
Таблица 1.5. Шкала ATRIA
По результатам метаанализа 6 когортных исследований, показатели С-статистики шкал ATRIA и CHA2DS2-VASc были близкими и совсем не выдающимися — 0,66 и 0,63 соответственно, при этом, по данным Z-статистики, шкала ATRIA прогнозировала инсульты и тромбоэмболии лучше, а шкала CHA2DS2-VASc была несколько точнее в оценке низкого риска (Zhu W. et al., 2017). В других исследованиях оценки прогнозирования пациентов с низким риском оказались противоречивыми (Aspberg S. et al., 2016; van den Ham H. et al., 2015).
Другие шкалы. Использовать шкалы оценки риска тромбоэмболических осложнений у пациентов с выраженной почечной недостаточностью нельзя, так как они исключались из исследований. Существуют варианты шкал риска тромбоэмболий, которые учитывают больных с нарушением функции почек (R2CHADS2), однако прогностические возможности при их применении не увеличиваются (Roldan V. et al., 2013; Banerjee A. et al., 2013).
Идут поиски способов улучшения шкалы CHA2DS2-VASc, например включение стеноза сонных артерий в критерии сосудистого заболевания значительно увеличило прогнозирование инсульта (Basili S. et al., 2017). Модифицированная шкала CHA2DS2-VASc-HSF, включающая дислипидемию, курение и семейный анамнез, позволяет прогнозировать коронарную болезнь (Modi R. et al., 2017). Добавление дисфункции почек в шкалу CHA2DS2-VASc-R позволило улучшить прогнозирование тромбоэмболий и смертность у пациентов без ФП (Parsons C. et al., 2018). У азиатов может быть более точной модификация шкалы mCHA2DS2-VASc (Chao T. et al., 2014).
Для повышения возможности разграничения групп риска в «серой зоне» предложено при шкале CHA2DS2-VASc, равной 2, использовать дополнительно шкалу смертности IMRS (Graves K. et al., 2019).
По данным нескольких крупных исследований, шкала ABC-stroke, включающая биомаркеры (NT-proBNP и высокочувствительный сердечный тропонин T), возраст, анамнез инсульта/ТИА, лучше предсказывала риск инсульта и системных тромбоэмболий, чем шкала CHA2DS2-VASc (Hijazi Z. et al., 2016; Berg D. et al., 2019).
Возможно, дополнение шкалы CHA2DS2-VASc с данными биохимических тестов по определению сердечного тропонина, мозгового натрийуретического пептида и D-димера улучшит прогнозирование тромбоэмболических осложнений (Ruff C. et al., 2016).
Среди пациентов с острым инсультом и ФП простая шкала ALESSA, включающая возраст, индекс ишемического повреждения и выраженное увеличение предсердия, позволяет выявить группу с риском рецидивов ишемических событий без кровотечений (Paciaroni M. et al., 2017). Такая оценка позволяет рано начать прием антикоагулянтов и предупредить рецидивы инсультов, которые чаще всего происходят в первые 2 нед.
Не менее важны неэмболические сердечно-сосудистые события (ИМ, смерть), риск которых увеличен у пациентов с ФП. Шкала 2MACE лучше прогнозировала риск сердечно-сосудистых событий, чем CHA2DS2-VASc, в двух разных когортах пациентов (Rivera-Caravaca J. et al., 2017).
Применение шкал. Согласно современным рекомендациям, выбор длительного лечения антикоагулянтами основан в первую очередь на оценке риска появления инсульта (рис. 1.2).
Рис. 1.2. Тактика выбора антикоагулянтов по шкале CHA2DS2-VASc
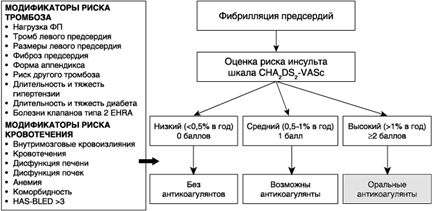
Несмотря на активное продвижение шкалы CHA2DS2-VASc в качестве основного инструмента для выбора приема антикоагулянтов, следует обратить внимание на невысокие показатели дискриминации групп риска (0,61–0,63) при ее применении, что может привести к неверному прогнозу риска и лечению. Предложение рабочей группы ESC по тромбозам по детальному ранжированию риска тромбозов и кровотечений на основании числа баллов шкал CHA2DS2-VASc и HAS-BLED довольно спорное. Предлагается выделять группы очень высокого, высокого, умеренного, низкого умеренного и низкого риска. Однако, во-первых, возрастание риска при увеличении суммы баллов не является линейным, а во-вторых, даже выделение групп низкого и высокого риска характеризуется умеренной точностью, которая, очевидно, будет ниже при дальнейшем разделении подгрупп.
Более перспективны инструменты, оценивающие соотношение польза/риск на основе учета наряду со шкалой CHA2DS2-VASc, риска кровотечений и функции почек — SPARCtool или несколько модифицированный AnticoagEvaluator для мобильных устройств, предлагаемый American College of Cardiology Foundation. Исследователи отмечают возможные неточности этих инструментов (Mayer M, 2020).
Важно помнить, что шкалы, оценивающие риск тромбоэмболий, не могут использоваться у пациентов с митральным стенозом и гипертрофической кардиомиопатией, которым в случае фибрилляции/трепетания предсердий показан варфарин даже при невыполнении критериев шкалы, что имеет место у большинства молодых людей.
Следует учитывать существенное снижение прогностических возможностей шкал при дисфункции почек. Так, у пациентов с рСКФ >60, 30–60 и <30 мл/мин/1,73 м2 C-статистика для шкалы CHA2DS2-VASc составила 0,70, 0,60 и 0,58, а для шкалы ATRIA 0,78, 0,68 и 0,66 соответственно (de Jong Y. et al., 2021).
Исследование ORBIT-AF показало, что прогноз тромбоэмболических осложнений и кровотечений с помощью шкал обладает умеренной точностью, а врачи склонны немного преувеличивать риск, предсказанный шкалами (Steinberg B. et al., 2016). Этот факт становится особенно очевидным у пациентов группы низкого риска.
Наряду с оценкой риска тромбоэмболических осложнений в случае принятия положительного решения о назначении оральных антикоагулянтов следует взвесить риск больших и фатальных кровотечений.
Шкала HAS-BLED. Чаще всего для определения риска кровотечений у пациентов с ФП рекомендуют применять шкалу HAS-BLED, представленную в табл. 1.6 (Pisters R. et al., 2010).
Таблица 1.6. Шкала HAS-BLED
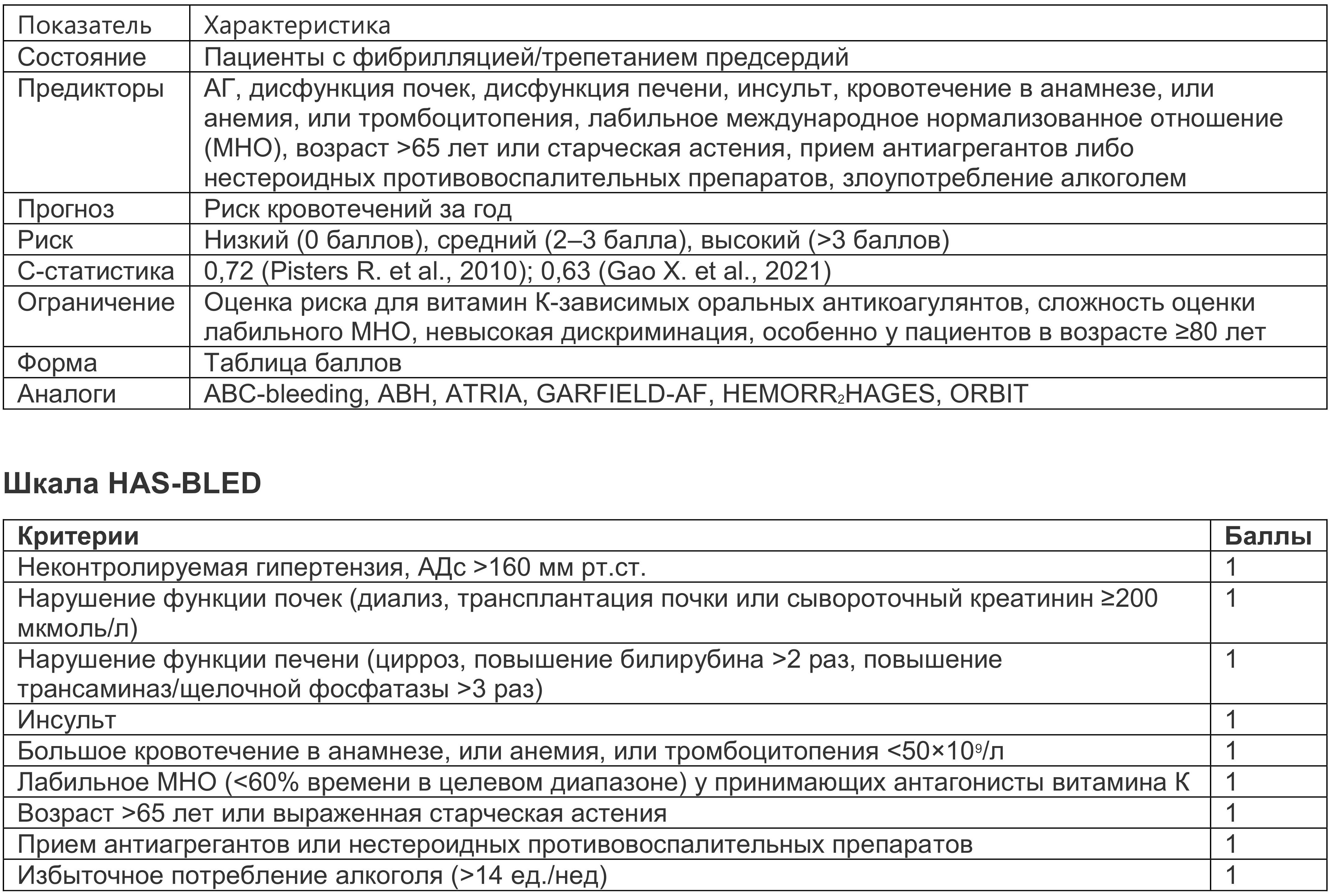
Критерии шкалы HAS-BLED изложены в трактовке последних европейских рекомендаций по ФП.
В оригинальном исследовании шкала лучше различала риски у пациентов, использовавших антиагреганты и в отсутствие приема противотромботических препаратов, немного хуже — в группе пациентов, принимавших витамин К-зависимые оральные антикоагулянты.
В отношении данной шкалы следует учитывать тот факт, что она включает оценку МНО для антагонистов витамина К.
Вместе с тем, последний метаанализ 39 исследований показал, что шкала HAS-BLED оценивала риск больших кровотечений у пациентов, принимавших антагонисты витамина К и прямые оральные антикоагулянты с одинаковой С-статистикой 0,63 (Gao X. et al., 2021). Плохая способность разграничивать группы риска, по-видимому, обусловлена неполным учетом значимых факторов риска кровотечений. Например, анализ риска внутричерепных кровоизлияний у пациентов, принимающих прямые оральные антикоагулянты, выявил ассоциацию с возрастом, антиагрегантами, активным раком, высоким риском падений, гиперхолестеринемией, низким клиренсом креатинина, болезнью периферических артерий, изменениями белого вещества мозга, но не шкалой HAS-BLED (Paciaroni M. et al., 2021).
Продолжаются активные поиски способов улучшения прогноза кровотечений. Например, для более эффективной калибровки шкалы HAS-BLED при геморрагическом инсульте предлагается увеличить число баллов до 2. Такой подход заметно повышает значение С-статистики (Nielsen P. et al., 2015).
Возможно, что шкала HAS-BLED лучше разграничивает риск кровотечений, чем другие шкалы у пациентов с ФП, но обладает невысокой предсказательной точностью, соответственно принимать значимые решения на основе нее следует с осторожностью.
Другие шкалы. Предложена простая 5-факторная шкала ORBIT (возраст старше 75 лет, сниженный уровень гемоглобина/гематокрита/анемия, кровотечение в анамнезе, нарушение функции почек, лечение антиагрегантами), которая обладает разграничительными возможностями, сопоставимыми с другими аналогичными шкалами, но, возможно, лучше, чем шкалы HAS-BLED и ATRIA, работает у пациентов, принимающих ривароксабан (O’Brien E. et al., 2015). В последних рекомендациях Национального института здоровья и клинического совершенствования (качества медицинской помощи) Великобритании (National Institute for Health and Clinical Excellence, NICE) рекомендуется предпочесть шкалу кровотечений ORBIT на основании более точного прогноза абсолютного риска кровотечения, включая внутричерепные, и лучшей специфичности.
Простая шкала ATRIA включает анемию, возраст старше 75 лет, нарушение функции почек, кровотечение в анамнезе, АГ.
Шкала ABC, включающая возраст, анамнез кровотечений и уровни биомаркеров [гемоглобина, высокочувствительного сердечного тропонина, GDF-15 (или рСКФ, или цистатин С)], может оказаться точнее шкал HAS-BLED и ORBIT (Hijazi Z., Oldgren J. et al., 2016; Berg D. et al., 2019).
Для оценки риска кровотечений у пациентов, принимающих оральные антикоагулянты и двойную антиагрегантную терапию после стентирования, может быть полезной узкоспециализированная шкала DAIGA (Kobayashi N. et al., 2016).
Использование оценки модифицируемых факторов риска может быть менее эффективным, чем оценка риска с помощью шкал (Guo Y. et al., 2018).
Сравнение шкал. Сравнительный анализ шкал кровотечений у пациентов с ФП показал лучший баланс шкалы HAS-BLED по чувствительности и специфичности относительно других инструментов (Senoo K. et al., 2016; Chao T. et al., 2018; Lip G. et al., 2018; Chang G. et al., 2020). Вместе с тем, последний большой сравнительный метаанализ показал близкие результаты шкал HAS-BLED, HEMORR2HAGES, ATRIA, ORBIT, GARFIELD-AF и ABC (Gao X. et al., 2021).
Применение шкал. Учитывая невысокие показатели различения групп риска, шкалы не должны использоваться для принятия решения об отмене антикоагулянтов. Например, у пациентов старше 80 лет С-статистика шкал кровотечений была ниже 0,6 (Jaspers Focks J. et al., 2016). Не случайно в последних рекомендациях ESC шкалы кровотечений предлагается в большей степени использовать для выделения модифицируемых факторов риска.
При высоком риске кровотечения следует тщательно оценить пользу длительной антикоагулянтной терапии. У пациентов со шкалой HAS-BLED ≥3 в случае использования варфарина можно рассмотреть использование фармакогенетического тестирования для выявления повышенной чувствительности к действию антикоагулянта (Dietz N. et al., 2020).
Регулярная оценка риска кровотечений с помощью мобильной версии шкалы HAS-BLED позволила снизить риск кровотечений и увеличить частоту приема оральных антикоагулянтов (mAFA-II).
Что делать при сочетании высокого риска тромбоэмболических осложнений с высоким риском кровотечений? Почти у 22% пациентов имеются высокие баллы по шкалам CHA2DS2-VASc и HAS-BLED (Marcucci M. et al., 2014). В этих случаях принимаются индивидуальные решения с учетом результатов исследований, которые показывают, что усредненные оценки пользы предупреждения тромбозов перевешивают риски кровотечений (Friberg L. et al., 2012; Olesen J. et al., 2011). Более того, крупнейшее датское исследование выявило, что польза антикоагулянтной терапии возрастает у пациентов с более высоким риском кровотечений.
При опасности кровотечений целесообразно рассмотреть возможность использования апиксабана, а также дабигатрана этексилата в дозе 110 мг 2 раза в сутки, ривароксабана в дозе 15 мг однократно, варфарина с целевым значением МНО, приближающимся к 2,0, или закрытия придатка левого предсердия (Jaakkola S. et al., 2018, рис. 1.3).
Рис. 1.3. Алгоритм выбора оральных антикоагулянтов. ЖК — желудочно-кишечный
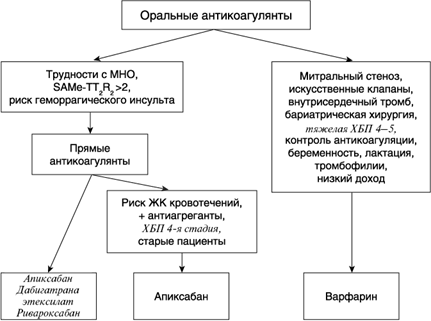
Возобновление приема варфарина у пациентов с ФП даже после желудочно-кишечного или внутричерепного кровотечения повышает выживаемость пациентов (Nielsen P. et al., 2015; Qureshi W. et al., 2014).
Важно учитывать и позицию пациентов, которые согласны перенести четыре возможных кровотечения для предупреждения одного инсульта (Lahaye S. et al., 2014).
Следует отметить, что у пациентов с высоким риском больших кровотечений часто повышаются значения по шкалам HAS-BLED и CHA2DS2-VASc (общие критерии — возраст, перенесенный инсульт, АГ) и, наоборот, при повышении риска инсульта возрастает риск кровотечения (Marcucci M. et al., 2014). Сравнительные исследования показали, что у пациентов, принимавших прямые оральные антикоагулянты, разделение на группы риска кровотечений было сопоставимым у шкал CHA2DS2-VASc, HAS-BLED, ORBIT и ATRIA (Yao X. et al., 2017). Это обстоятельство снижает необходимость использования шкалы HAS-BLED, и так обладающей невысокой предсказательной точностью (Poli D. et al., 2017).
У пациентов после стентирования коронарных артерий при наличии ФП и лечении антикоагулянтами для определения продолжительности двойной антиагрегантной терапии рекомендуют оценивать соотношение риска тромбоза и кровотечений, в том числе с использованием шкал CHA2DS2-VASc и HAS-BLED, что, однако, нельзя сделать только с помощью имеющихся инструментов прогнозирования (рис. 1.4).
Рис. 1.4. Антитромботическая терапия после стентирования у пациентов с ФП, принимающих антикоагулянты. ОАК — оральный антикоагулянт, АСК — ацетилсалициловая кислота
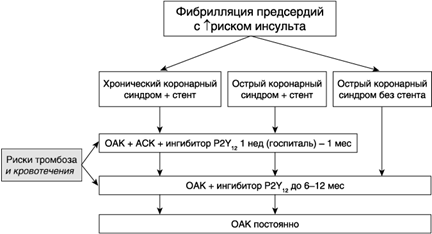
Несмотря на появление прямых оральных антикоагулянтов, прием которых связан с меньшим риском внутричерепных кровотечений, варфарин остается распространенным оральным антикоагулянтом и не может быть заменен у пациентов с механическими клапанами сердца, митральным стенозом, почечной недостаточностью, беременностью, наследственными тромбофилиями, и у людей, имеющих низкие доходы (Olesen J. et al., 2015).
Интегральная шкала GARFIELD-AF, представленная в табл. 1.7, позволяет прогнозировать не только риск инсультов и системных эмболий, но также кровотечений и смерти не хуже CHA2DS2-VASc и HAS-BLED (Fox K. et al., 2017, 2020; Proietti M. et al., 2021). Существенное число предикторов [возраст, диабет, хроническая болезнь почек (ХБП), болезнь сосудов, ЧСС] используется для прогнозирования всех неблагоприятных исходов. Шкала GARFIELD-AF хорошо проверена на независимых данных крупных исследований ORBIT-AF и датских регистров.
Таблица 1.7. Шкала GARFIELD-AF

Применение шкал. Количественное сравнение рисков инсульта/системных эмболий, кровотечений и смерти без антикоагулянтов с применением варфарина либо прямых оральных антикоагулянтов позволяет более точно взвесить целесообразность назначения и выбор того или иного антикоагулянта.
Шкала SAMe-TT2R2. Высокая стоимость и необходимость пожизненного приема, сопоставимый с варфарином профилактический эффект, отсутствие рутинного лабораторного контроля сдерживают широкое использование прямых оральных антикоагулянтов.
При выборе орального антикоагулянта может быть полезной шкала SAMe-TT2R2, которая дает возможность оценить эффективность контроля МНО и помочь выявить пациентов с хорошим контролем при лечении варфарином (0–1 балл) или с трудностями достижения оптимальной антикоагулянтной активности (≥2–3 баллов) (табл. 1.8) (Apostolakis S. et al., 2013). Неоптимальной антикоагулянтной активностью считается ситуация, при которой МНО находится в необходимом терапевтическом диапазоне менее <60–70% времени.
Таблица 1.8. Шкала SAMe-TT2R2
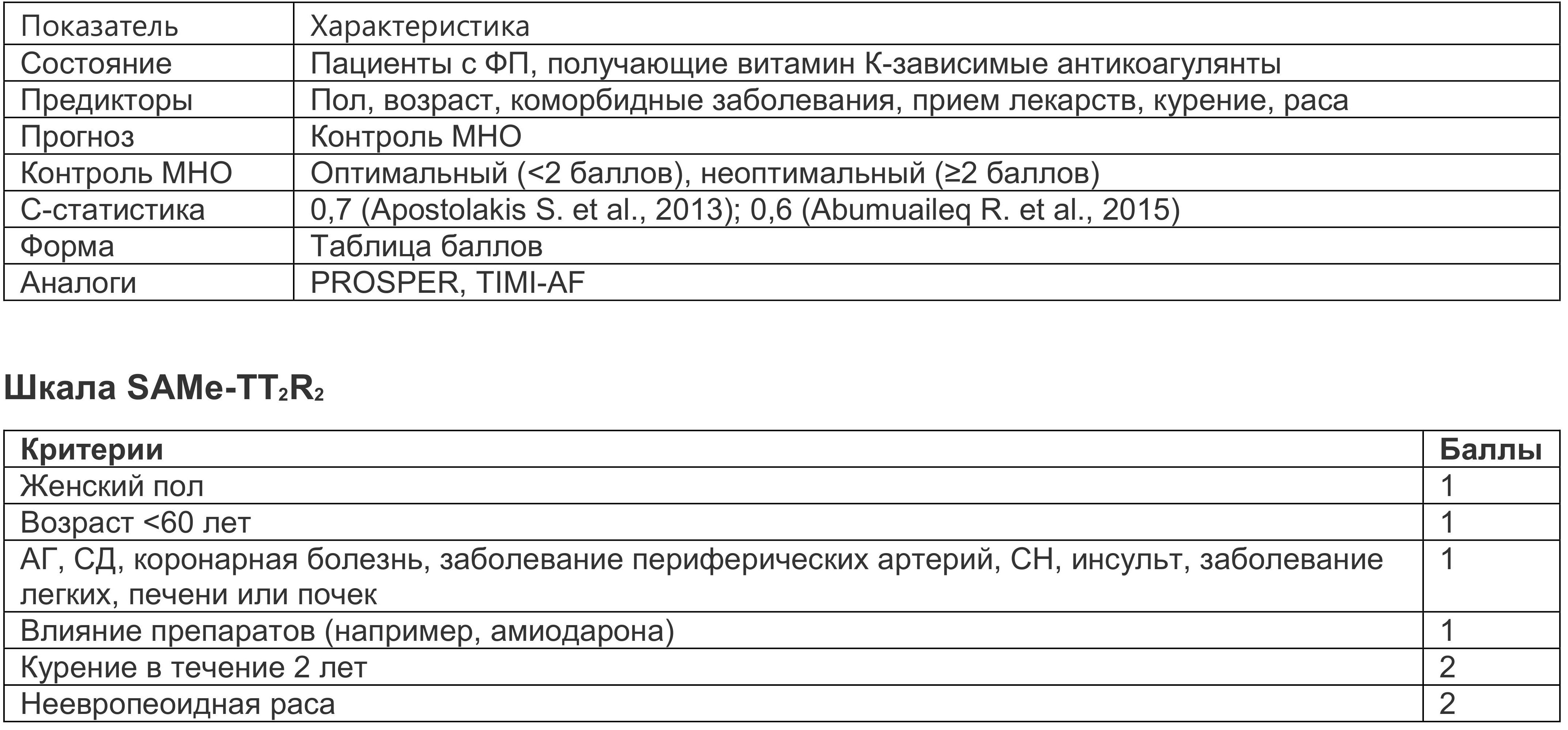
Шкала SAMe-TT2R2 позволяет предсказать повышение риска инсульта/тромбоэмболий, тяжелых кровотечений и смерти, отражающее неадекватную антикоагулянтную активность и лабильное МНО (рис. 1.5) (Abumuaileq R. et al., 2015; Esteve-Pastor M. et al., 2018).
Рис. 1.5. Прогноз в зависимости от суммы баллов по шкале SAMe-TT2R2 (Abumuaileq R. et al., 2015)
Другие шкалы. Шкала PROSPER, включающая 7 предикторов (пневмония, дисфункция почек, предшествующие кровотечения, госпитализация ≥7 сут, обезболивающие препараты, антикоагулянтная служба (anticoagulation service), прием антибиотиков) у разработчиков шкалы превзошла шкалу SAMe-TT2R2 по прогнозированию времени антикоагуляции в терапевтическом диапазоне ≥70% (С-статистика 0,67 vs 0,55), тромбоэмболиям и кровотечениям (С-статистика 0,62 vs 0,52) (Lin K. et al., 2017).
Шкала TIMI-AF, включающая возраст, пол, расу, ФВЛЖ, уровень гемоглобина, креатинина, СД, анамнез инсульта, ИМ и поражение сонных артерий, позволяет выделить подгруппу пациентов с умеренным и высоким риском инсульта, кровотечений и смерти, у которых может быть предпочтительнее применение новых антикоагулянтов (эдоксабан℘), а не варфарина (Fanola C. et al., 2017).
Сложной проблемой является назначение антикоагулянтов у пациентов с заболеваниями печени, в которой синтезируется много факторов свертывающей и противосвертывающей системы крови. Пациенты с выраженными заболеваниями печени исключались из исследований прямых антикоагулянтов, поэтому для длительного лечения данной популяции используют в основном варфарин. В этих случаях может быть полезна простая шкала, включающая уровень креатинина и альбумина плазмы, ранжирующая риск от низкого (0 баллов) до высокого (4 балла) с частотой кровотечений в 8 раз выше, чем в группе низкого риска (Efird L. et al., 2014).
Применение шкал. Пациентам с высоким риском отклонений МНО от рекомендуемого терапевтического диапазона требуются дополнительные стратегии по улучшению режима антикоагуляции, например строгая диета, использование портативных устройств для контроля МНО в домашних условиях или перевод на прямые оральные антикоагулянты (Roldán V. et al., 2015).
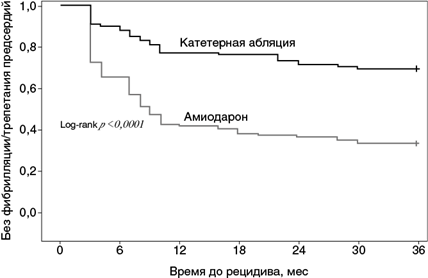
Катетерная абляция — самый эффективный метод профилактики ФП, сопровождающейся появлением клинической симптоматики (рис. 1.6). В то же время это дорогостоящая процедура, связанная с риском (6–10%) серьезных осложнений, не избавляющая пациента от необходимости приема антикоагулянтов, поэтому у пациентов — кандидатов на абляцию целесообразна оценка эффективности процедуры для принятия оптимального решения. Для оценки риска исходов восстановления синусового ритма у пациентов с ФП предложены шкалы CAAP-AF и APPLE.
Рис. 1.6. Сравнительная эффективность абляции и амиодарона у пациентов с фибрилляцией предсердий (Di Biase L. et al., 2016)
Шкала CAAP-AF позволяет оценить риск рецидивов ФП после катетерной радиочастотной абляции (табл. 1.9) (Winkle R. et al., 2016). Использование шкалы при баллонной криоабляции показало близкие частоты рецидивов тахиаритмии в зависимости от градации рисков (Sanhoury M. et al., 2017; Hamilton R. et al., 2019). В сравнительном исследовании шкала CAAP-AF также позволяла прогнозировать риски осложнений с оценкой С-статистики 0,62 (Mulder M. et al., 2021).
Таблица 1.9. Шкала CAAP-AF

Другие шкалы. Шкала APPLE, включающая возраст старше 65 лет, персистирующую ФП, рСКФ <60 мл/мин/1,73 м2, диаметр левого предсердия ≥43 мм, ФВЛЖ <50%, позволяет с умеренной точностью (С-статистика 0,62) прогнозировать рецидивы ФП в течение года после абляции (Kornej J. et al., 2015).
Для оценки риска рецидивов ФП после криоабляции на основании анализа турецкого регистра предложена шкала BASE-AF2, которая включает 6 клинических признаков, и у пациентов с суммой баллов ≥3 предсказывала высокий риск рецидивов ФП (Canpolat U. et al., 2013).
Валидизированная шкала MB-LATER возможно лучше прогнозирует поздние (>1 года) рецидивы ФП после абляции по сравнению со шкалами APPLE, BASE-AF2, HATCH (Mujović N. et al., 2017; Potpara T. et al., 2019; Kornej J. et al., 2019).
Как известно, типичное трепетание предсердий эффективно излечивается абляцией кавотрикуспидального перешейка, однако в последующие 2–3 года у 20–50% пациентов развивается ФП. Для оценки риска постабляционной ФП может быть полезной шкала HATCH (АГ, возраст ≥75 лет, ТИА или инсульт, ХОБЛ и СН), разработанная ранее для прогнозирования риска перехода пароксизмальной ФП в персистирующую (Chen K. et al., 2015). У пациентов с суммой баллов по шкале HATCH ≥2 может быть эффективна изоляция легочных вен, целесообразны тщательный мониторинг ЭКГ после процедуры и продолжение лечения антикоагулянтами.
Применение шкал. У пациентов с низким риском рецидивов ФП бывает эффективна ранняя абляция, а при высоком риске можно рассмотреть стратегию сохранения постоянной формы ФП под контролем ЧСС.
В то же время, несмотря на невысокую вероятность успеха, абляция может быть оправдана у пациентов с выраженными симптомами или развивающейся дисфункцией ЛЖ, даже при наличии большого числа факторов риска.
Катетерная абляция может улучшить исходы у пациентов с ФП и СН, однако в такой ситуации шкалы CAAP-AF и APPLE хуже разделяют группы риска, что отражается в С-статистике 0,60 и 0,54 соответственно (Black-Maier E. et al., 2019).
Выбор тактики лечения, основанный исключительно на прогнозе частоты рецидивов после абляции, не может быть единственно верным при решении вопроса о проведении абляции. Например, также важно учитывать риск периоперационных нежелательных явлений, включающих 2,5–4% больших осложнений и летальный исход в 0,15–0,4% случаев, даже в центрах с большим объемом осуществляемых вмешательств.
Следует отметить, что методика регистрация аритмии в исследованиях после абляции (ежедневные транстелефонные ЭКГ и 1–14-дневные мониторирования ЭКГ через 3 и 12 мес) не позволяет исключить наличие у пациентов частых бессимптомных и непродолжительных эпизодов ФП. Соответственно невозможность в реальной практике доказать полное исчезновение рецидивов ФП требует того, чтобы целесообразность приема оральных антикоагулянтов основывалась на оценке риска тромбоэмболических осложнений, а не на отсутствии регистрируемой ФП (Елесин Д.А. и др., 2011; Winkle R. et al., 2012; DISCERN AF; van Brabandt H. et al., 2013).
14.04.2023 | 19:52:18