Миома матки. Причины, классификация и клиника миомы матки. Диагностика и лечение миомы матки.
Раздел: Статьи
/
Акушерство и гинекология
/
Гинекология
/
Миома матки. Причины, классификация и клиника миомы матки. Диагностика и лечение миомы матки.
Содержание
Введение
Эпидемиология
Классификация миомы матки
Этиология и патогенез миомы матки
Клиническая картина миомы матки
Диагностика миомы матки
- Ультразвуковая диагностика
- Спиральная/мультиспиральная компьютерная томография
- Магнитно-резонансная томография
Лечение миомы матки
- Медикаментозное лечение
- Хирургическое лечение миомы матки
Прогноз и профилактика миомы матки
Миома матки - доброкачественная, моноклональная, капсулированная опухоль, происходящая из гладкомышечных клеток тела и шейки матки.
Миома матки - наиболее часто встречаемая доброкачественная опухоль у женщин в большинстве стран мира. В России миома матки является причиной гистерэктомии в 50-70% случаев. У 30-35% женщин миома матки диагностируется в репродуктивном возрасте.
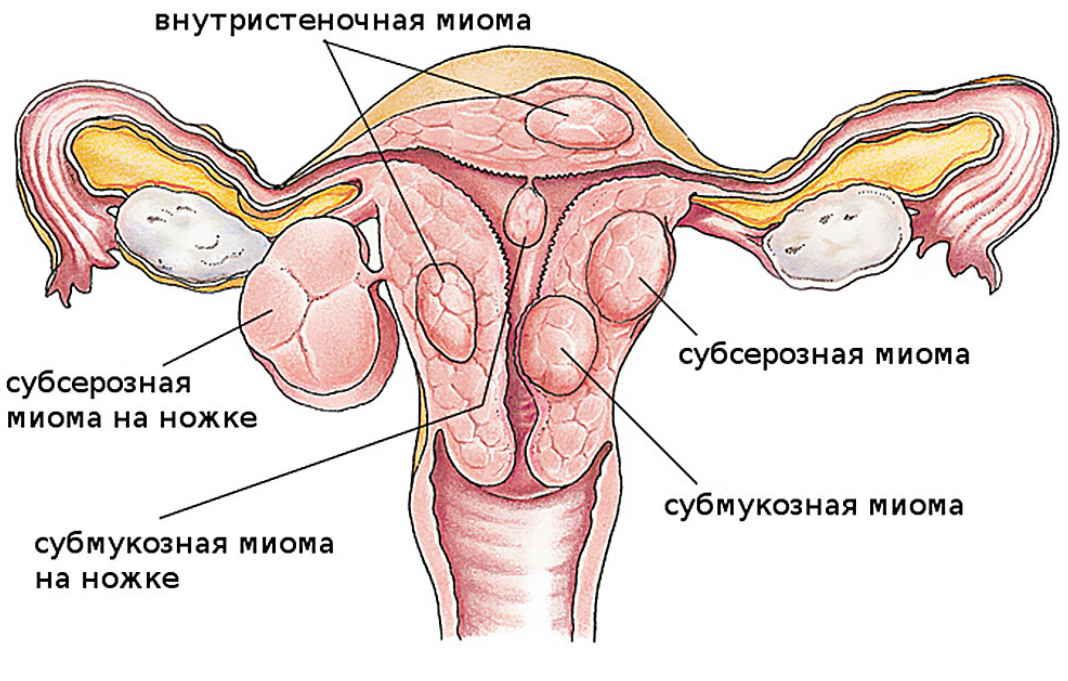
В настоящее время имеется несколько вариантов классификации миомы матки. 
Клинико-анатомическая классификация:
• интрамуральные;
• субмукозные;
• субсерозные;
• межсвязочные;
• шеечные;
• паразитарные.
В 95% наблюдений опухоль располагается в теле матки и в 5% - в ее шейке.
Классификация ВОЗ в зависимости от степени дифференцировки:
• обычная лейомиома - зрелая доброкачественная опухоль;
• клеточная лейомиома;
• причудливая лейомиома;
• лейомиобластома - эпителиоидная лейомиома;
• внутрисосудистый лейомиоматоз;
• пролиферирующая лейомиома;
• лейомиома с явлениями предсаркомы (малигнизирующаяся).
В зависимости от количества узлов миома матки может быть:
• одиночной;
• множественной.
Согласно третичной классификации FIGO:
• тип 1 и тип 2 - определенная часть опухоли расположена интрамурально:
♢ тип 1 - <50%;
♢ тип 2 - 50% и более;
• тип 3 - располагается вне ее полости, но тесно примыкает к эндометрию;
• тип 4 - интрамуральная миома расположена в толще миометрия, но не простирается до границ с эндометрием или с серозной оболочкой матки;
• типы 5-7 - субсерозные опухоли представляют собой как бы зеркальное отражение классификации субмукозной опухоли:
♢ тип 5 включает интрамуральный компонент по крайней мере на 50%;
♢ тип 6 - <50% опухоли располагается интрамурально;
♢ тип 7 - опухоль соединяется с серозной оболочкой с помощью ножки;
• тип 8 - «паразитарная» миома матки, которая может прирастать к кишечнику, сальнику или брыжейке, теряя свое первичное кровоснабжение от матки.
При наличии нескольких миоматозных узлов первым упоминается тот, что связан с эндометрием, и вторым - связанный с серозной оболочкой матки (например, 2-5).
Факторы, потенциально связанные с генезом опухоли:
1) предрасполагающие или факторы риска;
2) инициаторы;
3) промоутеры;
4) эффекторы.
Факторы риска миомы матки (предрасполагающие)
Наличие генетической предрасположенности к возникновению миомы матки косвенно подтверждается этническим и семейным характером заболевания.
Риск заболеваемости миомой матки выше у нерожавших женщин.
Гипотеза основополагающей роли эстрогенов в патогенезе миомы матки подтверждается клиническими исследованиями, оценивавшими эффективность лечения миомы матки агонистами ΓнРΓ, на фоне которых наблюдается гипоэстрогенемия, сопровождаемая регрессом миоматозных узлов.
Клинические и лабораторные исследования свидетельствуют о том, что и эстрогены, и прогестерон могут быть важными стимуляторами роста миомы.
Симптомы, характерные для миомы матки, наблюдаются у 20-50% женщин, их характер и выраженность зависят от размеров и локализации опухоли.
При субсерозной миоме на широком основании симптомы, как правило, отсутствуют.
Шеечно-перешеечная локализация миоматозного узла визуализируется при влагалищном исследовании сглаживанием передней, задней губы либо всей шейки со смещением наружного зева к противоположной локализации узла стенке таза.
Расположение субсерозного или интерстициального узла в области перешейка может приводить к изменению и нарушению функции мочеиспускания за счет сдавления и нарушения иннервации мочевого пузыря. При перешеечной локализация узел исходит из боковых отделов шейки матки. Мочеточник бывает сложно катетеризировать до операции, он может быть распластан на узле. Субсерозная миома иногда отслаивает брюшину от задней поверхности передней брюшной стенки, вызывая при вхождении в брюшную полость опасность ранения мочевого пузыря.
Узел, исходящий из задней губы шейки матки, часто растет в сторону прямой кишки и вызывает ее сдавление с появлением запора, изредка - лентообразного кала. При интралигаментарной локализации миомы возможно развитие гидроуретера, гидронефроза и пиелонефрита. Узлы опухоли могут сдавливать крестцовые нервы и вызывать корешковую боль - так называемый вторичный ишиас. Параметральный рост миомы также вызывает болевую симптоматику, так как давит на сплетения, возможно нарушение кровообращения в области малого таза, развивается венозный застой, а также тромбоз вен малого таза и нижних конечностей.
При наличии миоматозного узла, расположенного по задней стенке тела матки, самым частым клиническим симптомом является ноющая боль в крестце и пояснице. Интерстициальные миомы нарушают сократительную способность миоме-трия, увеличивают и деформируют полость матки и площадь эндометрия. При этом утолщается срединный слой миометрия, нарушается микроциркуляция и как результат возникают длительные и обильные маточные кровотечения.
Причинами обильных кровотечений, кроме названных выше, могут быть образование сосудов эндотелиального типа в процессе роста миомы, венозный застой при опущении «отяжелевшей» матки, нарушение кровообращения в толще миометрия вследствие расширения венозных сплетений мио- и эндометрия в сочетании с усилением артериального кровоснабжения, появление ГЭ как следствия «стимуляции потреблением», вторичные изменения в системе гемостаза и субмукозная локализация миоматозного узла. АМК наиболее характерны для быстрорастущей и субмукозной миомы.
Для субмукозных узлов, деформирующих полость матки (I типа), и узлов на ножке (0 типа) типичны периодически возникающая схваткообразная боль внизу живота, а также появление жидких выделений с ихорозным запахом из влагалища. Боль и выделения усиливаются в период менструации. После ее окончания, когда шейка матки частично закрывается, клинические симптомы ослабевают.
Болевой синдром у каждой третьей больной миомой матки проявляется в виде вторичной дисменореи, схваткообразной боли при субмукозном расположении узла, ноющей боли при быстром росте, больших размерах, межсвязочном расположении опухоли, сдавлении соседних органов, дегенеративных изменениях в узле и сопутствующих воспалительных заболеваниях половых органов.
При перекруте ножки субсерозного узла развивается клиническая картина острого живота.
В ряде случаев прослеживается отягощенная наследственность по наличию миомы матки у близких родственников.
Онкологическую настороженность должны вызывать женщины, вступающие в менопаузу с большими размерами опухоли, узлами субмукозной локализации или с центрипетальным ростом, с рецидивирующей и атипической гиперплазией эндометрия, при сочетании миомы матки и аденомиоза II-III степени, при отсутствии регресса миомы на фоне длительной возрастной инволюции матки. Этот вариант особенно опасен в отношении развития саркомы.
Ультразвуковая диагностика
Ультразвуковое исследование с помощью трансабдоминального и трансвагинального датчиков является методом первичной диагностики миомы матки и динамического наблюдения за развитием опухолевого процесса, выбора лечебного воздействия.
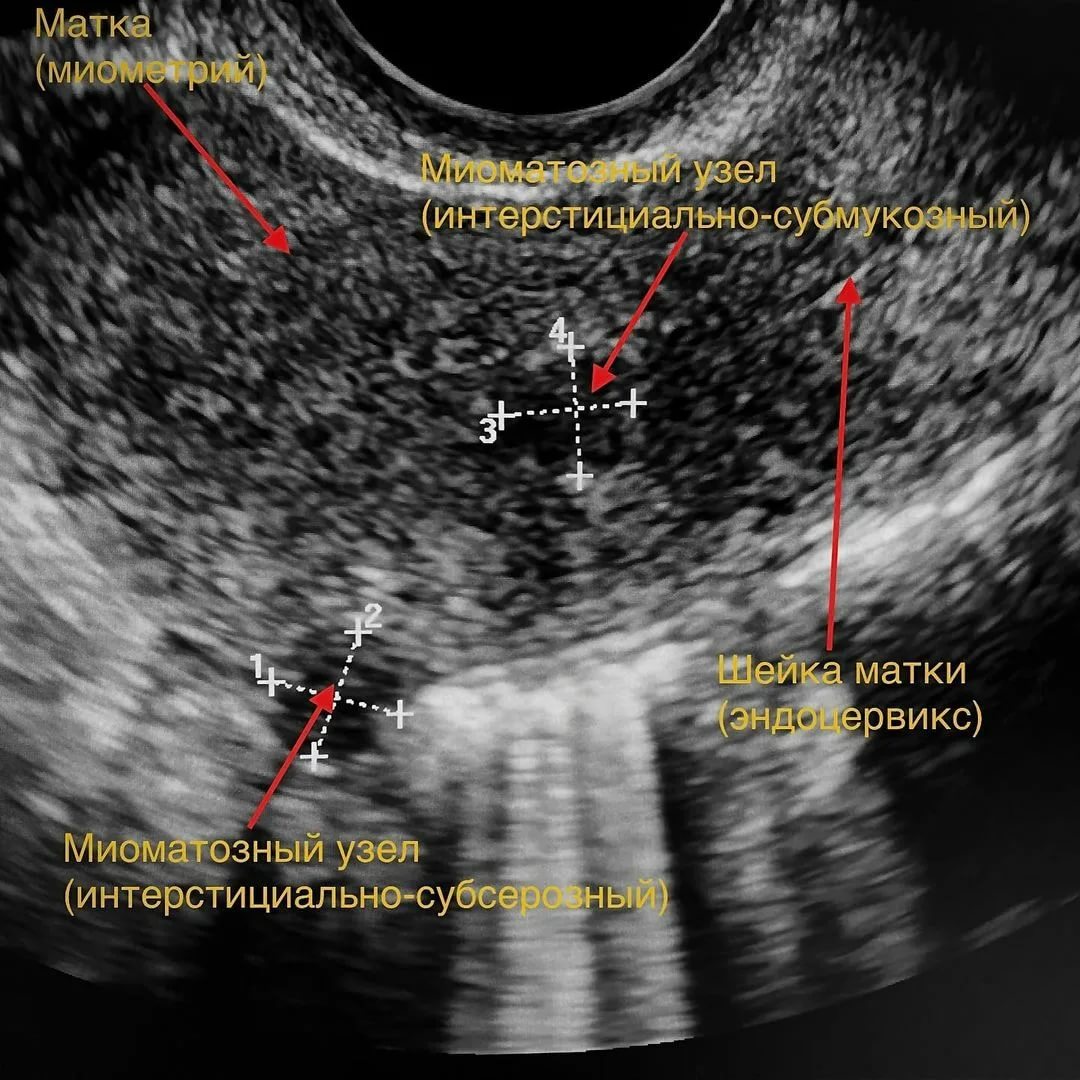
При цветовом допплеровском картировании оценивают качественные и количественные параметры его кровотока.
Компьютерная томография и магнитно-резонансная томография в диагностике миомы матки
Спиральная/мультиспиральная компьютерная томография
При спиральной КТ с контрастным внутривенным усилением миому определяют в виде мягкотканного образования, вызывающего деформацию и/или выпячивание за пределы наружного контура матки или деформирующего полость матки. Миомы матки имеют четко очерченную капсулу и однородную структуру с мягкотканной плотностью - 40-60 HU.
При мультисрезовой спиральной КТ миом с введением рентгеноконтрастных средств можно получить данные о состоянии сосудов малого таза, что очень важно для выявления основного питающего сосуда при планировании рентгенохирургического лечения миомы эмболизацией маточной артерии.
Множественная миома определяется в виде единого конгломерата мягкотканной плотности с ровными четкими контурами, овальной формы с гомогенной внутренней структурой. При больших миомах можно наблюдать сдавление и деформацию мочевого пузыря, мочеточников. При развитии дегенеративно-некротических изменений структура миомы становится неоднородной, с зонами пониженной плотности вследствие нарушения кровоснабжения. При субмукозных миомах в центре матки определяют мягкотканное образование, повторяющее конфигурацию полости матки. Контуры его ровные, четкие, окружены гиподенсивным ободком эндометрия, оттесненным узлом. В паренхиматозную фазу контрастирования миоматозный узел четко выделяется на фоне окружающего миометрия. Нередко в миоматозных узлах образуются кальцинаты в виде единичных вкраплений и массивных участков.
Магнитно-резонансная томография
Миоматозные узлы на магнитно-резонансных томограммах представлены образованиями с четкими границами, с ровными или слегка бугристыми контурами.
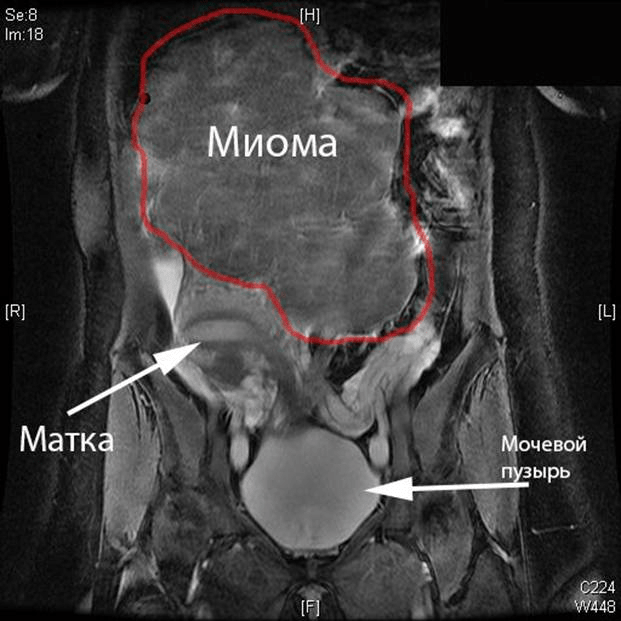
При МРТ органов малого таза, независимо от фазы цикла, можно выявить 5 типов миоматозных узлов:
1) c однородным гипоинтенсивным магнитно-резонансным сигналом, аналогичным скелетным мышцам;
2) c неоднородной преимущественно гипоинтенсивной структурой, но с участками гиперинтенсивных включений за счет дегенерации с формированием отека и гиалиноза;
3) c изоинтенсивным магнитно-резонансным сигналом, аналогичным ткани миометрия, за счет малого содержания коллагена;
4) c высоким магнитно-резонансным сигналом за счет кистозной дегенерации;
5) c варьирующим магнитно-резонансным сигналом на Т2-ВИ и высоким, с различной степенью интенсивности - на Т1-ВИ при дегенеративных изменениях с кровоизлиянием.
Миомы с дегенеративными изменениями (гиалиновые, кистозные) имеют характерный пятнистый или гомогенный вид с неоднородным по интенсивности сигналом. При кальцификации миома выглядит как образование с равномерно высокой интенсивностью сигнала, четко очерченное кольцом низкой интенсивности от окружающего миометрия.
Медикаментозное лечение
Общие рекомендации
• Улипристала ацетат в дозе 5 мг в день при назначении в течение 3 мес представляет эффективное лекарственное средство для лечения симптомной миомы матки у женщин репродуктивного возраста в целях их подготовки к хирургическому лечению (уровень доказательности А) и с 2016 г. разрешен для курсовой (4 курса) консервативной терапии миомы матки. Улипристала ацетат является селективным модулятором прогестероновых рецепторов и оказывает непосредственное воздействие на миому матки, подавляя пролиферацию клеток и индуцируя в них апоптоз, что способствует значительному уменьшению размеров узлов миомы. Курсовая терапия позволяет отсрочить или избежать оперативного лечения.
• Агонисты ГнРГ служат эффективным средством для предоперационного лечения пациенток с симптомной миомой матки, необходимым для уменьшения размеров миомы в целях облегчения выполнения оперативного вмешательства эндоскопическим или трансвагинальным путем и восстановления уровня гемоглобина (уровень доказательности А). Достаточная длительность предоперационного лечения ограничивается 3 мес (уровень доказательности В).
• Использование тиболона в качестве поддерживающей терапии не снижает эффективность терапии и предпочтительнее по сравнению с приемом эстрогенсодержащих препаратов (уровень доказательности А).
• Антагонисты ГнРГ не одобрены для лечения миомы матки. Препараты данной группы не противопоказаны при использовании ВРТ при миоме матки (уровень доказательности С).
• Прогестагены не должны использоваться для лечения миомы матки, но могут применяться в течение короткого периода времени или периодически для лечения аномальных маточных кровотечений (уровень доказательности C).
• Использовать мифепристон 50 мг (антигестаген) в качестве самостоятельной медикаментозной терапии миомы матки в течение 3 мес для торможения роста опухоли и уменьшения размеров миоматозных узлов, а также в сочетании с органосохраняющими методами лечения [перед миомэктомией - для облегчения оперативного вмешательства, после миомэктомии - для увеличения безрецидивного периода (уровень доказательности С)].
• Левоноргестрел-внутриматочная система (ЛНГ-ВМС) может использоваться для лечения тяжелых маточных кровотечений, связанных с миомой матки, и значимо снижает величину кровопотери (уровень доказательности B).
• ЛНГ-ВМС имеет относительные противопоказания при субмукозной миоме матки вследствие возможной экспульсии и неэффективного лечения маточных кровотечений (уровень доказательности С).
Нестероидные противовоспалительные средства НПВС снижают активность циклооксигеназы-2 и уровень простагландинов, содержание которых повышено у женщин с избыточной менструальной кровопотерей. Кроме того, они эффективны при дисменорее.
Наиболее широко используют ацетилсалициловую кислоту, диклофенак, ибупрофен, флурбипрофен, кетопрофен, напроксен, тиапрофеновую кислоту, индометацин, фенилбутазон, пироксикам, мелоксикам, целекоксиб. Транексамовая кислота
В качестве негормональных препаратов 1-й линии при АМК применяют антифибринолитики, в частности транексамовую кислоту (Транексам*).
Оптимальная суточная доза 3,9-4,0 г, длительность приема до 5 дней.
Прогестагены
Прогестагены оказывают центральное действие, блокируя гипоталамо-гипофизарно-яичниковую ось, уменьшая секрецию стероидных гормонов яичниками и вызывая децидуализацию эндометрия и секреторную трансформацию эпителиальных клеток, что приводит к его атрофии.
Применяются внутриматогный и пероральный способы лечения прогестагенами.
Пероральный - в циклическом и 21-дневном режиме.
При наличии субмукозной миомы матки терапия прогестагенами нецелесообразна.
Агонисты гонадотропин-рилизинг-гормона
Длительность предоперационного лечения ограничивается 3 мес (уровень доказательности Б).
Существуют различные классы лигандов рецепторов прогестерона:
• агонисты прогестерона (прогестерон и прогестагены);
• антагонисты прогестерона (антипрогестины или антигестагены - мифепристон);
• вещества со смешанным действием агонистов и антагонистов прогестерона (селективные модуляторы рецепторы прогестерона: улипристала ацетат).
Селективные модуляторы рецепторов прогестерона подавляют рост лейомиомы матки и могут приводить к ее регрессии.
Хирургическое лечение миомы матки
Показания к хирургическому лечению
Обильные менструальные кровотечения, хроническая тазовая боль, нарушение нормального функционирования соседних с маткой внутренних органов, большой размер опухоли (более 12 нед беременной матки), быстрый рост опухоли (увеличение более чем на 4 нед беременности в течение 1 года), рост опухоли в постменопаузе, подслизистое расположение узла миомы, межсвязочное и низкое (шеечное и перешеечное) расположение узлов миомы; нарушение репродуктивной функции, бесплодие при отсутствии других причин.
В плановом порядке хирургическое лечение выполняют в I фазу менструального цикла (5-14-й день). Экстренная операция необходима при спонтанной экспульсии («рождении») подслизистого миоматозного узла, при дегенеративных изменениях в опухоли вследствие нарушения кровообращения, сопровождаемых признаками инфицирования и возникновением симптоматики «острого живота», а также при неэффективности проводимой антибактериальной и противовоспалительной терапии.
Объем хирургического лечения
Окончательное решение об объеме операции и доступе должна принимать сама пациентка совместно с хирургом (лечащий врач), подписывая информированное согласие на операцию и осведомление о возможности осложнений. Гистерэктомия
Единственным приводящим к полному излечению (радикальным) способом хирургического лечения является операция в объеме тотальной гистерэктомии - экстирпация матки (уровень доказательности IA). Субтотальная гистерэктомия (надвлагалищная ампутация матки) не является полностью радикальным вмешательством, но ее можно выполнять после подтверждения состояния шейки матки (кольпоскопия, биопсия при показаниях) (уровень доказательности IA). При сочетании с аденомиозом, учитывая отсутствие четкой границы заболевания, надвлагалищная ампутация не рекомендуется, так как возможно неполное удаление указанных выше патологических процессов, что в дальнейшем может быть причиной еще одной более сложной операции (удаление культи шейки матки и других тазовых органов - дистального отдела мочеточника).
При гистерэктомии, учитывая высокий удельный вес патологических процессов в маточных трубах и их роль в развитии РЯ, необходимо оценить состояние маточных труб и ставить вопрос об удалении. Однако надо иметь в виду возможность снижения функции яичников в связи с нарушением их кровоснабжения.
Доступ
Наилучшим оперативным доступом для удаления матки является влагалищный доступ. При отсутствии условий для выполнения влагалищной гистерэктомии следует проводить лапароскопическую гистерэктомию. Лапаротомическая гистерэктомия необходима лишь небольшому числу больных с опухолями чрезвычайно больших размеров (более 24 нед и 1500 г), а также при наличии противопоказаний к проведению эндоскопической операции. Вне зависимости от доступа при тотальной гистерэктомии следует использовать интрафасциальную технику, позволяющую максимально сохранить интеграцию между тазовой фасцией и поддерживающим связочным аппаратом матки.
Миомэктомия
Показанием к миомэктомии является бесплодие или невынашивание беременности при отсутствии каких-либо других причин, кроме миомы матки, а также желание пациентки сохранить матку. Имеются сведения об улучшении результатов ВРТ после миомэктомии у женщин с неуточненным бесплодием.
Доступ
Подслизистые миоматозные узлы (0-II типа ESGE), не превышающие в диаметре 5-6 см, удаляют гистероскопически с помощью моноили биполярного резектоскопа или внутриматочного морцеллятора. При технической невозможности полного удаления узла II типа возможно выполнение миомэктомии в два этапа (двухэтапная операция). В течение 3-месячного перерыва между этапами больной назначают терапию улипристала ацетатом или агонистами ГнРГ, способствующую уменьшению матки и миграции неудаленных остатков узла в полость матки.
Больным с единичными миоматозными узлами субсерозной и интерстициальной локализации даже при значительных их размерах (до 20 см), с множественными субсерозными узлами целесообразно проводить лапароскопическую миомэктомию.
Лапароскопическую миомэктомию можно сочетать с гистероскопической у больных с ассоциацией субсерозных и субмукозных узлов. Морцелляцию миоматозных узлов в брюшной полости, по возможности, следует проводить в специальных контейнерах в целях профилактики контаминации опухоли. Обязательно выполнение гистологического исследования удаленного материала.
При множественных интерстициальных миомах (чаще больших размеров) или ассоциациях множественных узлов различных локализаций целесообразно проводить лапаротомическую миомэктомию.
Во всех случаях рождающихся или родившихся подслизистых опухолей миомэктомию проводят влагалищным доступом. При наличии единичных субсерозных и межмышечных узлов, располагающихся на задней стенке матки или в ее дне, можно выполнить миомэктомию влагалищным доступом через заднее кольпотомное отверстие. Таким способом можно удалять миомы диаметром до 8-12 см, используя технику фрагментации узлов. Влагалищный доступ является наиболее подходящим для миом, локализующихся частично или целиком во влагалищной части шейки матки.
Важно после миомэктомии, выполненной любым доступом, соблюдать основные правила зашивания стенки матки - послойно, не оставляя «мертвых» пространств, которые способствуют образованию гематомы и других осложнений операции. Целесообразно использование гемостатических губок, ареактивного шовного материала, а главное - принципов микрохирургической техники: увлажнение тканей, адекватная коагуляция, гемостаз.
Вспомогательные хирургические технологии
Для уменьшения интраоперационной кровопотери используют как сосудосуживающие агенты, так и разнообразные способы механической окклюзии сосудов, снабжающих матку. При применении данных мер необходимо предупредить анестезиолога, учитывая сосудистый эффект - повышение АД.
Для профилактики спаек применяют барьерные способы в виде биопленок, спреев, гелей, растворов, обеспечивающих временное отграничение раны от прилежащих к ней анатомических структур.
Доказана важность применения кондиционирования брюшной полости во время эндоскопической операции с контролируемым режимом температуры, влажности и дополнительным использованием кислорода.
Послеоперационное ведение
Отказ от половой жизни в течение 1,5-2 мес. Регулярное проведение цитологического исследования шеечного эпителия. Динамическое УЗИ. Предохранение от беременности в течение 6-12 мес. Беременеть разрешается в среднем через 1 год.
Эмболизация маточных артерий
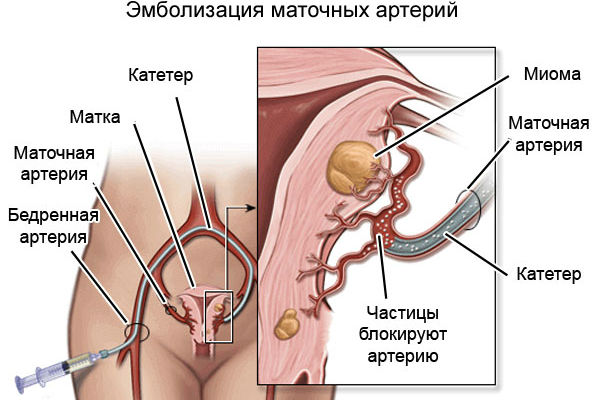
• при лечении миомы матки;
• для остановки кровотечения при неоперабельных злокачественных новообразованиях;
• для предоперационной деваскуляризации сосудистых опухолей и артериовенозных аномалий в целях облегчения их удаления и уменьшения кровопотери.
Показания к эмболизации маточных артерий
I. Самостоятельный метод лечения:
1) маточное кровотечение у больных:
¤ с миомой матки;
¤ с миомой матки в сочетании с аденомиозом;
2) лечение миомы, имеющей следующие клинические проявления:
¤ мено- и метроррагия, приводящая к железодефицитной анемии;
¤ размер миомы, соответствующий 14-20 нед беременности;
¤ нарушение функции соседних органов (учащенное мочеиспускание, никтурия, острая задержка мочи, хронический запор);
¤ нарушение сексуальной функции (диспареуния);
3) неэффективность гормональной терапии:
¤ агонистами ЛΓ-РΓ у пациенток с миомой матки;
¤ различными препаратами у пациенток с миомой матки, сочетающейся с аденомиозом (КОК, гестагены, антигонадотропные препараты);
4) рецидив миомы матки после миомэктомии;
5) невозможность других органосохраняющих методов лечения;
6) у пациенток с миомой матки, требующей оперативного лечения, имеющих IV степень операционно-хирургического риска из-за тяжелых экстрагенитальных заболеваний;
7) у пациенток при наличии показаний к гистерэктомии с высоким риском интра- и послеоперационных осложнений вследствие:
¤ многократных (3 и более) хирургических вмешательств на органах брюшной полости и малого таза в анамнезе; ¤ ожирения IV степени (ИМТ ≥30);
¤ декомпенсированного сахарного диабета.
II. ЭМА также проводится как подготовительный этап перед миомэктомией, осуществляемой различными доступами: трансцервикальным (биполярная гистерорезекция), лапароскопическим, лапаротомическим.
Противопоказания для эмболизации маточных артерий у пациенток с миомой матки
I. Гинекологические:
a) абсолютные:
1) острые и хронические воспалительные заболевания органов малого таза;
2) атипическая гиперплазия эндометрия и эндоцервикса;
3) Рак эндометрия и рак шейки матки;
4) опухоли яичников и рак яичников;
5) подозрение на саркому матки;
6) рост миомы матки в постменопаузе;
7) быстрый рост миомы в репродуктивном периоде;
b) относительные:
1) единичные субсерозные узлы 0 и I типа, которые имеют условия для проведения лапароскопической миомэктомии;
2) единичные субмукозные узлы, которые могут быть удалены методом трансцервикальной механической миомэктомии при 0 или I типе узла или методом гистерорезекции при I или II типе субмукозной миомы;
3) размер миомы матки свыше 20 нед беременности.
II. Общесоматические:
1) острая или хроническая почечная недостаточность;
2) аллергическая реакция на йодсодержащие контрастные среды.
Механизм эндоваскулярного лечения Три стадии морфологических изменений в неизмененном миометрии и миоматозных узлах после ЭМА, которые клинически соответствуют раннему, позднему и отсроченному постэмболизационному периоду.
I стадия:
♢ острая ишемия миометрия;
♢ инфаркт миоматозных узлов. Длится от 1 до 3-4 нед и обусловливает развитие постэмболизационного синдрома в ближайшие сутки после ЭМА.
II стадия:
♢ частичное восстановление микроциркуляции неизмененного миометрия;
♢ деструкция и фиброз миоматозных узлов. Продолжительность от 2 до 6 мес - клинически происходит уменьшение матки и миоматозных узлов, исчезает патологический симптомокомплекс, свойственный миоме матки.
III стадия:
♢ полное восстановление микроциркуляции неизмененного миометрия;
♢ кальциноз или лизис миоматозных узлов.
За 6-12 мес заканчиваются морфологические трансформации в тканях, происходит максимальное уменьшение матки и узлов и, как следствие, завершается процесс изменения топографии узлов. В эти сроки создаются оптимальные условия для проведения ранее невозможных абдоминальных или транс-цервикальных миомэктомий с минимальной хирургической травмой.
Формы постэмболизационного синдрома в раннем послеоперационном периоде:
1) болевая;
2) метаболическая;
3) латентная.
Клинические проявления болевой формы следующие.
• Острые боли внизу живота различной степени выраженности продолжительностью от 1 до 5 ч. Наиболее выражены при использовании эмболов мелкого диаметра и йодсодер-жащих рентгеноконтрастных сред.
• Субфебрилитет, лейкоцитоз до 9-10 тыс./мкл, а также незначительное повышение скорости оседания эритроцитов (СОЭ) у 1/3 пациенток.
• К редким симптомам относятся тошнота (15%), рвота (1,7%), дизурия с атонией мочевого пузыря (0,8%).
Метаболическая форма развивается на 3-и сутки после ЭМА и длится от 7 до 14 дней.
Клинические проявления метаболической формы:
• тахикардия 90-110 в минуту;
• озноб;
• боли внизу живота продолжительностью до 5-7 дней;
• длительная гипертермия гектического характера;
• лейкоцитоз с одновременным сдвигом формулы до юных форм и появлением палочкоядерных и сегментоядерных нейтрофилов, увеличение СОЭ до 22-50 мм/ч;
• повышение белков острой фазы воспаления, уровня пролактина.
Латентная форма постэмболизационного синдрома характеризуется слабовыраженными клиническими признаками или их полным отсутствием при наличии изменений в лабораторных, биохимических или гормональных анализах крови.
Возникновение постэмболизационного синдрома следует расценивать как закономерную реакцию организма на морфо-функциональные изменения, которые происходят вследствие вмешательства.
Профилактика болевых ощущений после ЭМА должна начинаться в предоперационном периоде.
Премедикация перед эндоваскулярной ЭМА при лечении миомы должна проводиться за 20-30 мин и включать использование ненаркотических анальгетиков центрального действия (трамадол ) и др. и транквилизаторов [бромдигидрохлорфенилбензодиазепин (Феназепам*), диазепам (Седуксен*, Реланиум*) и др.].
• Коррекция болевой формы.
1. Обезболивание:
¤ перидуральная анестезия в течение 6-12 ч; или
¤ наркотические анальгетики в первые сутки;
¤ ненаркотические анальгетики (трамадол, метамизол натрия);
¤ противовоспалительная терапия [кеторолак (Кеторол*), лорноксикам (Ксефокам), диклофенак и др.).
2. Инфузионная терапия в объеме инфузии 800-1200 мл в течение 1 сут.
3. Антибактериальная терапия до 5 сут после вмешательства (антибиотики широкого спектра действия).
4. Πротивопротозойные препараты (метронидазол, орни-дазол).
5. Πрофилактика тромбоэмболических осложнений: ¤ эластическая компрессия нижних конечностей;
¤ введение низкомолекулярных гепаринов [надропарин кальция (Фраксипарин*), эноксапарин натрия (Клексан*)] продолжительностью до 5 сут;
¤ прием дезагрегантов [ацетилсалициловая кислота (Тромбо-АСС*, Аспирин*)] до 30 сут после эндоваскулярной операции.
В целях профилактики эмболизации базальных артерий, питающих эндометрий в послеоперационном периоде, целесообразно использовать:
• ангиопротекторы (пентоксифиллин);
• низкомолекулярные гепарины [надропарин кальция (Фраксипарин*), эноксапарин натрия (Клексан*)];
• антиоксиданты (витамин Е, витамин С).
Снятие давящей повязки с места пункции и катетеризации (бедренная артерия) осуществляется через 4 ч. Активизация больных проводится не ранее чем через 9 ч. Рекомендуемый объем потребляемой жидкости должен составлять 2000 мл/сут в течение 2-4 нед после ЭМА.
Исходы ЭМА в отдаленном послеоперационном периоде.
1. Матка и миоматозные узлы уменьшаются. После 1-1,5 года наблюдения матка не превышает 12 нед беременности. Пациентку снимают с динамического наблюдения.
2. В различные сроки наблюдения возможна самопроизвольная экспульсия узла (или одного из узлов) или его лизис.
3. Создаются условия для миомэктомии различными доступами - трансцервикальным или абдоминальным (лапароскопическим или лапаротомическим).
Миграция миоматозных узлов происходит по следующим направлениям в зависимости от исходной топографии: в полость матки выделяются субмукозные узлы любых размеров, меняя свой тип с II на I или 0, а также интерстициальные узлы с центральным или центрипетальным типом роста при размерах, превышающих диаметр 5 см.
Если после ЭМА формируется 0 или I тип субмукозной миомы, проводится трансцервикальная миомэктомия механическим способом, если I или II тип - трансцервикальная резекция миомы.
Определяющими факторами для использования гистерорезекции являются размер и тип узла.
В качестве одного из самых ранних проявлений лечебного эффекта ЭМА отмечена нормализация менструального цикла в течение 1-го месяца после вмешательства, что обусловлено редукцией артериального кровотока в бассейне маточной артерии.
Остаточная васкуляризация узлов возможна:
• из-за дополнительного кровоснабжения миоматозных узлов из других источников;
• технической незавершенности ЭМА.
Реваскуляризация может возникнуть:
• из-за дополнительного кровоснабжения из маточно-арте-риальных анастомозов или шеечной ветви маточной артерии;
• сочетания миомы матки с аденомиозом;
• саркомы матки.
При неэффективности проведенного эндоваскулярного лечения возможна повторная ЭМА за исключением пациенток с подозрением на саркому матки.
Осложнения эмболизации маточных артерий:
1) интраоперационные (0,6%):
♢ перфорация маточной артерии с образованием гематомы в предпузырном пространстве или в параметрии - лечение консервативное;
♢ диссекция стенки общей подвздошной артерии - наблюдение;
2) в ранний послеоперационный период (до 7 сут) (2,3%):
♢ локальные небольшие гематомы в области пункции артерии - наблюдение;
3) в поздний послеоперационный период (от 6 до 12 мес) (6%):
♢ воспалительные (пиометра) - 2,5%;
♢ гипоменструальный синдром (2,1%) - показана циклическая гормональная терапия;
♢ маточная форма аменореи (0,4%) - показаны циклическая гормональная терапия, физиотерапия;
♢ яичниковая форма аменореи (1%) - показана заместительная гормональная терапия.
Фокусированная ультразвуковая абляция
В настоящее время применяется ФУЗ-абляция, выполняемая под контролем МРТ, и аналогичное высокоинтенсивное УЗ-воздействие (HIFU-абляция1), осуществляемое под УЗ-контролем.
Показания
• Миома матки, симптомная или бессимптомная, подтвержденная клинически и инструментально.
• Медленный рост миомы в динамике.
• Линейные размеры узла 1-9 см (узлы <1 см плохо определяются при разметке).
• Маточные кровотечения.
• Синдром тазовых болей.
1 High Intensive Focused Ultrasound - высокоинтенсивный фокусированный ультразвук.
Нарушение функции смежных органов (сдавление мочевого пузыря, прямой кишки) - дизурические расстройства, проблемы дефекации, дискомфорт в области малого таза.
• Проблемы, возникающие во время полового контакта.
• Желание женщины сохранить орган.
Противопоказания
• Злокачественные новообразования гениталий.
• Острые воспалительные заболевания органов малого таза.
• Опухоли яичников.
• Субсерозные миоматозные узлы на тонкой ножке, узлы шейки матки.
• Невозможность выбора безопасного доступа (отсутствие УЗ-окна).
• Беременность.
• Тяжелые соматические заболевания в стадии декомпенсации.
• Ожирение III-IV степени (вес >120 кг, окружность талии >110 см).
• Наличие металлических и магнитных имплантов, кардиостимулятора.
• Грубые и обширные рубцы передней брюшной стенки, состояние после липосакции в области живота, пластики передней брюшной стенки полимерной сеткой, выраженный спаечный процесс в полости малого таза.
• Внутриматочный контрацептив (ВМК).
• Размер миоматозного узла <1 см и >15 см.
• Размер матки >20 нед беременности.
• Боязнь замкнутого пространства (клаустрофобия).
Технология и механизм фокусированной ультразвуковой абляции
Технология и механизм ФУЗ-абляции заключаются в дистанционном воздействии энергии УЗ, фокусированного в конкретном участке миоматозного узла. В течение нескольких секунд ткань в зоне фокусировки УЗ-лучей нагревается до температуры термического некроза (абляции).
Варианты действия ФУЗ на опухоль:
1) прямое термическое воздействие за счет высвобождения энергии звуковой волны;
2) опосредованное - за счет изменения локального кровотока и нарушения питания опухолевой ткани.
При нагревании ткани до 60 °С в течение нескольких секунд происходит гибель всех клеток опухоли за счет их дегидратации и денатурации белков. Повреждения окружающих тканей не происходит.
В итоге изменяется гистологическая структура ткани миомы (миоциты и строма «трансформируются» в ткань в состоянии сухого коагуляционного некроза) и останавливается ее рост, происходит постепенное уменьшение узлов и регресс симптомов миомы матки. В течение 2 нед после ФУЗ-абляции периферическая часть зоны некроза замещается пролиферирующей соединительной тканью.
Условия
Условиями для выполнения ФУЗ-абляции миоматозных узлов являются наличие соответствующего оборудования и подготовленного персонала.
ФУЗ-МРТ-абляция выполняется на комплексе ExAblate-2000 (InSightec, Израиль), объединенном в единую систему с магнитно-резонансным томографом 1,5 Тесла (General Electric, США).
При выполнении ФУЗ-абляции необходимо учитывать тип строения миоматозных узлов, определяемых при МРТ. Три основных магнитно-резонансных типа миомы:
• I тип (преобладает сигнал низкой интенсивности на Т2-ВИ, миоматозные узлы определяют в виде черных образований), что соответствует гистологической картине простой миомы матки без отека стромы;
• II тип (преобладает сигнал средней интенсивности на Т2-ВИ, узлы - в виде серых образований), что соответствует гистологической картине пролиферирующей миомы без отека стромы, с небольшим количеством соединительной ткани, или простой миомы с выраженным диффузным отеком стромы;
• III тип (преобладает сигнал высокой интенсивности на Т2-ВИ, узлы - в виде белых образований), гистологически это пролиферирующая миома матки со значительным диффузным отеком стромы.
У одной больной могут встречаться миоматозные узлы различных магнитно-резонансных характеристик.
Этапы выполнения фокусированной ультразвуковой абляции под контролем магнитно-резонансной томографии
Подготовка аппаратуры, подготовка к планированию и планирование ФУЗ-абляции-МРТ, непосредственно выполнение самой процедуры и первичной оценки ее результатов. Планирование процедуры ФУЗ-абляции-МРТ начинается с разметки зоны воздействия внутри опухоли, выборе «точек-мишеней» для коагуляции и проверки пути прохождения ФУЗ (рис. 9.1, см. цветную вклейку).
Процедура ФУЗ-абляции-МРТ начинается с проверки точности наведения на опухоль (рис. 9.2, см. цветную вклейку), для чего производится тестовый импульс ФУЗ малой мощности (обычно 10-50 Вт), который вызывает увеличение температуры в точке воздействия всего на несколько градусов.
Процедура ФУЗ-абляции-МРТ заключается в последовательном импульсном воздействии ФУЗ в заданном объеме ткани внутри опухоли. После каждого произведенного импульса ФУЗ точка коагуляции отображается в виде синего пятна. Этим контролируют выполнение процедуры и оценивают кумулятивную термическую дозу.
Операция ФУЗ-МРТ с высокой точностью контролируется посредством магнитно-резонансного сканирования и термометрии в реальном времени.
Во время процедуры контроль ее качества осуществляется после внутривенного введения контрастного препарата для МРТ при образовании зоны некроза (без перфузии), не накапливающей контрастный препарат. При ФУЗ-абляции используют контрастные препараты, обладающие свойством их детекции при УЗ-исследовании (Sonazoid, Levovist и др.).
Продолжительность процедуры ФУЗ-МРТ в среднем составляет 1,5-2 ч, достигая иногда 3 ч, а для абляции небольших опухолей может составлять всего несколько минут.
Послеоперационное наблюдение
После ФУЗ-абляции пациентки наблюдаются в лечебном учреждении в течение 1 ч. Эффект лечения оценивают через 1 и 6 мес.
При своевременном обнаружении и правильно проведенном лечении миомы матки дальнейший прогноз благоприятен.
Рекомендован:
• Психологический комфорт, оптимальная физическая активность, правильное питание, отказ от вредных привычек.
• Сохранение первой беременности у молодых женщин с наследственной миомой.
• Обязательно лечение гормональных нарушений.
• Рациональная контрацепция для исключения абортов.
• Посещение гинеколога 1 раз в полгода и УЗИ органов малого таза.
Источник: Гинекология: национальное руководство. Краткое издание / гл. ред. Г. М. Савельева, Г. Т. Сухих, В. Н. Серов, В. Е. Радзинский, И. Б. Манухин. - 2-е изд., перераб. и доп. - Москва: ГЭОТАР-Медиа, 2020
11.09.2021 | 17:46:08