Трудноизлечимый ревматоидный артрит.
В 2021 г. было опубликовано определение трудноизлечимого ревматоидного артрита как первый шаг к разработке рекомендаций по ведению таких больных. В состав группы экспертов входило 32 члена: 26 ревматологов, психолог, фармацевт, терапевт, два социальных работника, специалист органов здравоохранения. Предварительно был проведен онлайн-опрос среди ревматологов для определения характеристик трудноизлечимого РА. Опрос состоял из девяти вопросов, включая два общих вопроса: «Где вы работаете?», «Скольких пациентов с ревматоидным артритом вы лечите?», а также четыре вопроса с множественным выбором и три открытых вопроса, касающихся определения РА D2T. Четыреста десять респондентов из 33 стран завершили опрос в период с июля 2017 по март 2018 г., 96% респондентов были европейцами. По результатам опроса были выделены для определения D2T три критерия: история неудачного лечения, характеристика проявлений активности и клиническое восприятие неудачного лечения. Все три критерия должны быть учтены при определении D2T ревматоидного артрита.
Критерий 1. Лечение в соответствии с рекомендациями EULAR и неудача терапии двумя ГИБП или более с различным механизмом действия или иJAK после неудачной терапии классическими синтетическими БПВП (ксБПВП) при отсутствии противопоказаний к последним.
Критерий 2. Один признак и более, указывающий на активное/прогрессирующее заболевание, из следующих:
a) по меньшей мере умеренная активность заболевания [в соответствии с подтвержденными комплексными индексами, включающими количество суставов, как то DAS28-СОЭ >3,2 или клинический индекс активности заболевания (Clinical Disease Activity Index — CDAI) >10];
б) наличие признаков (включая острофазовые показатели, биохимические маркеры активности воспаления и визуализацию активного воспаления) и/или клинических симптомов, указывающих на активное заболевание (связанные с суставами или с внесуставными проявлениями);
в) неспособность сократить лечение глюкокортикоидами (ГК) (ниже 7,5 мг суточной дозы преднизолона);
г) быстрое рентгенологическое прогрессирование (независимо от наличия или отсутствия признаков активного заболевания). Быстрое рентгенологическое прогрессирование деструкции мелких суставов определяется как увеличение индекса Шарпа в модификации van der Hejide на 5 баллов или более;
д) хорошо контролируемое заболевание в соответствии с вышеуказанными стандартами, но при наличии симптомов РА, которые приводят к снижению качества жизни. Например, сопутствующая фибромиалгия, которая может имитировать воспалительную активность. Невоспалительное заболевание может приводить к наличию ряда симптомов, мимикрирующих под активное/симптоматическое заболевание (боль, скованность, утомляемость). Невоспалительные поражения могут быть причиной клинически важных жалоб. Следовательно, пациенты с невоспалительными жалобами могут быть классифицированы как имеющие трудно поддающийся лечению ревматоидный артрит.
Критерий 3. Ревматолог и/или пациент воспринимают заболевание как проблематичное. Этот критерий говорит о том, что только клинические сценарии, которые оцениваются как проблемные (например, явно неэффективное лечение), относятся к категории D2Т ревматоидного артрита. Поскольку это определение применимо в основном к пациентам, у которых имеются проблемы с оценкой эффекта, было решено принять определение соответствующим образом: «Лечение признаков и/или симптомов воспринимается ревматологом и/или пациентом как проблематичное». Имеются некоторые опасения, что этот критерий может быть слишком субъективным, особенно при проведении клинических исследований. Однако, поскольку основное внимание в рекомендациях должно быть уделено клиническим последствиям, было решено включить этот критерий по единогласному соглашению всех членов группы экспертов.
Хорошо известно, что ревматоидный артрит является заболеванием с чрезвычайно разнообразными вариантами течения, что подчас затрудняет точное соблюдение рекомендаций по ведению больных. Недостаточный эффект или отсутствие эффекта на фоне терапии ксБПВП может быть обусловлено как устойчивостью заболевания к лечению (больные-«неответчики»), так и непереносимостью ксБПВП. У ряда больных наличие сопутствующих заболеваний затрудняет лечение, например наличие хронических инфекционных заболеваний (хронический цистит, пиелонефрит, бронхит и пр.), рецидивирующие заболевания желудочно-кишечного тракта, хроническая обструктивная болезнь легких. С другой стороны, наличие у больного невоспалительных состояний (фибромиалгия, вторичный или сопутствующий остеоартрит) и психосоциальные факторы могут обусловливать наличие симптомов, в первую очередь боли, которые могут быть приняты за признаки активного ревматоидного артрита, что приведет к оценке заболевания как трудноизлечимого. Кроме того, при невозможности достижения цели терапии следует учитывать приверженность пациентов лечению и регулярность приема лекарственных средств.
В настоящее время разрабатываются рекомендации по комплексному лечению ревматоидного артрита D2T, направленные на охват всех воспалительных и невоспалительных факторов, лежащих в основе ревматоидного артрита D2T. Они должны включать как фармакологические, так и немедикаментозные варианты лечения и будут дополнять существующие рекомендации ревматоидного артрита. Первая публикация EULAR по ведению больных с D2T РА, опубликованная в 2022 г., включает обсуждение диагностических и лечебных мероприятий при установлении этого варианта заболевания. Рабочая группа EULAR сформулировала два основных принципа для подтверждения оценки РА как D2T и ведения таких больных.
1. Необходимо убедиться, что пациенты относятся к группе больных с трудноизлечимым ревматоидным артритом в соответствии с критериями EULAR, хотя ведение этих пациентов проводилось в соответствии с современными рекомендациями по лечению ревматоидного артрита.
2. При оценке ревматоидного артрита как D2T следует подтвердить или исключить наличие воспалительного активного состояния, что должно быть сделано до принятия решения о коррекции терапии БПВП. Если сохранение признаков и/или симптомов не вызвано активностью заболевания РА, то изменение терапии БПВП (наращивание дозы препарата или смена препарата), по всей вероятности, будет неэффективным и может далее привести к очевидной неудаче назначения нескольких ГИБП или иJAK. Кроме того, при выявлении воспалительного процесса следует исключить возможность наличия признаков воспаления, связанных с другими состояниями
Сформулированы также 11 положений, которые следует учитывать при определении трудноизлечимого ревматоидного артрита.
1. Если у пациента предполагается D2Т ревматоидный артрит, в качестве первого шага следует рассмотреть возможность неправильного диагноза и/или наличия сопутствующего имитирующего заболевания.
Помимо оценки сопутствующих фибромиалгии, остеоартрита и/или наличия психологических состояний, несоблюдения режима приема препаратов, следует оценить возможность наличия таких сопутствующих заболеваний, как инфекции и злокачественные новообразования, которые могут способствовать состоянию D2T РА. Неправильный диагноз (т.е. имитация альтернативного заболевания) чаще может быть при серонегативном заболевании, но такая возможность должна быть учтена у всех пациентов с синдромом D2Т РА. Некоторые заболевания могут имитировать сохранение активности ревматоидного артрита, такие как кристаллические артропатии, ревматическая полимиалгия, псориатический артрит, спондилоартрит, болезнь Стилла, системная красная волчанка (СКВ), синдром красной волчанки (RA-волчанка), идиопатические воспалительные миопатии, васкулит, ремиттирующий симметричный серонегативный синовит, реактивный артрит [например, парвовирус В19, краснуха, болезнь Уиппла, инфекции, вызванные вирусом гепатита В (hepatit B virus HBV) и вирусом гепатита С (hepatit C virus HCV)], паранеопластические синдромы, остеоартрит и фибромиалгия.
2. Когда клинически сложно (например, при ожирении или фибромиалгии) оценить наличие воспалительных изменений, ультразвуковое исследование (УЗИ), по-видимому, является наиболее приемлемым методом для выявления (или исключения) воспалительной активности при предположении о развитии D2T ревматоидного артрита.
В общей популяции больных ревматоидным артритом (где оценка активности с помощью составных индексов считается надежным методом) отмечены умеренные или сильные корреляции между суммарными баллами США и составными индексами на групповом уровне. Это подтверждает, что УЗИ способно подтвердить «истинную» воспалительную активность и может иметь дополнительную ценность у пациентов с D2T, когда существуют сомнения в наличии воспаления. Однако в настоящий момент остается неясным, какое минимальное количество суставов должны быть оценены при УЗИ, что затрудняет оценку общего уровня активности в повседневной практике. Меньшую ценность в настоящее время для подтверждения активного воспаления имеют определение биомаркеров [таких как фибриноген, резистин, матриксная металлопротеаза 3-го типа, интерлейкина-6 (интерлейкин — ИЛ) и др.], использование магнитно-резонансной томографии.
3. Составные индексы активности и клинические проявления следует интерпретировать с осторожностью при наличии сопутствующих состояний, в частности при ожирении и фибромиалгии, поскольку в таких случаях возможно завышение индексов активности.
Хотя эксперты указывают, что завышение активности воспаления может быть связано с многочисленными сопутствующими заболеваниями, но существенные доказательства были получены только для ожирения и фибромиалгии. Другие сопутствующие заболевания (особенно те, которые протекают с повышением острофазовых показателей, например, инфекции, злокачественные новообразования или ревматическая полимиалгия) также могут привести к неправильной классификации воспалительной активности РА, хотя не было выявлено существенных доказательств, подтверждающих это. Кроме того, не было выявлено подтверждения влияния остеоартрита, подвывиха или вывихов суставов на клиническую оценку суставов. Следует отметить, что при наличии деструкции сустава болезненность в нем может быть обусловлена разрушением, а не синовитом.
4. Приверженность лечению должна обсуждаться и оптимизироваться в рамках процесса совместного принятия решений по D2T.
По данным литературы, приверженность к лечению при РА колеблется от 30 до 80%. В недавно проведенном проспективном наблюдательном многоцентровом (10 центров) 6-месячном исследовании было установлено, что процент приверженности больных лечению ксБПВП, ГИБП и иJAK составляет 59%. Оценка проводилась по опроснику CQR (Compliance Quetionnare Rheumatology). Данный опросник был валидизирован в 2003 г. в сравнении c электронным мониторированием медикаментов. Было установлено с использованием многомерного линейного регрессионного анализа, что общий взвешенный показатель CQR значительно и адекватно предсказывает соблюдение режима приема (р=0,001, r2=0,46) и правильный режим дозирования (р=0,004, r2=0,42). Дискриминантный анализ показал, что специфичность и чувствительность для определения хорошего соответствия требованиям назначения медикамента составили 95 и 62% соответственно. Прогностическая ценность для выявления неудовлетворительного соответствия требованиям приема препарата составила 86%, а для выявления хорошего приема соответствие требованиям — 83%. За 6-месячный период была проанализирована приверженность больного лечению в зависимости от социально-демографических, клинических параметров, вида проводимой терапии, от психологических, коммуникационных и логистических факторов. Самой низкой оказалась приверженность пациента к лечению первым ксБПВП — 43,1%, приверженность ко второму ксБПВП составила 70,4% и к ГИБП/таргетным синтетическим БПВП (тсБПВП) — 64,4%. Из этих данных можно сделать определенные выводы. Низкая приверженность к впервые назначенному ксБПВП может объясняться непониманием больного риска ухудшения течения заболевания, его прогрессирования, развития деструкции структур сустава при «недолеченном» заболевании, а также недостаточностью информации о РА, его осложнениях и о цели лечения, что непременно должен сделать врач. Авторы сами отмечают, что степень приверженности в большей степени коррелировала с психологическими, коммуникационными и логистическими факторами, чем с социально-демографическими или клиническими.
5. После неудачи лечения вторым или последующим ГИБП/тсБПВП и особенно после неудачи лечения двумя ингибиторами фактора некроза опухоли альфа (ФНО-α) следует рассмотреть лечение с помощью ГИБП с другим механизмом действия или с помощью тсБПВП.
Увеличивающийся арсенал ГИБП и тсБПВП представляется достаточным для успешного подавления активности ревматоидного артрита. При необходимости переключение на другой препарат того же класса и с другим механизмом действия может быть достаточно эффективным. Однако значительная доля пациентов с РА не отвечает по крайней мере на два ГИБП/тсБПВП с разными механизмами действия, что приводит к достижению критериев для РА D2Т. В обычной практике преобладает метод проб и ошибок при смене препаратов, относящихся к базисным, в случаях сохранения признаков и/или симптомов, указывающих на активное заболевание. В рандомизированных контролируемых исследованиях (РКИ) были выявлены лишь ограниченные доказательства эффективности терапевтических стратегий у пациентов с РА, у которых по крайней мере два ГИБП/тсБПВП (в частности, с различными механизмами действия) потерпели неудачу.
После недостижения цели лечения по крайней мере при использовании двух ГИБП/тсБПВП были выявлены некоторые доказательства благоприятного эффекта лечения ГИБП/тсБПВП с другой мишенью. В девяти работах возможность добиться эффекта после неудачи нескольких ГИБП представлена для тофацитиниба, тоцилизумаба, барицитиниба, филготиниба, ритуксимаба (после применения ингибиторов ФНО-α), абатацепта, голимумаба, упадацитиниба. Для голимумаба, тоцилизумаба 4 мг (внутривенно), тофацитиниба 5 мг и барицитиниба 2 мг было показано уменьшение эффективности по мере увеличения числа ранее неудачных ГИБП, для упадацитиниба и филготиниба эта тенденция к снижению эффективности была менее очевидной. Эффективность абатацепта и ритуксимаба также численно снижалась с увеличением числа ранее неудачных ГИБП: для абатацепта показано уменьшение эффекта при неэффективности одного ингибитора ФНО-α против трех; на ритуксимабе клинический индекс активности (CDAI) при лечении после неудачи одного ингибитора ФНО-α через 12 мес снизился до 13,2, а при неудаче двух ингибиторов ФНО-α и более — до 18,3 (достоверность различий не приведена). Не для всех препаратов указана причина неудачи лечения предшествующими ГИБП (недостаточная эффективность, развитие нежелательных явлений (НЯ) или другие факторы), что затрудняет интерпретацию результатов и разработку четких рекомендаций по смене ГИБП/тсБПВП.
6. Если рассматривается третий или последующий ГИБП/тсБПВП, следует использовать максимальную дозу препаратов, которая была признана эффективной и безопасной в ходе клинических испытаний.
Тенденция увеличения эффекта в этих группах больных не была значимой для упадацитиниба и филготиниба, а также для более высоких доз тоцилизумаба (внутривенно, 8 мг/кг), барицитиниба (4 мг 1 раз в день) и тофацитиниба (10 мг 2 раза в день, хотя тофацитиниб не зарегистрирован в такой дозе из соображений безопасности в большинстве стран, за исключением РФ и Турции). Следует также отметить, что барицитиниб в дозе 4 мг/сут не следует применять у пациентов старше 75 лет и со сниженным клиренсом креатинина (30–60 мл/мин).
7. Варианты лечения должны быть тщательно продуманы при наличии сопутствующих заболеваний, которые влияют на качество жизни больных либо самостоятельно, либо за счет ограничения использования вариантов лечения ревматоидного артрита.
Специальных исследований по ведению пациентов с ревматоидным артритом с ВИЧ-¬инфекцией, желудочно-кишечными заболеваниями, латентным туберкулезом и злокачественными новообразованиями не проводилось; были выявлены лишь ограниченные данные для пациентов с РА с внесуставными проявлениями, а также сформулированы противопоказания к назначению ГИБП/тсБПВП при заболеваниях с выраженными стадиями печеночной или почечной недостаточности, психологическими расстройствами, осторожность использования при заболеваниях легких. Ограниченные данные представлены при вирусных гепатитах (HBV, HCV), сердечно-сосудистых заболеваниях (ССЗ), ожирении и при ведении больных до и во время беременности и кормления грудью. Сообщалось о более высокой частоте венозных тромбоэмболий у пациентов, использующих тсБПВП в высоких дозах и имеющих факторы риска развития венозных тромбоэмболий.
Рекомендации по безопасному применению DMARDs до и во время беременности и кормления грудью разработаны EULAR и ACR.
Хотя ожирение само по себе не ограничивает выбор лекарств, эффективность лечения у пациентов с ожирением может отличаться. Так, внутривенное введение инфликсимаба может быть менее эффективным у пациентов с индексом массы тела выше 30 кг/м2 по сравнению с пациентами с индексом массы тела ниже 30 кг/м2. Равнозначная эффективность при разном весе больных регистрировалась у подкожных форм ингибиторов ИЛ-6 и его рецепторов, абатацепта, барицитиниба.
С учетом того, что до 80% пациентов с ревматоидным артритом имеют одно или несколько сопутствующих заболеваний, приводящих к сокращению продолжительности жизни, следует отнести коморбидность к значимым факторам, влияющим на формирование D2T. Наличие сопутствующих заболеваний может также повлиять на оценку активности заболевания, стать препятствием для оптимального контроля заболевания и привести к ухудшению связанного со здоровьем качества жизни (HRQoL). Однако сопутствующие заболевания, связанные с ревматоидным артритом, такие как ССЗ, остеопороз (ОП) и интерстициальная болезнь легких (ИБЛ), следует оптимально скринировать и лечить.
Группой экспертов предложено 11 рекомендаций по оценке и лечению коморбидных состояний при ревматоидном артрите (табл. 1.1), уровень доказательности и строгость рекомендаций определялись в соответствии с системой оценки и разработки оценок рекомендаций (GRADE).
Таблица 1.1. Рекомендации по оценке и лечению отдельных сопутствующих заболеваний при ревматоидном артрите
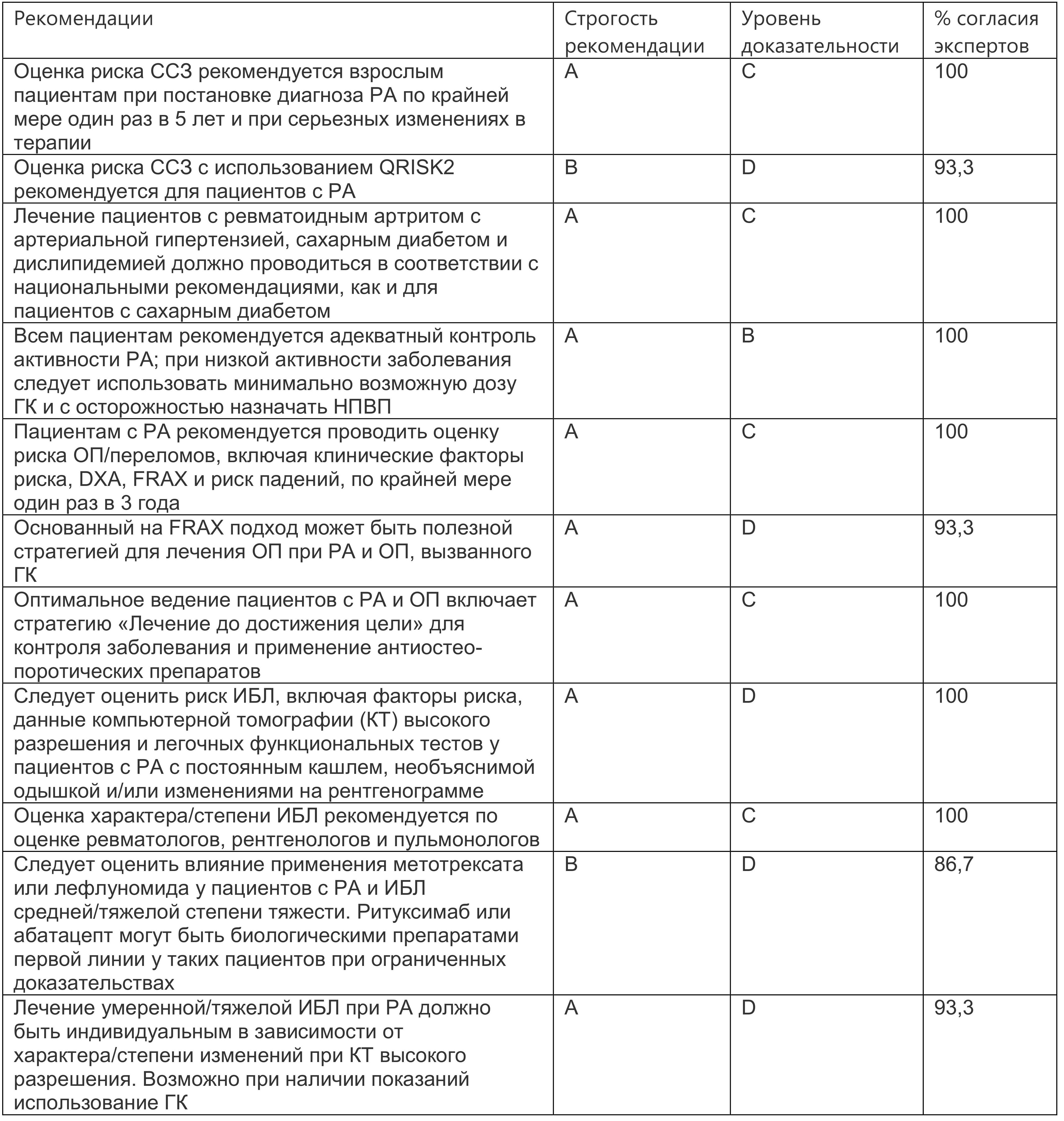
Самые низкие показатели строгости рекомендации и согласия экспертов касаются 10-й рекомендации. Действительно, и метотрексат, и лефлуномид в редких случаях способны вызывать поражение легких на ранних сроках лечения — пневмонит с гипоксимией. Это редкое нежелательное явление развивается в первые 3–4 нед терапии. Клинические проявления обычно неспецифичны: лихорадка, озноб, недомогание, непродуктивный кашель, одышка, боль в груди, нарастающие за несколько дней. При КТ высокого разрешения картина типична для пневмонита. Критериями этого нежелательного явления являются: клинически — связь клинической картины с гиперчувствительностью; рентгенологически: исчезновение инфильтратов после отмены метотрексата. исключение других причин: исключение инфекции или другой патологии легких; гистология: соответствие изменений непереносимости лекарственных средств (т.е. гиперчувствительный пневмонит или токсическая реакция на лекарство). Наличие трех-четырех критериев соответствуют диагнозу «пневмонит» как НЯ при лечении метотрексатом. Характерно острое начало, тахипноэ ≥28 дыханий в минуту, сатурация кислорода <90%, в анализе крови лейкоциты ≤15х109 /л с эозинофилией или без нее, при функциональном тесте рестриктивные нарушения и снижение диффузионной способности. Помимо отмены метотрексата, показано назначение средних доз ГК (15–20 мг/сут преднизолона). Такие же критерии и рекомендации касаются развития пневмонита при терапии лефлуномидом, преимущественно пневмонит как нежелательное явление лечения лефлуномидом описан у лиц азиатских рас. За исключением пневмонита как НЯ, развивающегося по типу идиосинкразии, метотрексат не оказывает отрицательного влияния на ИБЛ при РА. Метотрексат, по данным регистров, не увеличивает риск возникновения или усугубления интерстициального поражения легких при ревматоидном артрите, более того, лечение метотрексатом ассоциируется с достоверным снижением риска развития интерстициального поражения легких при РА, и метаанализ, включивший 22 двойных слепых РКИ (8584 пациента), показал, что увеличение респираторных поражений при лекарственной терапии метотрексатом ассоциировалось с увеличением риска инфекций респираторного тракта, но не с неинфекционным поражением легких при ревматоидным артритом.
Следует учитывать, что клинически значимые противопоказания к некоторым препаратам могут привести к ограничению вариантов лечения. Например, наличие дивертикулита ограничивает использование тоцилизумаба, тофацитиниба, а при рецидивирующей инфекции опоясывающим герпесом нежелательно использовать иJAK. Однако отсутствие достоверных клинических доказательств степени безопасности и эффективности терапии для пациентов с этими состояниями не позволило сформулировать конкретные рекомендации.
8. У пациентов с сопутствующей инфекцией HBV/HCV могут быть использованы ряд ГИБП/тсБПВП, сопутствующую противовирусную профилактику или лечение повреждения печени следует рассматривать в тесном сотрудничестве с гепатологом.
Ингибиторы ФНО-α, абатацепт и тоцилизумаб могут быть рассмотрены у пациентов с HBV, ингибиторы ФНО-α — у пациентов с HCV. В любом случае должна проводиться профилактика активации вирусных гепатитов противовирусными препаратами.
После проведения скрининга на HBV, который должен включать исследование на HB-антиген, HB-core-антиген и HB-core-антитела, оценку вирусной нагрузки дезоксирибонуклеиновой кислоты (ДНК), следует оценить результаты скрининга (табл. 1.2), а на фоне лечения необходимо следить за Anti-HBD-core (общий), Anti-HBs-антиген, гепатит B ДНК (см. табл. 1.2).
Таблица 1.2. Интерпретация результатов лабораторных исследований при вирусном гепатите В
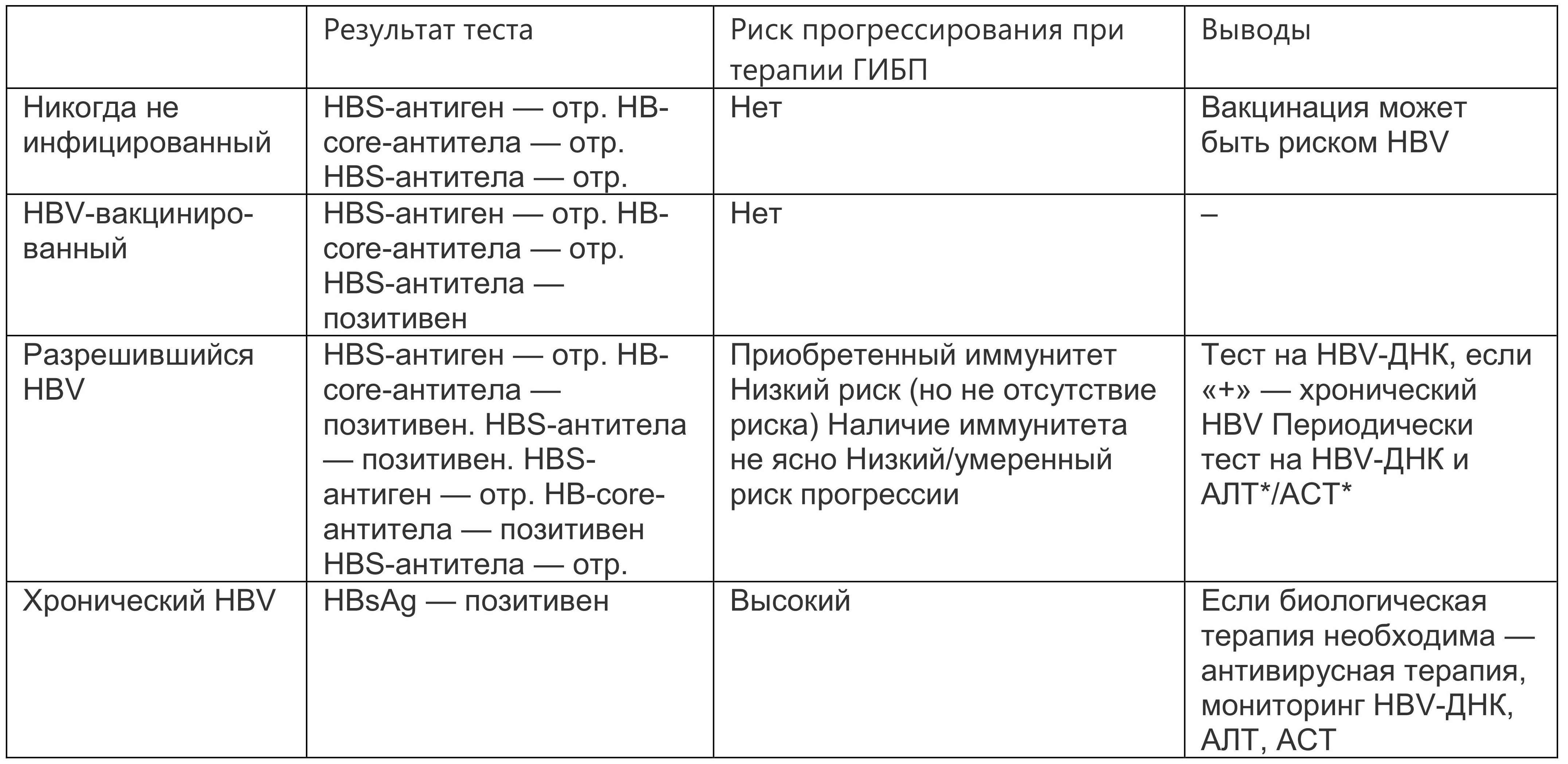
* Примечание: АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза.
Следовательно, проведение терапии ГИБП возможно только при отрицательном тесте на HBS-антиген, при положительном тесте необходимо проведение противовирусной терапии до начала терапии ГИБП. У HBV-неактивных носителей антивирусная профилактика ламивудином должна начаться до старта анти-ФНО и продолжаться 6–12 мес после их отмены. Мониторинг проводится клинически и лабораторно для профилактики реактивации HBV-инфекции и во время приема, и после отмены анти-ФНО-терапии.
Отсутствуют доказательства в пользу активации HBV-инфекции при лечении другими ГИБП/тсБПВП, но это не указывает на то, что эти препараты безопасны. В отдельных случаях при низком риске инфекции HBV возможно проведение противовирусной профилактики в виде сопутствующей терапии. Лечение ревматоидного артрита в любом случае должно проводиться совместно с гепатологом. Необходимо отметить, что сопутствующая профилактическая противовирусная терапия может иметь место только при гепатите В, при гепатите С необходимо противовирусное лечение.
Скрининг на гепатит С (HCV) включает исследование на антитела к HCV и оценку вирусной нагрузки HCV-РНК, интерпретация результатов представлена в табл. 1.3.
Таблица 1.3. Исследования на антитела к HCV и оценка вирусной нагрузки HCV-РНК

При носительстве вируса гепатита С, помимо ингибиторов ФНО-α, может использоваться ритуксимаб. Среди ингибиторов ФНО-α наиболее безопасным считается этанерцепт.
9. В дополнение к фармакологическому лечению следует рассмотреть возможность присоединения немедикаментозных вмешательств (физические упражнения, психологические, образовательные мероприятия), направленных на возможность оптимизации лечения функциональной недостаточности, боли и усталости.
Широкий спектр клинических, психологических факторов может способствовать сохранению признаков и/или симптомов, напрямую не связанных с воспалением (например, функциональные ограничения, боль и усталость). Индивидуально подобранные немедикаментозные вмешательства также являются важными компонентами лечения РА D2T.
Имеются данные о благотворном влиянии физических упражнений, образования больных, психологической помощи больным и мероприятий по внедрению самоконтроля болезни пациентом в отношении уменьшения боли, усталости, функциональной способности, хотя убедительных доказательств, что немедикаментозные вмешательства улучшают качество жизни больного, получено не было. Польза физических упражнений при ревматоидном артрите хорошо установлена. В соответствии со статусом пациента может быть рекомендован широкий спектр физических нагрузок, например аэробные упражнения, динамические упражнения на водной основе, укрепление мышц или упражнения для рук. Могут быть применены психологические вмешательства, в частности для уменьшения боли и усталости, например когнитивно-поведенческая терапия и вмешательства, направленные на управление стрессом.
10. Пациентам следует предлагать соответствующее обучение, чтобы иметь возможность информировать их о цели лечения и терапевтической тактике.
В соответствии со стратегией «Лечение до достижения цели» (Treat to target) определение целей лечения занимает центральное место в лечении РА. В текущих рекомендациях EULAR по лечению РА клиническая ремиссия или по крайней мере низкая активность заболевания являются идеальной целью для корректировки терапевтических стратегий. В соответствии с рекомендациями по ведению больных по принципам современной стратегии лечения РА, если нет улучшения через 3 мес или если цель лечения не достигнута через 6 мес (рекомендация № 3), то следует менять терапию. В реальной практике эти сроки достижения цели лечения могут быть нереалистичными (особенно для пациентов с D2Т, учитывая их историю болезни, накопленное повреждение суставов и другие факторы) и привести к ненужным переключениям ксБПВП. В каждом конкретном случае следует оценивать индивидуальное течение заболевания. Если цель лечения не достигнута в определенные рекомендациями сроки, но имеется отчетливая тенденция к снижению активности ревматоидного артрита, то можно проследить за активностью болезни далее, пока необходимость смены терапии не станет очевидной.
Несоответствие понимания заданной поставленной цели пациентом и врачом может негативно повлиять на исходы заболевания. Именно поэтому цели и тактика лечения должны быть обсуждены с пациентом, что может привести к улучшению приверженности к лечению, комплаентности приема необходимых препаратов и сократить время до достижения цели терапии.
Необходимо использовать все возможные инструменты (школы, брошюры, веб-инструменты), которые повышают уровень знаний пациентов и уверенность в принятии решений о лечении. Такие инструменты можно было бы использовать в дополнение к предоставлению информации посредством обычных обсуждений. Поскольку представления о целях лечения и необходимой терапии могут меняться с течением времени, непрерывное обучение пациентов и обсуждение с ними текущих проблем остается важным.
11. Для оптимального вовлечения больного в процесс лечения следует рассмотреть возможность использования программ самоконтроля, психологической помощи, что увеличит способность пациента уверенно управлять своим заболеванием (для этого используется термин «самоэффективность»).
Самоэффективность определяет способность пациентов контролировать различные аспекты своего заболевания или управлять ими и играет важную роль в благополучии пациентов. Убеждения в самоэффективности определяют, как люди думают, чувствуют и действуют, и являются важным аспектом самоуправления. Люди с низкой самоэффективностью быстро отказываются от своих целей, когда сталкиваются с трудностями, и подвергаются более высокому риску нарастания уровня боли, усталости, депрессии, беспокойства и стресса, а это может способствовать развитию состояния, которое определяется как трудноизлечимый РА.
Напротив, сильно развитое чувство самоэффективности улучшает производительность и благополучие человека, способствует достижению сложных целей и поддерживает приверженность им. Повышение самоэффективности может улучшить не только такие исходы заболевания, как психическое благополучие, но и многие аспекты поведения, изменить факторы образа жизни. Таким образом, повышение самоэффективности особенно важно при лечении трудноизлечимого РА, включая повышение приверженности лечению.
В оценке уровня самоэффективности в борьбе с болезнью наиболее надежным показателем признана шкала ASES (The Arthritis Self-Efficacy Scale). Хотя шкала ASES является слишком общей, считается, что ее можно использовать в начале лечения и при определении неоптимального уровня самоэффективности продумать дополнительные мероприятия общения с больным.
В 2021 г. EULAR опубликовала рекомендации по самоконтролю пациентами РА в ходе терапии. Сформулированы ключевые аспекты самоконтроля пациентами в виде трех принципов.
1. Самоконтроль подразумевает принятие активной роли в изучении своего состояния и в совместном процессе принятия решений о своем здоровье и путей заботы.
2. Самоэффективность (личная уверенность в выполнении деятельности с целью достижения желаемого результата) оказывает положительное влияние на различные аспекты жизни с воспалительными артритами.
3. Организации пациентов часто предоставляют ценные ресурсы для самоконтроля, и поэтому сотрудничество между медицинскими работниками и организациями пациентов представляется полезным. Рекомендации по самоконтролю представлены в табл. 1.4.
Таблица 1.4. Рекомендации EULAR по внедрению стратегий самоконтроля у пациентов с воспалительным артритом
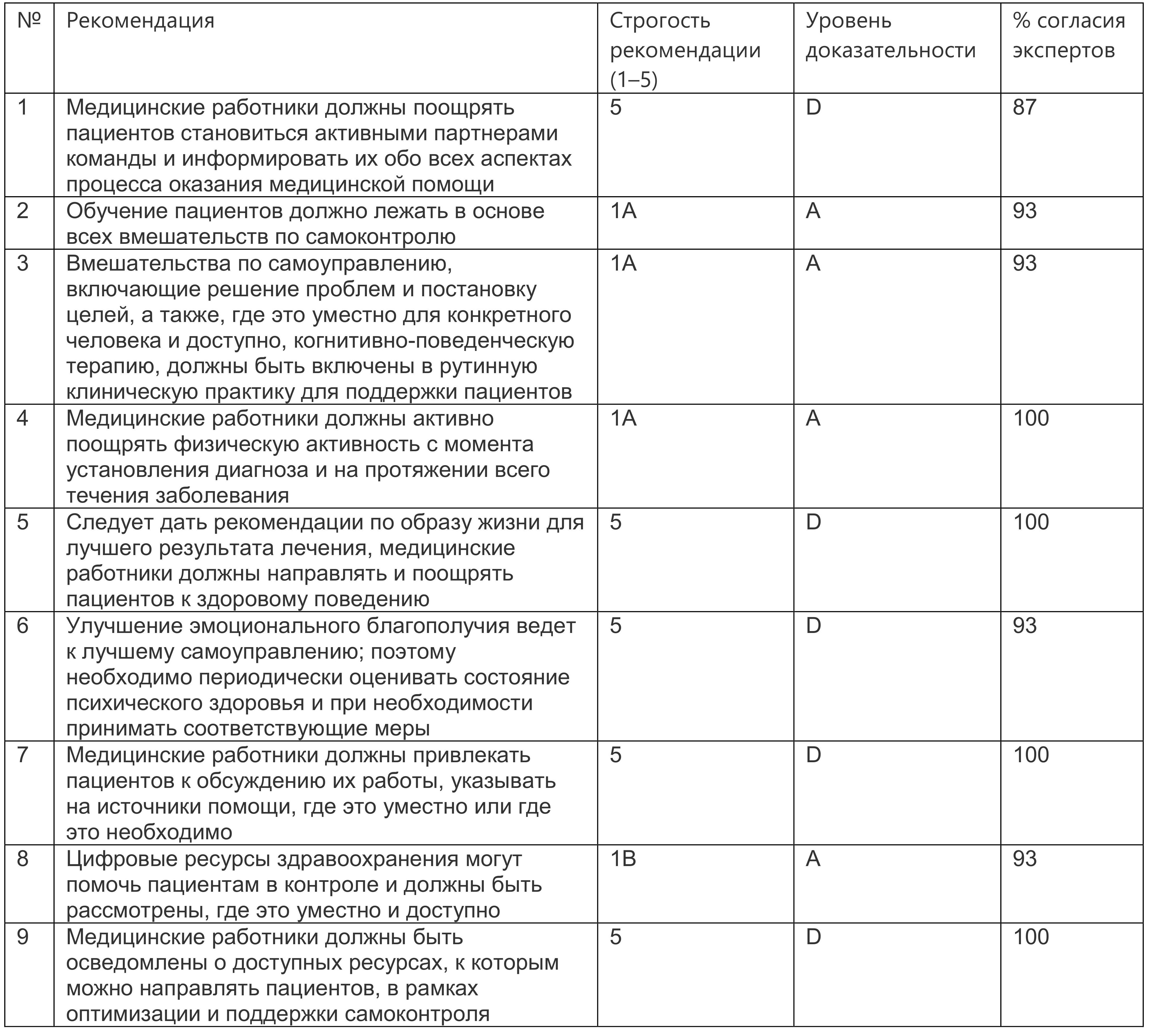
Участие пациента в процессе лечения, понимание им цели лечения и самостоятельный контроль за эффективностью и переносимостью терапии служат возможности добиться лучших исходов заболевания и сокращения сроков достижения цели лечения. В идеале самостоятельное контролирование хода лечения должно поддерживаться медицинскими работниками, пациентскими и профессиональными организациями и семьей. Эффективное поддерживаемое самоуправление включает в себя способность контролировать свое состояние и приводить в действие когнитивные, поведенческие и эмоциональные реакции, необходимые для поддержания удовлетворительного качества жизни, что было показано при различных хронических заболеваниях.
Заключение. В целом мероприятия для определения трудноизлечимого РА в виде алгоритма представлены на рис. 1.1.
Рис. 1.1. Алгоритм, основанный на принципах EULAR ведения трудноизлечимого ревматоидного артрита (адаптировано из Nagy G. et al. Ann Rhcum Dis. 2022. Vol. 81. P. 20–33)
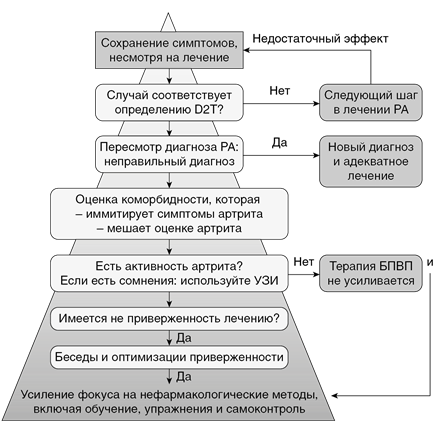
Термин «трудноизлечимый ревматоидный артрит» введен в ревматологическую терминологию относительно недавно, он характеризует гетерогенную группу пациентов с РА, у которых персистируют признаки и симптомы заболевания. В группу больных с трудноизлечимым РА включаются не только типичные случаи, характеризующиеся длительно сохраняющейся активностью и структурными повреждениями, когда ГИБП/тсБПВП оказались неэффективными (Ревматоидный артрит с множественной лекарственной устойчивостью, т.е. истинно рефрактерный ревматоидный артрит). Имеется множество факторов, потенциально способствующих развитию трудноизлечимого заболевания. К этим факторам могут относиться наличие коморбидных состояний, низкая приверженность пациента лечению, наличие состояний, обусловливающих боль, утомляемость, не связанные с наличием воспаления, функциональные нарушения суставов, психологические проблемы. Именно поэтому определение трудноизлечимого РА подразумевает целостный подход к выявлению и оценке всех возможных вариантов развития трудноизлечимого РА и адаптации ведения таких больных с разработкой тактики медикаментозного и немедикаментозного лечения для каждого индивидуума. Врач должен предлагать пациенту индивидуально подобранные лечебные вмешательства как по выбору препарата с учетом сопутствующих заболеваний и состояний, так и по проведению немедикаментозных мероприятий для улучшения функциональной способности больного, приверженности лечению, уменьшения боли, усталости. Важным является и обучение больного для привлечения его к осознанному отношению к процессу лечения, пониманию цели лечения, привлечению его к самоконтролю за достаточностью и переносимостью терапии. Такой подход уменьшает вероятность как недостаточного, так и чрезмерного фармакологического лечения.
12.03.2023 | 17:26:59