Болезнь Стилла взрослых. Патогенез, диагностика, клиническая картина, осложнения и лечение болезни Стилла у взрослых.
Раздел:
Статьи
/ Общая врачебная практика.
/ Ревматология.
/ Болезнь Стилла взрослых. Патогенез, диагностика, клиническая картина, осложнения и лечение болезни Стилла у взрослых.
Содержание
Введение
Клинические и лабораторные проявления болезни Стилла взрослых
Проявления со стороны опорно-двигательного аппарата
Варианты течения болезни Стилла взрослых
Лечение болезни Стилла взрослых
- Ингибиторы фактора некроза опухоли альфа (ФНО-α)
- Ингибиторы интерлейкина-1 бета (ИЛ-1α)
- Ингибиторы рецепторов интерлейкина-6 (ИЛ-6)
- Ритуксимаб
- Абатацепт
- Ингибиторы Янус-киназ
Заключение
Болезнь Стилла у взрослых (БСВ) — редкое системное аутовоспалительное заболевание, характеризующееся артритом, фебрильной лихорадкой, кожной сыпью и повышенным уровнем ферритина. Причина этого сложного расстройства, которое обычно поражает молодых людей, остается неизвестной.
Синдром Стилла был впервые описан педиатром Георгом Ф. Стиллом в 1897 г. как новое заболевание, отличающееся от других форм ювенильного артрита. Лондонский врач Е. Байуотерс впервые ввел термин «болезнь Стилла взрослых» (БСВ) в медицинскую литературу в 1971 г., описав это состояние у небольшой группы из 14 пациентов в возрасте от 17 до 35 лет. Причина, лежащая в основе номенклатуры этого заболевания, заключается в том, что БСВ схожа с определенными симптомами при болезни Стилла у детей, которая в настоящее время называется системным ювенильным идиопатическим артритом (СЮИА). На основе анализа экспрессии генов существует мнение, что детский и взрослый варианты синдрома Стилла — единое нозологическое образование. По последним оценкам, заболеваемость БСВ составляет от 0,16 до 0,4 на 100 000 человек.
Одной из наиболее интересных текущих дискуссий в иммунологии является недавно обозначенная концепция «перекреста между аутовоспалением и аутоиммунитетом из-за патогенного вовлечения обоих звеньев иммунной системы». В середине 2000-х гг. была сформулирована гипотеза о двух основных патогенетических механизмах, лежащих в основе иммуноопосредованного воспаления, и была предложена новая классификация иммунологических заболеваний, в которой заболевания разделены на основании отличий аутоиммунитета от аутовоспаления. Термин «аутоиммунитет» использовался для обозначения адаптивного иммунитета и определялся как аберрантные реакции дендритных клеток, В-клеток и Т-клеток в первичных и вторичных лимфоидных органах, приводящие к нарушению толерантности и развитию иммунной реактивности к нативным антигенам (в большинстве случаев с аутоантителами). Термин «аутовоспаление» использовался для обозначения врожденного иммунитета и определялся как нарушенная активация макрофагов и нейтрофилов в ответ на сигнал опасности, приводящий к повреждению тканей. Эти категории представляют собой континуум, который позволил уточнить новую классификацию иммуноопосредованных воспалительных заболеваний в последующие годы.
Диагноз «аутоиммунное заболевание» часто подтверждается наличием аутоантител или аутоантигенспецифических Т-клеток и В-клеток. Напротив, не существует специфического биомаркера для системных аутовоспалительных расстройств. Определение в основном основывается на сходстве с моногенными, наследственными синдромами при периодической лихорадке. Аутовоспалительные заболевания имеют несколько ключевых клинико-лабораторных особенностей, включая интенсивное воспаление с периодической лихорадкой, воспаление тканей в зависимости от заболевания, увеличение количества лейкоцитов и нейтрофилов, повышенные СОЭ и уровень СРБ, патогенную функцию инфламмасомы и терапевтический ответ на блокаду ИЛ-1β. Помимо моногенных семейных синдромов, болезнь Крона была первым классифицированным несемейным полигенным аутовоспалительным расстройством. Несколько лет спустя болезнь Стилла детей и взрослых была описана как еще одно несемейное аутовоспалительное расстройство и стала одним из наиболее характерных полигенных системных аутовоспалительных расстройств (рис. 1.1).
Рис. 1.1. Патогенез болезни Стилла взрослых (адаптировано из Foist E., Mitrovic S., Fautrel B. Mechanisms, biomarkers and targets for adult onset still’s discase // Nat Rev Rheumatol. 2018. Vol. 14. N. 10. P. 603–618)
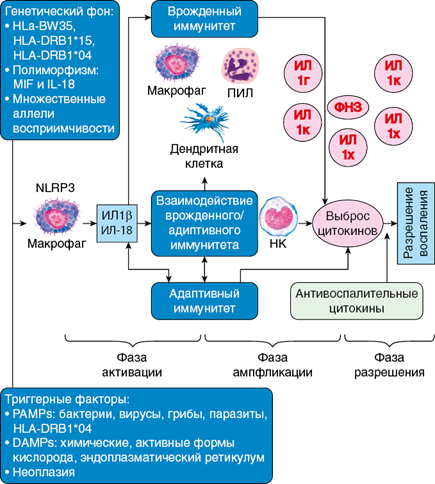
Патогенез БСВ тщательно изучается. В различных этнических группах описана связь между носительством широкого спектра генетических маркеров и риском БСВ, включая молекулы главного комплекса гистосовместимости: HLABw35, B17, B18, B35, DR2, DR4, DQ1, DRw6, DRB1, DQB1, а также генов ИЛ-18, сывороточного амилоидного белка А1, макрофагального ингибиторного фактора, хотя значение этих связей требует дальнейшего изучения. Исследуется роль нового генетического маркера — семейства LIR (leukocyte immunoglobulin-like receptor) — лейкоцитарных иммуноглобулиноподобных ингибиторных и активаторных рецепторов, относящихся к HLA класса I. Увеличение концентрации растворимой формы активного LILRA3 (SNP rs103294) в кровяном русле ассоциируется с клинической и лабораторной активностью БСВ.
В основе развития аутовоспаления лежит возникновение провоспалительного каскада. Клетки миелоидного ряда (моноциты/макрофаги, нейтрофилы, дендритные клетки, клетки естественные киллеры и др.), экспрессируя PPRs (pattern recognition receptors, паттернраспознающие рецепторы) — TLRs (Toll-like receptors, толл-подобные рецепторы), NLRs (Nodlike-receptors, Nod-подобные рецепторы), CLEC5A/DAP12 (C-type lectin domain family 5 member A/DNAX activation protein 12) и др., — активируются в ответ на патогенные стимулы (сигналы опасности), которые определяются как PAMPs (pathogen-associated olecular patterns, патоген-ассоциированные молекулярные паттерны) и DAMPs (damage-associated molecular pattern, молекулярные паттерны, ассоциированные с повреждениями). Особое значение в инициации БСВ придают TLRs-зависимой сигнализации NLRP3 (NOD-, LRR- and pyrin domain-containing protein 3) инфламмасомы. Этот процесс заключается в активации каспазы-1, участвующей в расщеплении про-ИЛ-1β и про-ИЛ-18 в биоактивные, зрелые молекулы.
Этот этап, по-видимому, является центральным в патогенезе БСВ и приводит к интенсивной активации врожденных иммунных клеток и перепроизводству нескольких провоспалительных цитокинов, включая ИЛ-6, ИЛ-8, ИЛ-17, ИЛ-18 и ФНО-α.
ИЛ-1 и ИЛ-18 индуцируют свой собственный синтез за счет механизмов аутоамплификации и синтез других провоспалительных цитокинов — ФНО-α, ИЛ-6, ИЛ-8, ИЛ-17, интерферонов типа I, хемокинов, низкомолекулярных медиаторов воспаления (оксида азота и простагландинов). Данные провоспалительные агенты способствуют экспрессии молекул адгезии на лейкоцитах и эндотелиальных клетках; стимулируют гранулоцитопоэз; вызывают деструктивные и катаболические тканевые эффекты; индуцируют лихорадку; участвуют в развитии общеконституциональных симптомов, ноцицептивной и нейропатической боли, потери аппетита, депрессии, усталости, нарушения сна и др.. Активация макрофагов приводит к избыточному образованию ферритина, который не только выполняет роль внутриклеточного депо железа, но и влияет на воспалительные реакции.
У большинства пациентов (45–80%) начало заболевания отмечается в возрасте от 16 до 35 лет. Имеется два возрастных пика дебюта БСВ: первый приходится на возрастную группу от 16 до 25 лет, второй — от 36 до 46 лет. Задержка с постановкой диагноза — распространенное явление, учитывая неспецифические симптомы и недостаточную осведомленность о БСВ врачей общей практики, средний возраст к моменту установления диагноза болезни Стилла у взрослых колеблется от 33 до 45 лет.
Наиболее частыми клиническими симптомами БСВ являются фебрильная лихорадка ≥39 °С, макулопапулезная сыпь и артралгии/артриты.
Лихорадка — наиболее частый симптом БСВ, регистрируемый у 46% из 100% пациентов, и обычно предшествует другим проявлениям. Лихорадка, как правило, носит гектический характер, возникает ежедневно и иногда достигает максимума два раза в день и проходит в течение нескольких часов (интермиттирующая), хотя отмечен ремиттирующий и постоянный типы. В большинстве случаев лихорадка рецидивирует со «светлыми» промежутками в несколько дней, в 20% случаев переходит в хроническую форму. Диагноз БСВ часто ставится после исключения других заболеваний (инфекция, онкология) при обследовании пациента с лихорадкой неизвестного происхождения.
Сыпь, как правило, макулярная или макулопапулезная (лососевого цвета) (рис. 1.2), без зуда, не стойкая, отмечается у 50–90% больных, нередко возникает в ночные часы на пике лихорадки, поэтому может протекать незаметно для пациента, его родственников или медицинского персонала.
Рис. 1.2. Типичная сыпь при болезни Стилла взрослых
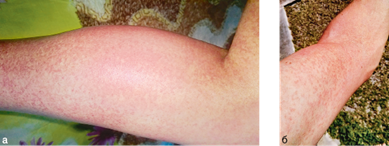
Необходимо при подозрении на БСВ, но отсутствии жалоб на сыпь, предложить пациенту (или его родственникам, медикам) осмотр кожи в ночные часы на высоте лихорадки. Типичная локализация сыпи — спина, грудь, проксимальные отделы рук, редко обнаруживается на ладонях и подошвах. У части больных отмечается и уртикарная сыпь.
Поражение суставов является кардинальным симптомом, который наблюдается у 70–100% пациентов, часто развивается полиартрит (полиартралгии) с поражением мелких суставов, так же как и при ревматоидном артрите. Наиболее часто поражаемыми суставами являются коленные, лучезапястные, голеностопные, локтевые и проксимальные межфаланговые суставы. Возможно асимметричное поражение. Крайне редко развивается поражение дистальных межфаланговых и плечевых суставов. Деструкция суставов отмечается у 1/3 больных, чаще в лучезапястных суставах вплоть до анкилоза. Чаще (у 75% больных) в мелких суставах отмечается сужение суставной щели. Выраженность суставного синдрома обычно слабая или умеренная, может носить рецидивирующий характер. Миалгии отмечались у 13–95% пациентов и часто развивались на фоне повышения температуры тела.
Часто заболевание начинается с болей в горле и лихорадки, затем могут присоединяться различные суставные и внесуставные проявления (лимфаденопатия, гепато- или спленомегалия и др.), что имитирует развитие инфекционного заболевания и ведет к назначению антибактериальной терапии, дополнительным необоснованным обследованиям и задержке с установкой диагноза болезни Стилла. В таблице 1.1 представлена частота различных проявлений БСВ, зарегистрированных в наиболее обширных группах больных, а также в нашей группе больных БСВ (n=32).
Таблица 1.1. Основные клинические проявления болезни Стилла взрослых (М*)
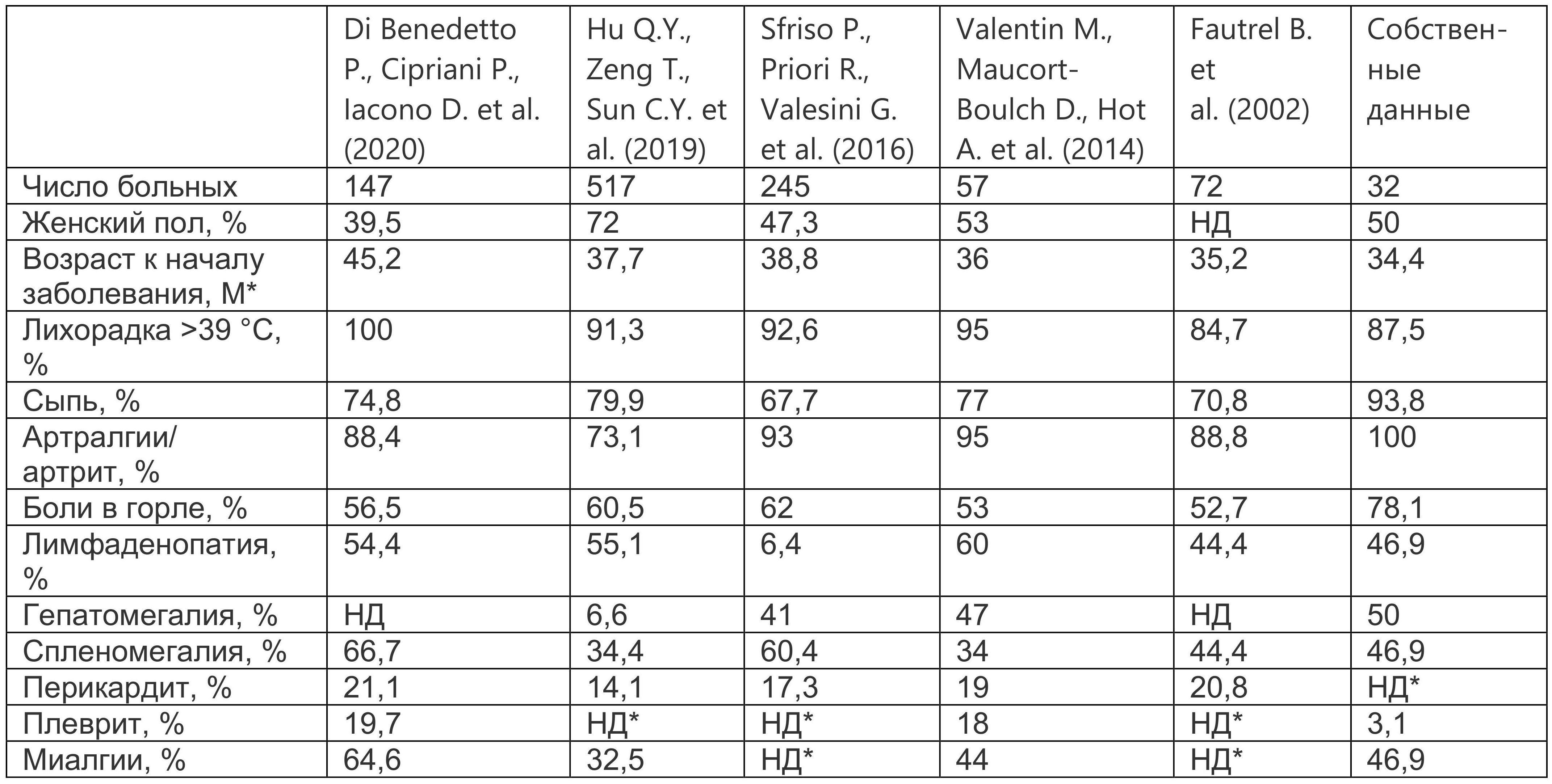
* Примечание: М — среднее значение; НД — нет данных.
Сообщают и о других клинических проявлениях при БСВ: потеря веса (11,5–66,1%), интерстициальная пневмония (1–15%), миокардит (14%), энцефалопатия (8,8%), астения (35,3%).
Лабораторные показатели. Типичны нейтрофильный лейкоцитоз (>10х109/л) со сдвигом лейкоцитарной формулы влево, обычно с нарастанием процентного содержания палочкоядерных нейтрофилов (10–20%), возможно до метамиелоцитов и миелоцитов. В нашей группе больных максимальный лейкоцитоз составил 46х109/л. Как правило, регистрируется очень высокая СОЭ (до 80 мм/час по Панченкову и более 100 мм/час по Westgren), повышение СРБ, повышенный уровень печеночных ферментов и заметно повышенный уровень ферритина в отсутствие РФ и антинуклеарных антител (табл. 1.2).
Таблица 1.2. Лабораторные показатели при болезни Стилла взрослых
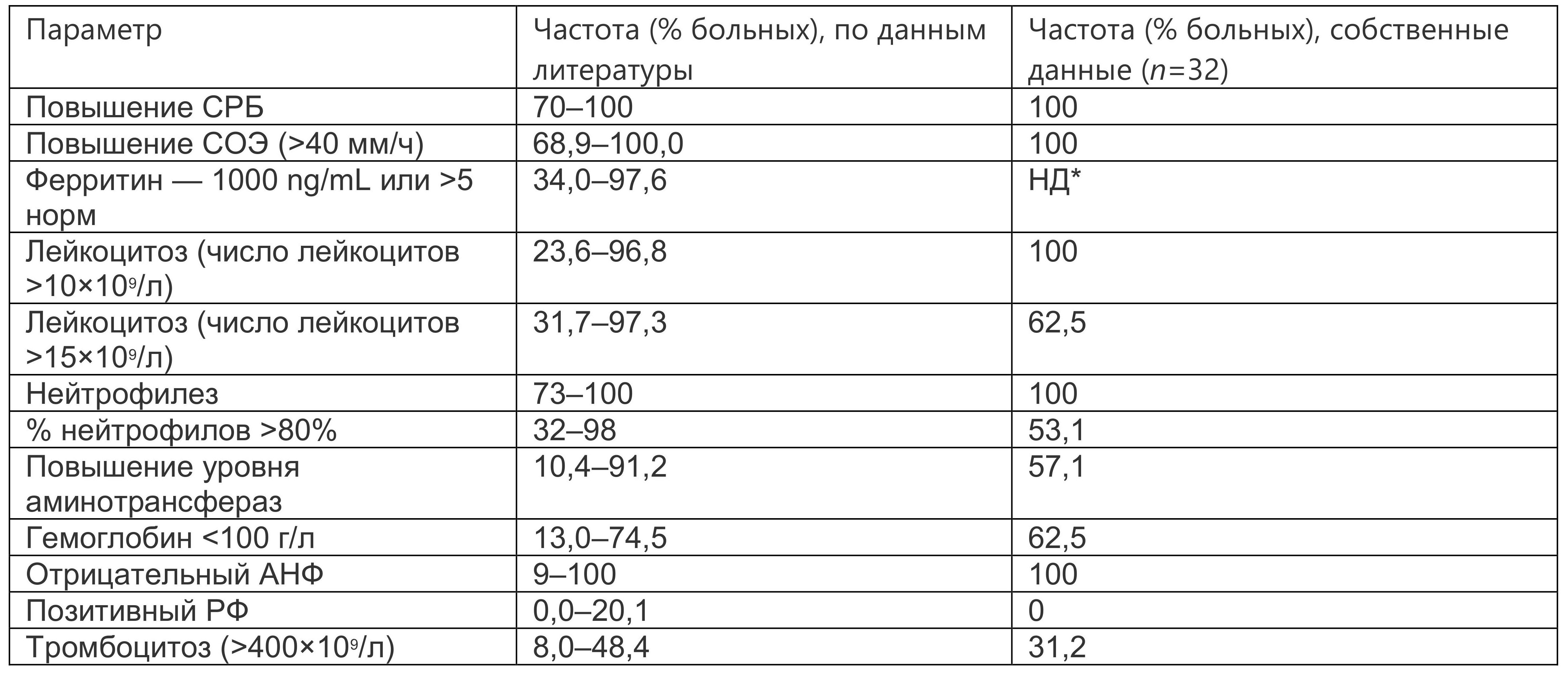
* Примечание: НД — нет данных.
Диагностика болезни Стилла. Диагностика БСВ в значительной степени зависит от квалификации врача и его осведомленности об основных проявлениях БСВ. Даже при типичной картине (лихорадка, артралгии/артрит, сыпь, нейтрофильный лейкоцитоз) следует исключить другие состояния, когда возможен такой комплекс симптомов, в первую очередь инфекции и малигнизацию. В предложенном E. Bilgin et al. алгоритме диагностического поиска при лихорадке неясного происхождения выделение больных с БСВ основывалось на результатах лабораторных исследований — повышение ферритина сыворотки и нейтрофильный лейкоцитоз. С этой же целью (выделение больных БСВ среди пациентов с лихорадкой неясного генеза) J.C. Crispin et al. предложили шкалу с балльной оценкой пяти симптомов (табл. 1.3): артрит, фарингит, типичная для синдрома Стилла сыпь, нейтрофильный лейкоцитоз и спленомегалия; диагноз БСВ подтверждается при наборе 30 баллов.
Таблица 1.3. Шкала J.C. Crispin et al. для диагностики болезни Стилла взрослых

Неспецифические клинические особенности CCВ представляют диагностическую проблему, было разработано несколько критериев для идентификации таких пациентов (табл. 1.4). Критерии классификации M. Yamaguchi и B. Fautrel являются наиболее широко используемыми критериями для БСВ.
Таблица 1.4. Классификационные критерии болезни Стилла взрослых
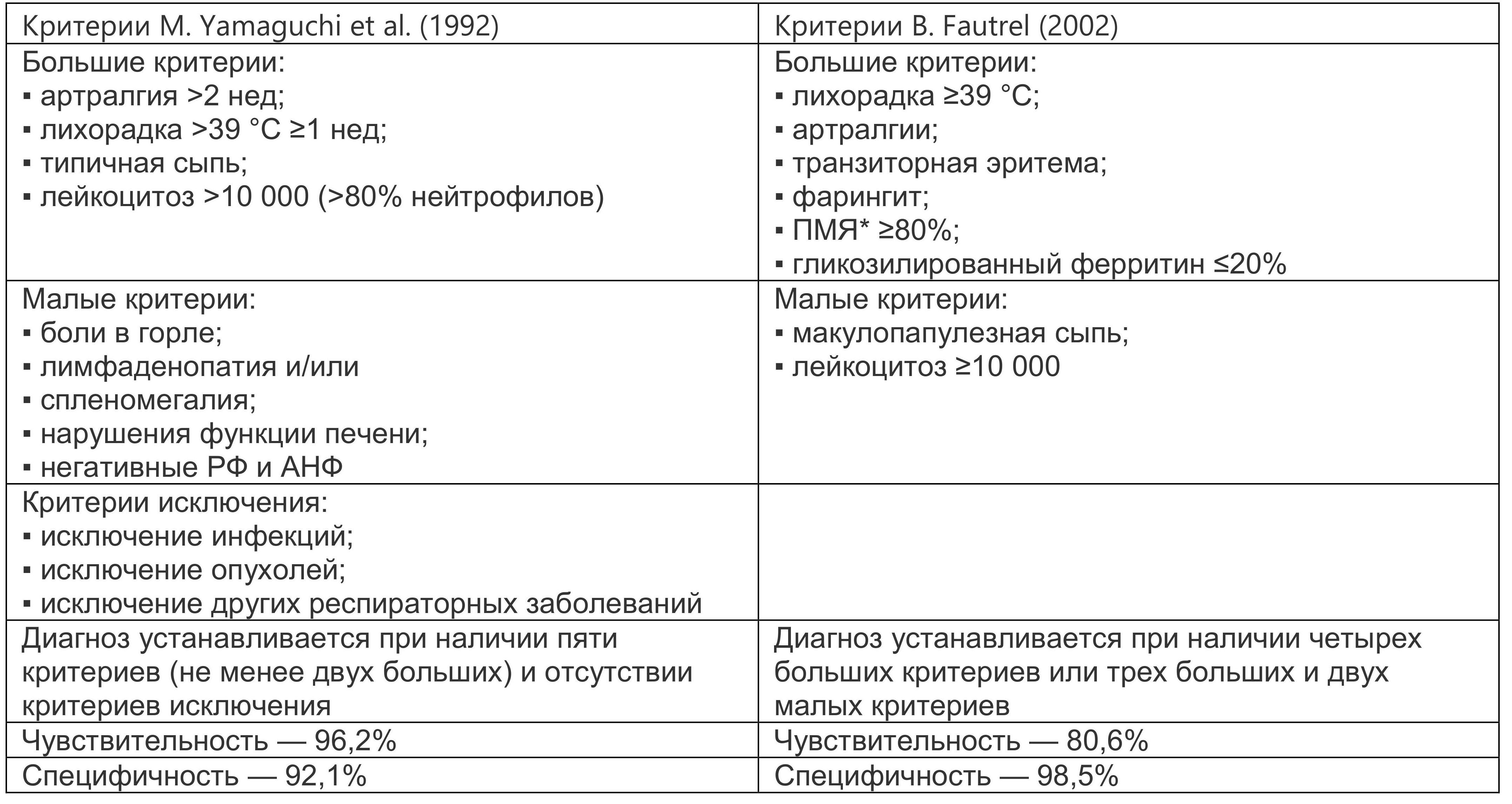
* Примечание: ПМЯ — полиморфноядерные лейкоциты.
Чувствительности критериев (96,2%) M. Yamaguchi препятствует большое количество клинических состояний, которые следует исключить, а диагностические критерии B. Fautrel требуют измерения уровня гликозилированного ферритина, который может быть недоступен во многих медицинских учреждениях, но этот показатель увеличивает специфичность критериев. Гиперферритинемия часто выявляется при БСВ (см. табл. 1.2) и может служить показателем активности заболевания. Однако ферритин имеет низкую ценность при использовании для диагностики БСВ при отсутствии характерных клинических признаков, независимо от выявленного уровня. Повышенный уровень ферритина отмечен и при других заболеваниях, таких как инфекционные заболевания, заболевания печени и почек, а также злокачественные новообразования, что может усложнить процесс дифференциальной диагностики. Некоторые исследования предполагают использование ферритина в качестве прогностического фактора перехода заболевания в хроническую форму. Потенциально более полезным биомаркером может быть гликозилированный ферритин, который обладает сравнительно более высокой чувствительностью и специфичностью. У здоровых взрослых людей 50–80% ферритина гликозилируется. Снижение процента гликозилирования ферритина может наблюдаться при различных воспалительных заболеваниях, злокачественных новообразованиях, инфекциях или заболеваниях печени, но редко составляет менее 20%. Уровни гликозилированного ферритина ниже 20% были описаны у пациентов с БСВ и гемофагоцитарным лимфогистиоцитозом. В ходе ретроспективного многоцентрового исследования оценено соответствие уровней ферритина и гликозилированного ферритина с окончательным диагнозом БСВ (при использовании критериев Yamaguchi M.). Было обнаружено, что чувствительность и специфичность теста на гликозилированный ферритин в диагностике БСВ составляют 80 и 66% соответственно при тестировании отдельно ферритина и гликозилированного ферритина и 43 и 93% соответственно при уровне ферритина, превышающем нормальное значение более чем в 5 раз.
Сложность диагностики БСВ заключается в схожести его инициальных симптомов с симптомами других заболеваний, таких как инфекции, злокачественные новообразования и другие воспалительные состояния. Бактериальная инфекция и лихорадка неясного генеза — наиболее распространенные ошибочные диагнозы, далее по частоте следует аллергия, включая лекарственную сыпь, и аутоиммунные заболевания (СКВ, РА). Кроме того, одновременное наличие всех клинических и лабораторных признаков БСВ практически не встречается, что приводит к отсрочке постановки диагноза на недели и месяцы, особенно при рецидивирующем течении БСВ.
Все известные клинические и лабораторные признаки БСВ могут не выявляться одновременно; таким образом, диагностика может быть отложена на несколько недель или месяцев, особенно у пациентов с полициклическим течением заболевания.
Осложнения болезни Стилла. Так же как при ювенильном хроническом артрите, осложнения развиваются при неадекватном лечении БСВ.
Синдром активации макрофагов (САМ) является одним из наиболее серьезных и потенциально опасных для жизни осложнений среди пациентов с БСВ, распространенность колеблется от 10 до 15%, при котором уровень смертности колеблется от 20 до 42%. САМ представляет собой острую системную воспалительную реакцию, вызванную синдромом высвобождения цитокинов; его развитие связано со значительным снижением выживаемости у пациентов с БСВ (p <0,000 1). В ретроспективном стационарном исследовании общая выживаемость была значительно ниже у пациентов с САМ, чем у пациентов без САМ (67% против 100%; р <0,001). САМ также известен как гемофагоцитарный синдром и считается формой вторичного гемофагоцитарного лимфогистиоцитоза.
В 2016 г. EULAR, ACR и Международная организация исследований в области детской ревматологии предложили классификационные критерии САМ при СИЮА: лихорадящий пациент с достоверным или подозреваемым СИЮА классифицируется как имеющий САМ при наличии следующих критериев: ферритин >684 нг/л + два из следующих параметров: число тромбоцитов ≤181×109/л, АСТ >48 ед./л, триглицериды >156 мг/дл, фибриноген ≤360 мг/дл.
Для определения, могут ли критерии САМ, осложняющего СИЮА, быть использованы для выявления САМ у пациентов с БСВ, Y. Tada et al. было проведено исследование на основании ретроспективного анализа проявлений болезни у 76 пациентов БСВ. Оценив лабораторные данные пациентов БСВ, соответствующих критериям M. Yamaguchi, с САМ и без него, была проанализирована ценность индивидуальных составляющих элементов САМ и их совокупности в критериях 2016 г. и дополнительных лабораторных показателей у пациентов БСВ с САМ (n=16) и без него (n=60). Классификационные критерии САМ при СИЮА имели общую чувствительность 100%, специфичность 70%, положительную прогностическую ценность 47,1% и отрицательную прогностическую ценность 100% для разделения пациентов БСВ с САМ и без него на основе лабораторных данных. Среди индивидуальных критериев чувствительность уровня триглицеридов (46,7%) и специфичность уровня ферритина (15,0%) для САМ при БСВ были особенно низкими (табл. 1.5).
Таблица 1.5. Чувствительность и специфичность индивидуальных классификационных критериев для диагностики синдрома активации макрофагов у пациентов с болезнью Стилла взрослых
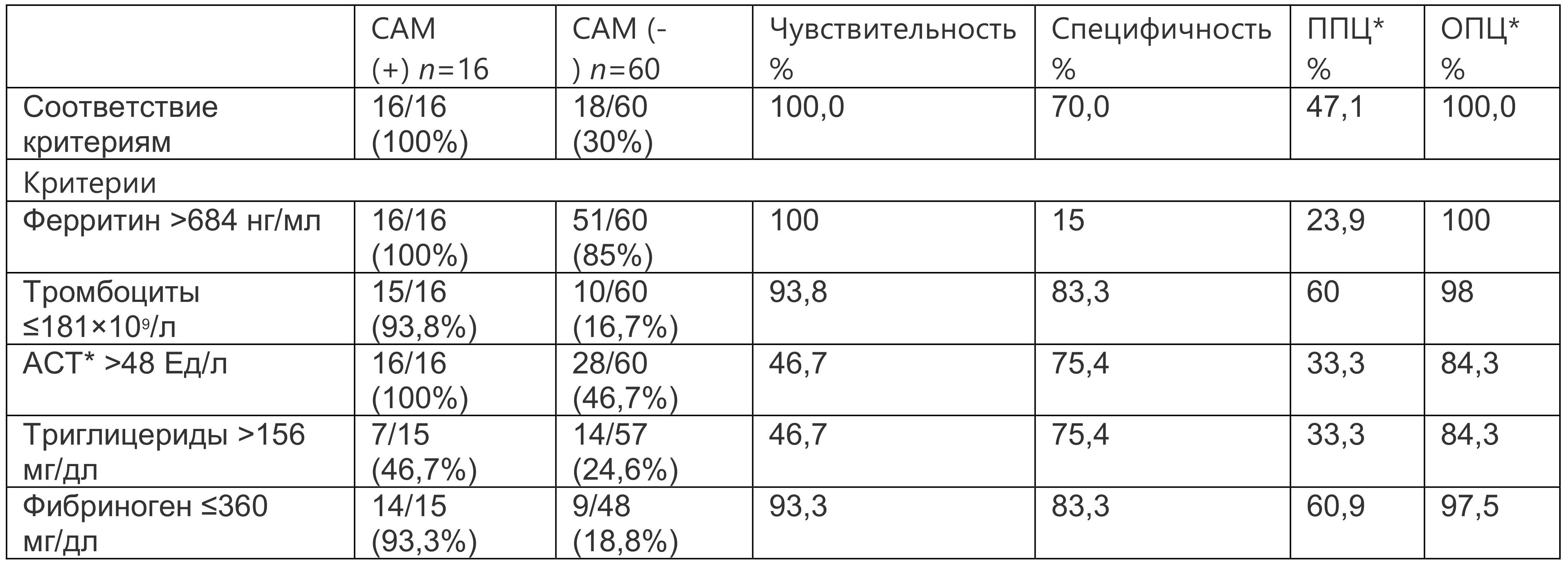
* Примечание: ППЦ — положительная прогностическая ценность; ОПЦ — отрицательная прогностическая ценность, АСТ — аспартатаминотрансфераза.
Чувствительность и специфичность для классификации САМ у пациентов с БСВ увеличились до 100 и 93% соответственно за счет исключения из критериев уровня триглицеридов и изменения значений четырех критериев САМ 2016 г. для СИЮА. Таким образом, модифицированные критерии САМ при БСВ включают ферритин >2810 мг/мл и любые два из следующих: тромбоциты ≤137×109/л, АСТ >95 ед./л и фибриноген ≤365 мг/дл. Данное исследование имеет свои ограничения — ретроспективный анализ, ограниченный контингент больных. Для окончательной разработки критериев САМ при БСВ необходимо проведение многоцентровых проспективных исследований.
Другие осложнения болезни Стилла взрослых, развивающиеся более чем у 10% пациентов, включали множественные рецидивы, миокардит, перикардиальный выпот, тампонаду сердца, сердечно-легочный шок, молниеносный гепатит, полиорганную недостаточность, деформации суставов и острый респираторный дистресс-синдром.
Вторичный амилоидоз — весьма редкое осложнение БСВ, по данным литературы, его распространенность составляет 0,88% [95% доверительный интервал (ДИ) 0,49–1,12], как правило, при длительной задержке с диагнозом в среднем на 16,75±5,80 года. Поражение почек было наиболее распространенным проявлением вторичного амилоидоза (протеинурия, отеки, почечная недостаточность).
Болезнь Стилла взрослых может осложняться двумя серьезными нарушениями свертываемости крови, главным образом в острой фазе заболевания. Диссеминированное внутрисосудистое свертывание крови (ДВС-синдром) возникает с частотой 1–5%. Этот диагноз следует заподозрить при сочетании тромботических явлений и кровоизлияний в кожу или слизистые оболочки, а иногда и при поражении внутренних органов, таком как молниеносный гепатит, сердечная или дыхательная недостаточность или инсульт. В анализах гемостаза выявляют потребление тромбоцитов и факторов свертывания крови, увеличенное тромбопластиновое время и высокий уровень D-димера.
Другим редким, но довольно серьезным нарушением свертываемости крови является тромботическая микроангиопатия. Ее следует подозревать при необъяснимой полиорганной недостаточности или инсульте, связанных с множественными мелкими тромбами, приводящими к ишемии тканей и механической гемолитической анемии. Острое нарушение зрения (затуманенное зрение), связанное с ретинопатией, часто является первым симптомом. Лабораторно определяется тромбоцитопения, анемия и шистоциты (фрагментированные красные кровяные тельца), что специфично для этой тромботической микроангиопатии. Визуализация органов может выявить множественные инфаркты. Тромботическая микроангиопатия в основном описывалась во время нарастания симптомов болезни Стилла, связанного с интенсивным воспалением или сопутствующей инфекцией микроорганизмами, продуцирующими токсин Шига (шигеллы).
Легочная артериальная гипертензия — крайне редкое, но очень тяжелое проявление БСВ. Легочная артериальная гипертензия при БСВ, как и при других заболеваниях соединительной ткани, как полагают, связана, по крайней мере частично, с иммунными изменениями эндотелия с перепроизводством ИЛ-1, ИЛ-6, ИЛ-18 и TNF. Легочная артериальная гипертензия может возникать и в дебюте БСВ, и позже, чаще у женщин. Диагноз должен быть заподозрен при необъяснимой и часто быстро прогрессирующей одышке. При электрокардиографии могут быть выявлены признаки гипертрофии правого предсердия; эхокардиографически отмечается систолическое давление в легочной артерии более 35 мм рт.ст. и дисфункция левого желудочка.
У пациентов с болезнью Стилла наблюдаются три основных варианта течения заболевания: моноциклический, полициклический и хронический суставной (см. табл. 1.3). Моноциклический вариант характеризуется единственным системным эпизодом, полностью разрешающимся в течение нескольких месяцев (21,1–64,3% больных); полициклический (также называемый рецидивирующий) вариант — одна или несколько вспышек заболевания с полными ремиссиями между ними, ремиссии могут длиться до двух лет (9,3–50,0% больных), хронический вариант обычно проявляется длительным полиартритом (без системных проявлений) (11,9–55,6% больных).
Возможно разделение больных БСВ на две подгруппы — с преобладанием системных клинических симптомов, таких как лихорадка и кожная сыпь, и с преобладающим поражением суставов, более похожим на классические признаки РА. H. Ichida et al. описали две подгруппы пациентов с БСВ: подтип, не связанный с РА, который характеризуется тяжелым системным воспалением, и РА-подобный подтип, характеризующийся хроническим, иногда эрозивным, артритом. Примерно у 50–70% пациентов развивается хроническая полициклическая форма заболевания или хронический полиартрит, который со временем может привести к деструкции суставов. Colina et al. отметили, что сохранение высоких уровней ферритина после активного лечения может быть предиктором хронического суставного варианта с прогрессированием повреждения. Кроме того, данные крупного многоцентрового исследования показали, что отсроченный диагноз является важным фактором, связанным с развитием хронического заболевания. Было обнаружено, что рецидивирующий или хронический суставной варианты чаще встречаются, когда диагноз был поставлен более чем через 6 мес от дебюта болезни.
Терапевтическая тактика при БСВ различна при разных вариантах течения болезни, которые можно оценить только при длительном наблюдении больных. Чаще всего клиницист ориентируется на выраженность клинических проявлений болезни, то есть на активность заболевания и семиотику проявлений (наличие или отсутствие системности). Предложенный алгоритм ведения больных БСВ учитывает именно эти параметры на первом этапе лечения (рис. 1.3)
Рис. 1.3. Алгоритм ведения больных с болезнью Стилла взрослых
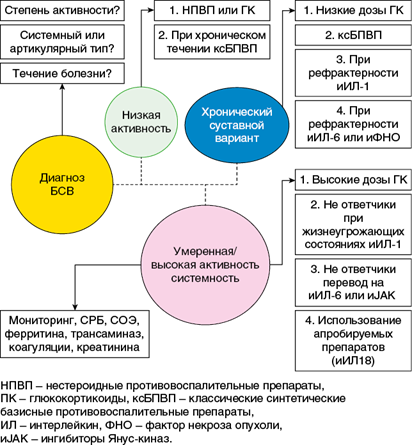
К препаратам первой линии относятся нестероидные и стероидные противовоспалительные препараты и ксБПВП, второй линии — ГИБП из класса ингибиторов ИЛ-1, третьей и четвертой линии — ГИБП с другим механизмом действия и иJAK.
Нестероидные и стероидные противовоспалительные препараты. У пациентов БСВ с низкой активностью и ограниченным суставным поражением можно достичь ремиссии с помощью нестероидных противовоспалительных препаратов (НПВП) и низких доз ГК без дальнейшего рецидивирования. В нашей когорте больных (n=32), клиническая характеристика которых представлена в табл. 1.6, лечение начиналось с назначения НПВП, что позволяло либо снизить температуру тела до субфебрильной (19 пациентов), либо купировать лихорадку (13 пациентов). В большинстве случаев больные БСВ переносят даже фебрильную лихорадку относительно легко, поэтому мы предпочитали не назначать ГК, пока не оценена выраженность эффекта при использовании ксБПВП. В литературе есть данные, что более 80% пациентов с БСВ не достигают ремиссии при использовании НПВП (т.е. 20% больных все же достигают ремиссии), что позволяет рассматривать НПВП как симптоматическое средство, а лечение БСВ нужно проводить с использованием ксБПВП. Как видно из таблицы 1.6, наши больные большей частью имели системные проявления (гепато- и спленомегалия, лимфаденопатия), поэтому параллельно с назначением НПВП во всех случаях назначались и ксБПВП, целью терапии мы ставили подавление активности заболевания и предотвращение хронизации БСВ.
Таблица 1.6. Демографическая и клиническая характеристика 32 больных болезнью Стилла взрослых (собственные данные)
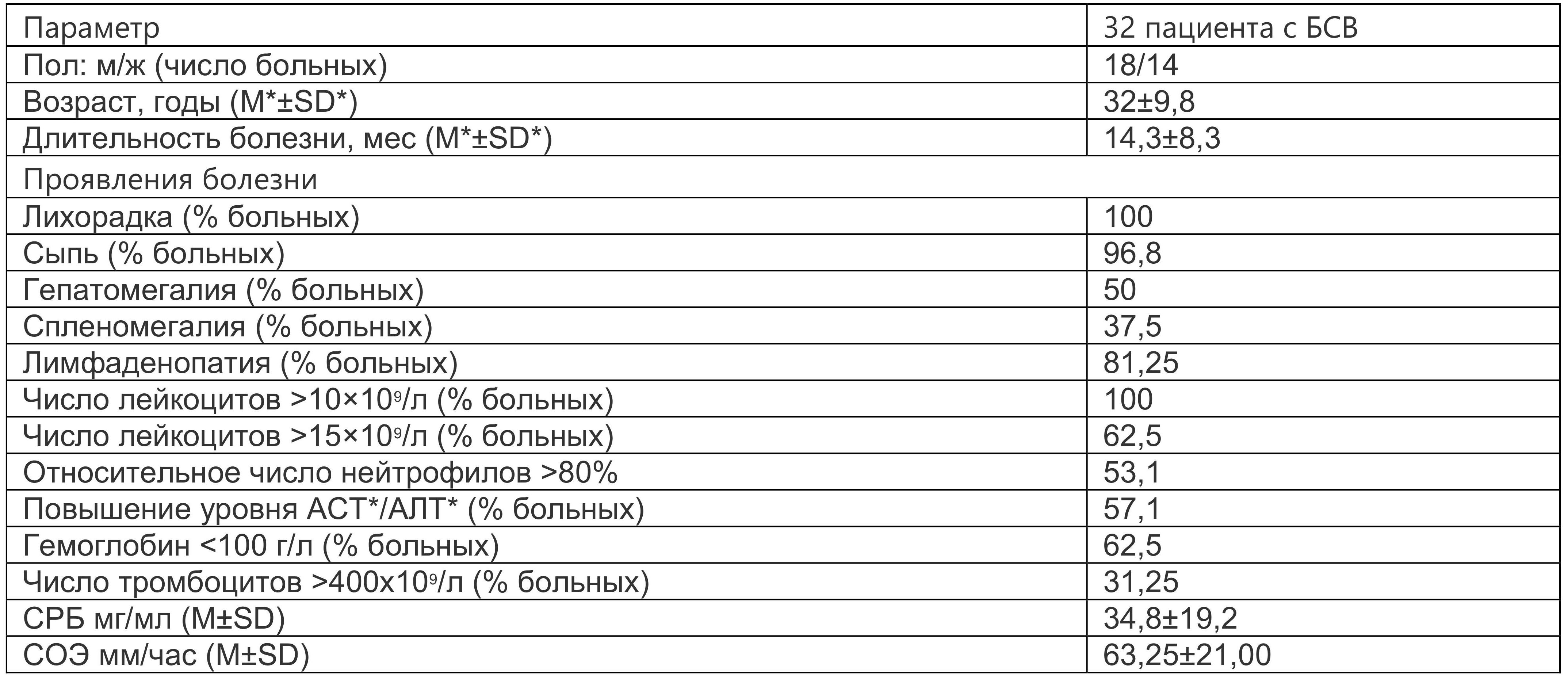
* Примечание: АСТ — аспартатаминотрансфераза, АЛТ — аланинаминотрансфераза, М — среднее значение, SD — стандартное отклонение.
Преднизолон, дексаметазон и метилпреднизолон (системная терапия ГК) — наиболее часто, по данным литературы, назначаемые средства, их использование приводит к ремиссии примерно у 65% пациентов и демонстрирует большую эффективность в устранении системных симптомов (в отличие от суставных симптомов). Хотя рядом авторов предлагалось в дебюте лечения БСВ использовать высокие дозы ГК — 0,5–1,0 мг/кг веса, в большинстве случаев используются низкие дозы ГК, высокие дозы оправданы при развитии осложнений БСВ. Безусловно, применение высоких доз ГК у нелеченых больных позволяет быстрее достичь клинической ремиссии, чем на низких дозах ГК. В исследовании P. Ruscitti et al. при ретроспективном анализе данных отмечено достоверно более частое достижение ремиссии через 6 мес терапии высокими дозами ГК у 38 больных БСВ (0,8–1,0 мг/кг в сутки преднизолона) по сравнению с лечением низкими дозами ГК 35 больных БСВ (0,2–0,3 мг/кг в сутки преднизолона) — в 64,8 и в 22,85% случаев соответственно (p <0,001). Кроме того, авторы отмечают и более частое моноциклическое течение при назначении в дебюте терапии высоких доз ГК — в 44,73% случаев против 8,57% при использовании низких доз ГК (p <0,001) при наблюдении больных в течение 12 мес. Авторы не отметили серьезных осложнений терапии в относительно короткий период наблюдения. Поскольку исследование было ретроспективным, интерпретировать эти данные надо с известной осторожностью, что отмечают и сами авторы. Назначение высоких доз ГК при низкой активности артикулярного варианта может быть сопряжено с развитием НЯ, что продемонстрировано в клиническом случае из собственной практики.
Классические синтетические БПВП. Пациенты с полициклическим системным артритом или хроническим артритом относительно трудно поддаются лечению и могут потребовать дальнейшего лечения ксБПВП и/или биологическими препаратами. Большинство пациентов с БСВ (в том числе и больные нашей группы) получали лечение по крайней мере одним ксБПВП, причем наиболее часто используемым препаратом был метотрексат. Обзор литературы показывает, что метотрексат эффективен для контроля заболеваний и при системном, и при хроническом суставном варианте БСВ, особенно у 40–70% стероидозависимых пациентов. В нашей группе больных метотрексат был назначен 23 пациентам и показал высокую эффективность в дозах 15–25 мг/нед: купирование лихорадки у всех больных, реальное уменьшение активности суставного поражения и выраженности системных проявлений отмечалось в те же сроки, что и при лечении РА — через 2–3 мес от начала терапии, в эти же сроки начинали нормализоваться и лабораторные показатели. Применение метотрексата у пациентов БСВ с вовлечением печени не является противопоказанным, но необходим постоянный мониторинг уровня трансаминаз.
ГИБП и таргетные синтетические БПВП. Резистентность к ГК и тсБПВП определяет рефрактерный вариант БСВ, при котором в основном отмечается полициклическое или хроническое течение заболевания. В таких случаях следующим шагом в лечении БСВ является назначение ГИБП.
- Ингибиторы фактора некроза опухоли альфа (ФНО-α)
Ингибиторы ФНО-α были первыми биологическими агентами, используемыми при БСВ.
В 2001 г. инфликсимаб впервые был применен у трех пациентов с хроническим и активным БСВ, не ответивших на терапию ГК и метотрексатом, и показал длительную эффективность (до 50 нед) при лечении рецидива рефрактерного БСВ. Значительное улучшение клинических проявлений и нормализация лабораторных показателей наблюдались у всех шести больных БСВ с высокой активностью заболевания после лечения инфликсимабом. В обсервационном исследовании с участием 20 пациентов с БСВ 10 пациентов получали инфликсимаб, пять — этанерцепт и пять — оба препарата. При лечении инфликсимабом четыре пациента достигли полной ремиссии, девять достигли частичной ремиссии, при лечении этанерцептом частичного ответа достигли семь из 10 пациентов, и только один пациент достиг полной ремиссии. В открытом исследовании 12 пациентов с БСВ с активным артритом, рефрактерным к ксБПВП, получали этанерцепт с уменьшением выраженности артритов и отсутствием побочных эффектов. Безопасность и эффективность адалимумаба при БСВ остаются неопределенными, поскольку имеются лишь отдельные описания случаев.
В отличие от признанной эффективности ингибиторов ФНО-α при РА и спондилоартритах, продемонстрированной в многочисленных исследованиях и в результатах многолетней клинической практики, эффективность ингибиторов ФНО-α при БСВ является спорной. Вероятно, их следует назначать только пациентам с хроническим суставным вариантом болезни и на развернутой стадии для подавления прогрессирования деструкции.
- Ингибиторы интерлейкина-1 бета (ИЛ-1α)
Поскольку роль ИЛ-1β в патогенезе БСВ показана в многочисленных исследованиях, ингибирование ИЛ-1β уже стало установленной целью в лечении БСВ. К настоящему времени большинство сообщений касаются эффективности и переносимости двух биологических препаратов, нацеленных на ИЛ-1 (анакинра и канакинумаб).
Анакинра лицензирована для подкожного применения при СИЮА, периодической лихорадке, РА и БСВ (только Европейским агентством по лекарственным средствам). Анакинра, рекомбинантный гуманизированный антагонист рецептора ИЛ-1, является препаратом, часто назначаемым при БСВ, эффективность его выше при системном варианте заболевания, чем при суставном варианте. Быстрое улучшение системных проявлений БСВ после приема анакинры было хорошо продемонстрировано в недавнем крупном наблюдательном ретроспективном многоцентровом исследовании с участием 140 пациентов из 18 центров Италии. Средняя продолжительность заболевания составила 50,3±81,67 мес, и большинство участников (n = 111) получали анакинру в качестве биологического средства первой линии. Предыдущим лечением были НПВП, ГК или ксБПВП (табл. 1.7).
Таблица 1.7. Предшествующая терапия болезни Стилла взрослых до назначения анакинры
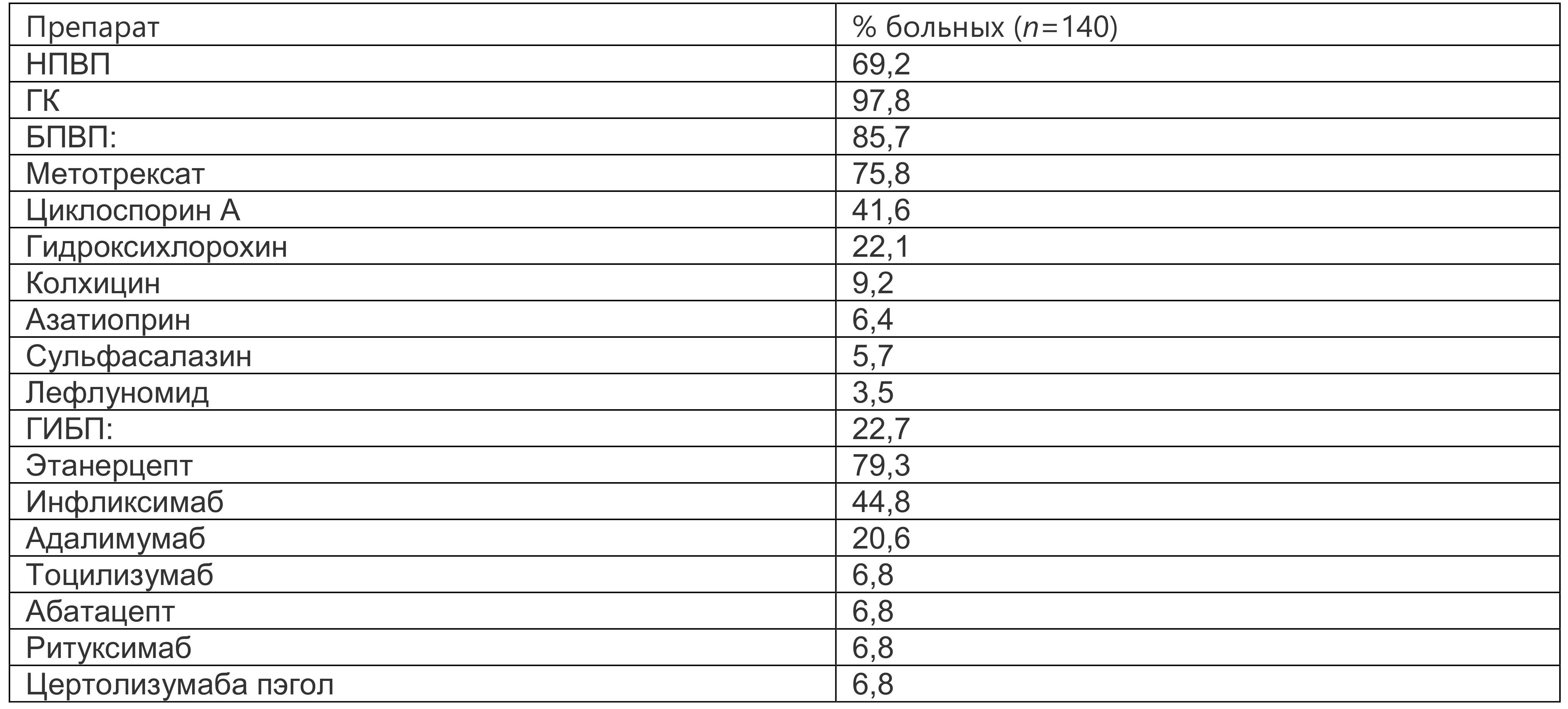
Анакинра 127 пациентам из 140 (90,7%) назначалась подкожно в дозе 100 мг в день; более высокие или более низкие дозы были назначены в 13 из 140 случаев (9,3%). У четырех пациентов с высокоактивной системной формой заболевания использовалась более высокая доза анакинры: у трех пациентов (2,1%) начальная доза анакинры составила 200 мг/сут, а один пациент (1,5%) получал 150 мг/сут. Ввиду проблем с переносимостью девяти пациентам были назначены более низкие, нетрадиционные дозы, т.е. 50 мг в день (один случай) или 100 мг через день (восемь случаев).
Результаты показали значительное улучшение клинических и серологических показателей заболевания уже через 3 мес лечения (табл. 1.8), а среднее значение индекса активности (DAS28) через 3 мес соответствовало ремиссии.
Таблица 1.8. Динамика клинических и лабораторных проявлений болезни Стилла взрослых за 12-месячный период лечения анакинрой (% больных)
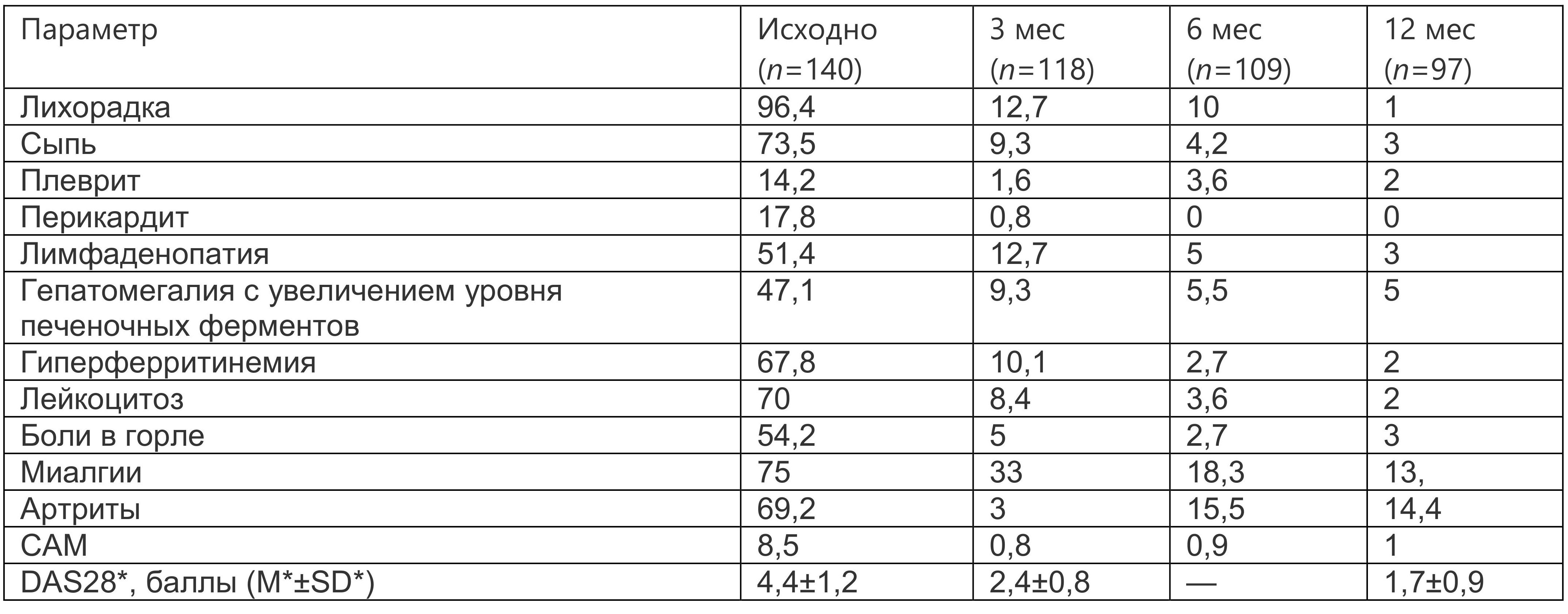
* Примечание: DAS (disease activity score) — индекс активности болезни, М — среднее значение, SD — стандартное отклонение.
Первичная и вторичная неэффективность в течение 12 мес лечения отмечены у 15 из 140 и 11 из 140 пациентов соответственно. Различий в клиническом или серологическом ответе на лечение в зависимости от возраста, пола или характера заболевания (системное или хроническое суставное) не выявлено.
Наиболее частыми НЯ были инъекционные реакции (у 59,5%), диффузная уртикарная сыпь (25,5%), инфекции (12,7%), лейкопения (2,1%), тромбоцитопения (4,2%).
При развитии САМ более медленная абсорбция анакинры при подкожном введении является серьезным недостатком, предпочтительнее использовать внутривенное введение препарата. Сообщается о лечении 18 больных БСВ с САМ внутривенной формой анакинры с хорошим эффектом, что позволяет рекомендовать внутривенную форму анакинры в качестве препарата первой линии из ГИБП при САМ.
Канакинумаб — полностью человеческие высокоспецифичные моноклональные антитела (МАТ) к ИЛ-1β человека, не взаимодействуют с другими представителями семейства ИЛ-1, включая ИЛ-1α и рецепторный антагонист (Ра) ИЛ-1. По данным фармакокинетических и фармакодинамических исследований, объем распределения и клиренс канакинумаба не зависят от возраста больных с коррекцией на массу тела. Для лечения болезни Стилла детей (вес более 7,5 кг) и взрослых рекомендуемая доза канакинумаба составляет 4 мг/кг (максимальная доза — 300 мг) 1 раз в 4 или 8 нед.
По данным систематического обзора, полный ответ (исчезновение всех клинических проявлений, включая лихорадку, кожную сыпь, артралгии/артрит, лимфаденопатию, гепатоспленомегалию, лейкоцитоз, лабораторные нарушения) имел место у 68,7% пациентов; частичный эффект — у 16,2% пациентов; у 15,1% пациентов улучшение отсутствовало или имело место развитие нежелательных лекарственных реакций. В большинстве исследований отмечено положительное влияние терапии канакинумабом на лейкоцитоз (у 73,8% пациентов), снижение СОЭ (у 88,9%), уровня ферритина (у 87,9%) и СРБ (у 95,4%). Особенно большое значение может иметь стероидосберегающий эффект (отмена или снижение дозы ГК) канакинумаба, который имел место у 65,6% пациентов.
Для оценки эффективности и переносимости канакинумаба было проведено рандомизированное плацебо-контролируемое исследование фазы II CONSIDER (Canakinumab for Treatment of Adult-Onset Still’s Disease to Achieve Reduction of Arthritic Manifestation), двойной слепой период продолжался 12 нед, и еще 12 нед была открытая фаза, все больные с отсутствием эффекта на фоне плацебо переводились на лечение канакинумабом. Из рандомизированных 36 пациентов с БСВ, соответствующих критериям Jamaguchi, 19 пациентам был назначен канакинумаб и 17 пациентов получали плацебо. Первичный результат определялся как доля пациентов с клинически значимым уменьшением суставных проявлений, оцениваемым по изменению индекса активности заболевания (ΔDAS28-СОЭ>1,2) на 12 нед. У 12 пациентов в группе канакинумаба и семи пациентов в группе плацебо отмечено снижение DAS28-СОЭ более чем на 1,2 балла к 12-й неделе, что соответствует хорошему эффекту по критериям EULAR (у 66,7% больных и у 41,2% больных соответственно). На 12-й неделе 77,8% пациентов, получающих канакинумаб, сообщили об отсутствии у них в течение 7 дней лихорадки (против 64,7% больных на плацебо). Достоверного различия снижения средней величины DAS28-СОЭ за 12 нед терапии канакинумабом по сравнению с плацебо, так же как и частоты ответа по критериям ACR, не отмечено. Из 12 ответчиков по критериям EULAR на канакинумабе к 12-й неделе 10 пациентов оставались ответчиками до 24-й недели и два — до 20-й недели. У четырех пациентов сохранялась ремиссия DAS28-СОЭ (<2,6), в то время как у остальных трех пациентов активность заболевания была низкой (<3,2) в течение всего открытого периода.
В течение первого 12-недельного периода этого исследования у двух пациентов на канакинумабе наблюдались серьезные НЯ (повышение активности печеночных ферментов и пателлофеморальный болевой синдром, приведшие к госпитализации). Еще семь серьезных НЯ наблюдались во втором периоде исследования (между 12-й и 24-й неделями): у двух пациентов на канакинумабе — тромбоз глубоких вен и гипотония, и еще пять у одного пациента, получавшего плацебо, — перелом в V пястно-фаланговом суставе и удаление спицы в этом суставе, перелом кисти, боли в верхней части живота и острый холецистит. Хотя исследование было краткосрочным (24 нед) и первичная конечная точка не достигла статистической значимости, лечение пациентов с БСВ и активным поражением суставов канакинумабом привело к улучшению нескольких показателей. Профиль безопасности был аналогичен тому, о котором сообщалось для СИЮА, и никаких неожиданных проблем с безопасностью не наблюдалось. Эти данные подтверждают эффективность лечения пациентов с БСВ канакинумабом в дозе 4 мг/кг массы тела каждые 4 нед. В рамках исследования CONSIDER было показано, что на фоне лечения канакинумабом (в отличие от группы плацебо) у пациентов, ответивших на терапию, уже через 4 нед наблюдалось статистически значимое снижение концентрации кальпротектина, S100A12, ИЛ-6 и ИЛ-18 в отсутствие динамики хемокинов (CXCL10 и CXCL13) и рCD163, несмотря на их высокий базальный уровень. Эти данные свидетельствуют о влиянии терапии канакинумабом на ведущие (ИЛ-18/ИЛ-6 зависимые) механизмы патогенеза БСВ.
Следует отметить, что в исследовании CONSIDER более половины (56,5%) пациентов ранее получали другой ингибитор ИЛ-1 — анакинру, которая до недавнего времени чаще всего назначалась при рефрактерной форме БСВ и САМ. Имеются важные фармакологические отличия анакинры и канакинумаба, заключающиеся в периоде полувыведения препаратов: 4–6 ч у анакинры и 26 дней — у канакинумаба, что возможно, позволяет добиться эффекта на канакинумабе при неэффективности в анамнезе анакинры. Таким образом, эффективность терапии канакинумабом при БСВ позволяет преодолеть резистентность к терапии ГК, ксБПВП, ингибиторами ФНО-α, ИЛ-6 или анакинрой и ассоциируется с высокой частотой ремиссии, позволяет оптимизировать дозу глюкокортикоидов.
Эффективность канакинумаба показана и в открытых исследованиях. Так, в исследовании Lascari et al. у 39 больных с суставной формой БСВ полная ремиссия зарегистрирована у 68% больных и частичная ремиссия — у 16% за 12 мес терапии. Ряд авторов сообщают о развитии полной ремиссии у больных с системной формой БСВ.
- Ингибиторы рецепторов интерлейкина-6 (ИЛ-6)
Тоцилизумаб представляет собой гуманизированное антитело к рецепторам ИЛ-6.
Iwamoto et al. впервые применили тоцилизумаб у пациентов с рефрактерным БСВ в 2002 г. с развитием клинико-лабораторного эффекта. Во многих сообщениях представлены данные об эффективности тоцилизумаба при лечении как системных, так и хронических суставных форм БСВ (табл. 1.9).
Таблица 1.9. Данные об эффективности тоцилизумаба при лечении системных и хронических суставных форм болезни Стила взрослых
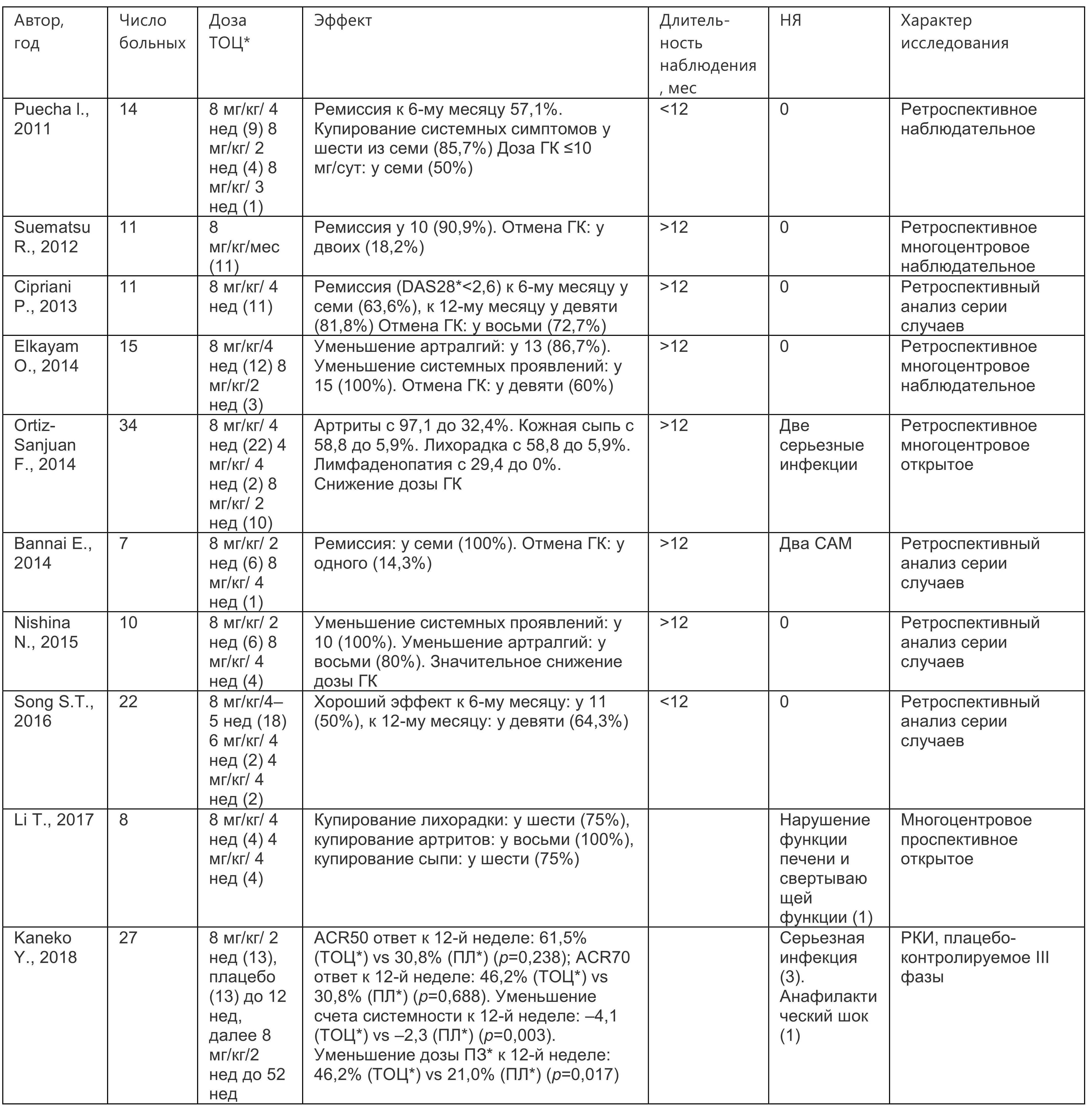
* Примечание: ТОЦ — тоцилизумаб; ПЛ — плацебо; ПЗ — преднизолон, DAS (disease activity score) — индекс активности болезни.
По данным недавнего обзора литературы, лечение ингибитором рецепторов ИЛ-6 тоцилизумабом 124 больных БСВ привело к развитию эффекта у 76,07%, в том числе и у больных, ранее получавших ксБПВП и ГИБП с другим механизмом действия (ингибиторы ФНО-α), но в некоторых случаях было отмечено развитие САМ на фоне терапии.
Имеется сообщение о применении сарилумаба, другого ингибитора рецепторов ИЛ-6, при БСВ: отмечено улучшение клинических проявлений у 25-летнего мужчины с возможностью отмены ГК при кортизонозависимости.
- Ритуксимаб
Роль В-клеток при БСВ еще предстоит определить. Возможно, что лечение, нацеленное на В-клетки, может ингибировать высвобождение провоспалительных цитокинов, опосредованное Т-клетками. Ритуксимаб, химерное МАТ против CD20, может ингибировать активацию Т-клеток и выработку провоспалительных цитокинов. Лишь в единичных сообщениях о случаях применения ритуксимаба при БСВ была показана потенциальная эффективность ритуксимаба у рефрактерных пациентов.
- Абатацепт
Абатацепт представляет собой полностью человеческий рекомбинантный белок CTLA4 Ig, который блокирует костимуляцию активации Т-клеток, потенциальная патогенетическая роль которых показана для БСВ. Кроме того, абатацепт снижает выработку провоспалительных цитокинов, включая интерферон-c и ИЛ-17. Описаны случаи успешного применения абатацепта при лечении рефрактерного БСВ с неэффективностью ксБПВП, анакинры и адалимумаба.
- Ингибиторы Янус-киназ
Ингибиторы JAK — эффективная терапевтическая стратегия при лечении воспалительных заболеваний, таких как РА, СКВ и СпА. Ингибиторы JAK препятствуют действию ИЛ-6, ИЛ-10, IFN-c, IFN-a и GM-CSF, которые сильно вовлечены в патогенез БСВ.
Тофацитиниб
В 2019 г. тофацитиниб, панингибитор JAK, впервые был применен у 14 пациентов с рефрактерным БСВ. Семь пациентов с БСВ достигли полной ремиссии с уменьшением сопутствующих ГК, шесть пациентов достигли частичной ремиссии, а у одного произошел рецидив при снижении дозы преднизолона. Это позволяет предположить, что тофацитиниб может быть альтернативой при лечении БСВ, особенно у пациентов с суставной формой.
Барицитиниб
Впервые в 2019 г. сообщено об эффективности барицитиниба, селективного иJAK 1-го и 2-го типа, у пациента со стероидозависимой рефрактерной БСВ: 43-летняя женщина с БСВ с 2010 г. лечилась ксБПВП в сочетании с ГК, но при снижении дозы преднизолона до 20 мг/сут отмечен рецидив заболевания, с 2013 г. получала анакинру с хорошим эффектом и отменой ГК, и вновь с развитием рецидива, назначением ГК 1 мг/кг веса и активацией при попытке снижения дозы ГК. Был назначен в 2014 г. инфликсимаб. Однако у больной через неделю после одной инфузии развилась реакция гиперчувствительности, далее назначались тоцилизумаб и абатацепт без явного эффекта. В 2017 г. была назначена комбинация барицитиниба 4 мг/сут и анакинры, через 1 мес стала возможна отмена ГК без нарастания активности БСВ, через 9 мес терапии достигнута полная ремиссия с отсутствием клинических симптомов и нормализацией лабораторных показателей с последующим постепенным уменьшением дозы анакинры.
Первые сообщения об успешном применении иJAK свидетельствуют, что препараты данного класса могут быть эффективны при БСВ, т.к. ингибируют ИЛ-6 и интерферон-ã, которые участвуют в патогенезе БСВ. Определение места иJAK требует дальнейших клинических испытаний.
Болезнь Стилла у взрослых является довольно редким заболеванием, дебютирующим с симптомов, которые могут имитировать инфекционные или онкологические заболевания. Недостаточная информированность врачей первичного звена о клинико-лабораторных проявлениях БСВ нередко приводит к задержке постановки диагноза, что снижает и эффективность проводимой терапии. При ранней диагностике БСВ и раннем назначении адекватной терапии ксБПВП (предпочтительнее метотрексат), как правило, отмечается моноциклический вариант болезни и вариант с двумя-тремя рецидивами без хронизации процесса и развития осложнений БСВ. У наших больных, прослеженных проспективно до 7 лет, развития САМ не наблюдалось ни в одном случае. Данные литературы свидетельствуют, что осложнения БСВ обычно отмечаются при длительной задержке диагностики и назначения противоревматических препаратов. Представляется, что неверно считать ГК препаратами первой линии, которые нужно обязательно назначать. При хорошем симптоматическом ответе на НПВП можно избежать назначения стероидных средств. Высокие дозы ГК показаны только при хроническом высокоактивном течении заболевания и при развитии САМ. В настоящее время имеется довольно большой арсенал лекарственных средств для лечения БСВ, который постоянно пополняется.
12.03.2023 | 16:26:19