Риск внезапной сердечной смерти. Синдром Бругада. Кардиомиопатии. Шкала MADIT-II, шкала HCM Risk-SCD и другие.
Раздел: Статьи
/
Общая врачебная практика.
/
Кардиология.
/
Риск внезапной сердечной смерти. Синдром Бругада. Кардиомиопатии. Шкала MADIT-II, шкала HCM Risk-SCD и другие.
Содержание
- Введение
- Систолическая дисфункция левого желудочка
- Гипертрофическая кардиомиопатия
- Синдром удлиненного интервала QT
- Синдром короткого интервала QT
- Синдром Бругада
- Аритмогенная кардиомиопатия
Примерно пятая часть всех смертей соответствует критериям внезапной сердечной смерти (ВСС), которую связывают с фибрилляцией желудочков, реже с асистолией при отсутствии терминальной дисфункции жизненно важных органов.
Почти в половине случаев внезапная остановка сердца происходит у пациентов без известных ССЗ, но у большинства из них впоследствии выявляется значимый атеросклероз коронарных артерий.
Важность прогноза внезапной остановки сердца подчеркивают данные регистра Tufts PACE, содержащие 81 модель, оценивающую риск ВСС (Carrick R. et al., 2020).
Основные факторы риска включают перенесенный ранее эпизод ВСС, систолическую дисфункцию ЛЖ, кардиомиопатию (гипертрофическую, дилатационную, аритмогенную), каналопатию (синдромы удлиненного и короткого интервала QT, синдром Бругада) и т.д.
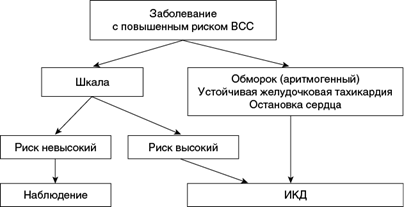
Для предупреждения ВСС наряду с лечением, специфическим для определенного заболевания, у пациентов группы высокого риска применяются ИКД (рис. 1.1). Если для пациентов после остановки сердца или с симптомной желудочковой тахикардией польза ИКД обычно очевидна, то выбор для первичной профилактики часто сложен. Правильный отбор пациентов для имплантации устройств весьма важен в связи с их высокой стоимостью, проблемой неадекватных разрядов, возможностью смерти, не предупреждаемой электрическим разрядом (ESC, AHA/ACC). С этой целью наряду с клиническими критериями предлагают использовать многочисленные прогностические шкалы.
Рис. 1.1. Общий алгоритм отбора пациентов для установки имплантированного кардиовертера-дефибриллятора (ИКД)
Кроме шкал, привязанных к заболеваниям сердца, на основании данных фремингемского исследования разработана модель прогноза ВСС, основанная на распространенных факторах риска, включая возраст, пол, уровень общего холестерина, АД, курение, СД, индекс массы тела, антигипертензивное и липид-нормализующее лечение (Bogle B. et al., 2018).
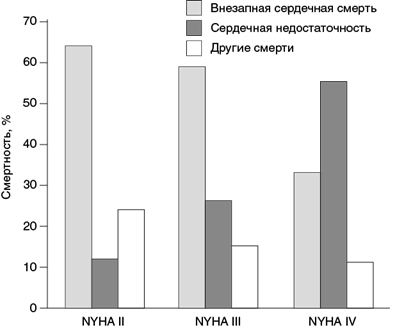
Почти 40% смертей пациентов с систолической дисфункцией ЛЖ обусловлена желудочковыми тахиаритмиями и классифицируются как аритмогенные или ВСС. У пациентов, имеющих СН с сохраненной ФВЛЖ, доля ВСС ниже и оценивается в 25–30%, что связывают с большей долей несердечных причин смерти (Vaduganathan M. et al., 2017). По мере прогрессирования заболевания возрастает число неаритмогенных смертей и снижается эффективность ИКД (рис. 1.2).
Рис. 1.2. Соотношение причин смерти в зависимости от класса NYHA (MERIT-HF)
Соответственно точная оценка прогноза заболевания может помочь в выборе терапевтических программ и улучшить исходы. Особенно значим точный прогноз для использования дорогостоящих имплантируемых устройств.
Анализ данных рандомизированных контролируемых исследований показал, что эффективность ИКД оказалась почти на треть ниже прогнозируемой (Anderson K. et al., 2005). Адекватный эффект использования ИКД наблюдался только у 17–31% пациентов (Gracieux J. et al., 2014).
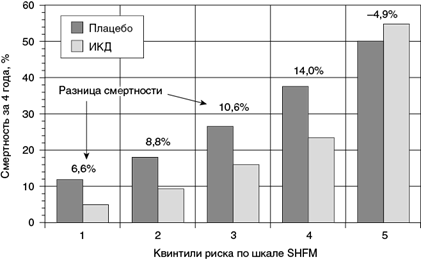
У пациентов с очень высоким риском смерти эффективность ИКД оказалась существенно ниже по сравнению с пациентами с более низким уровнем прогнозируемой смертности по шкале SHFM (рис. 1.3).
Рис. 1.3. Влияние имплантируемого кардиовертера-дефибриллятора (ИКД) на смертность в зависимости от риска по шкале SHFM (Levy W. et al., 2009)
Почти 20% сердечных смертей можно отнести на счет ИКД-резистентных желудочковых аритмий, включая нереципрокные желудочковые тахикардии и устойчивую к кардиоверсии фибрилляцию желудочков (Packer D. et al., 2009).
Нередко пациенты заблуждаются, будучи уверенными в абсолютно эффективности ИКД. Вместе с тем 5-летняя выживаемость была достигнута почти у 64% пациентов, соответствующих критериями исследования SCD-HeFT, получавших медикаментозное лечение, и у 71% с установленным ИКД (Bardy G. et al., 2005). Разряды, связанные с желудочковой тахиаритмией, в этом исследовании были зарегистрированы в течение 2 лет лишь у 21% пациентов с ИКД.
Применяемые в настоящее время упрощенные критерии отбора пациентов для установки ИКД на основе оценки ФВЛЖ и класса СН по NYHA достаточно грубы и неточны, они не учитывают многие важные факторы (например, возраст или функцию почек), которые включены в прогностические шкалы (Fauchier L. et al., 2015). Целесообразным представляется разработка критериев имплантации устройств на основе расчетной оценки риска ВСС.
Шкала MADIT-II. Группой исследователей под руководством I. Goldenberg была создана простая шкала для стратификации риска у пациентов — кандидатов на установку ИКД. Шкала разрабатывалась на основе данных исследования MADIT-II, включавшего пациентов, перенесших ИМ более 1 мес назад и имевших ФВЛЖ ≤30% (табл. 1.1).
Таблица 1.1. Шкала MADIT-II

При наличии 0, 1, 2 и ≥3 баллов смертность в группе пациентов с ИКД составляла 7, 9, 15 и 29% соответственно. Эффективность ИКД была значительно снижена в группах с очень низким (0 баллов) и высоким риском (≥3 баллов). В группе высокого риска в течение 2 лет почти 40% умерли не внезапно и только 13% внезапно. Продолжение наблюдения в течение 8 лет подтвердило отсутствие эффекта ИКД у пациентов группы очень высокого риска (Barsheshet A. et al., 2012). Аналогичные данные были получены у пациентов с имплантированными ресинхронизирующими устройствами с функцией дефибриллятора (Barra S. et al., 2016).
По-видимому, важнее для практической работы разработка шкал, рассчитанных на пациентов как с коронарной болезнью, так и без нее, поскольку, по данным метаанализа 11 рандомизированных исследований, применение ИКД приводило к одинаковому снижению смертности у пациентов обеих групп — в среднем на 24% (Shun-Shin M. et al., 2017).
Позднее на группе пациентов с ишемической и неишемической кардиомиопатией со сниженной ФВЛЖ была разработана модификация шкалы, в которой концентрация азота мочевины была заменена на рСКФ (Providência R. et al., 2015).
Другие шкалы. Учитывая значимый вклад ВСС в общую смертность, для определения показаний к применению ИКД при хронической СН можно использовать шкалы для прогноза смерти по любой причине. Например, у пациентов с ИКД и ресинхронизирующими устройствами с функцией дефибриллятора шкала MADIT-II хуже оценивала 5-летнюю смертность по сравнению со шкалой SHFM (Akoudad S. et al., 2017).
В то же время шкала SHFM лучше прогнозировала ВСС по сравнению с классификацией NYHA. Например, в исследовании MERIT-HF доля внезапных смертей у пациентов с СН II, III и IV класса по NYHA составила 64, 57 и 33% при годовом абсолютном риске в 4, 6 и 6% соответственно. У пациентов с суммой баллов по шкале SHFM от 0 до 4 доля ВСС была 79, 57, 43, 40 и 28% соответственно баллу, а абсолютный риск — 4, 6, 10, 23 и 25% соответственно (Mozaffarian D. et al., 2007). Наибольшую пользу применения ИКД следует ожидать у пациентов с низкими значениями по шкале SHFM.
Предложена модель SPRM для оценки пропорционального риска ВСС. В модели учтена связь молодого возраста, мужского пола, более высокого индекса массы тела с увеличением риска ВСС. В то же время наличие СД, гипотензии или гипертензии, высокого уровня креатинина и гипонатриемии снижает долю ВСС в общей смертности (Levy W. et al., 2017; Shadman R. et al., 2015). Предлагается выбирать подгруппу пациентов с наибольшей пользой от ИКД на основании низких значений шкалы общей смертности SHFM и высоких значений шкалы SPRM (Bilchick K. et al., 2017; Schrage B. et al., 2022). В японском исследовании проверка шкалы SPRM показала лучшую С-статистику по сравнению с традиционными критериями отбора для ИКД (II–III функциональный класс по NYHA и ФВЛЖ ≤35%) — 0,65 против 0,53 (Fukuoka R. et al., 2020).
Простая шкала PACE для оценки риска смерти у пациентов, которым планируется установка ИКД, включает возраст, наличие заболеваний периферических артерий, ФВЛЖ и уровень креатинина (Kramer D. et al., 2012). У пациентов со значением по шкале 3 балла и более годовая смертность, несмотря на применение ИКД, превышает 15% и эффективность аппаратного лечения низка. Шкала имеет скромную С-статистику — 0,69 и требует независимой валидизации.
Важным шагом в оптимизации прогноза стала шкала MADIT-ICD, созданная на основе анализа большой базы пациентов исследований MADIT (MADIT-II, MADIT-Risk, MADIT-CRT, MADIT-RIT), которая позволяет предсказывать вероятность пользы профилактической имплантации ИКД, основанную на сопоставлении риска желудочковой тахикардии/фибрилляции желудочков и риска неаритмической смерти (Younis A. et al., 2021).
С учетом аритмогенной природы ВСС и соответственно возможности иных профилактических подходов разрабатываются шкалы для пациентов с коронарной болезнью. В исследовании C. Borleffs и соавт. (2010) было показано, что факторы риска ВСС у пациентов с ишемической и неишемической кардиомиопатиями отличаются, поэтому исследователями было создано две простых шкалы для оценки смертности и показаний для применения ИКД.
Шкала FADES включает возраст, класс СН по NYHA, ФВЛЖ, СД, курение и позволяет оценить риск ВСС у пациентов с коронарной болезнью (van Rees J. et al., 2012).
Применение шкал. Учитывая невысокую частоту адекватной работы ИКД, представляется целесообразным у пациентов без абсолютных показаний к имплантации оценивать риск внезапной и общей (несердечной) смертности с помощью шкал (рис. 1.4).
Рис. 1.4. Алгоритм отбора пациентов с сердечной недостаточностью для установки имплантированного кардиовертера-дефибриллятора

Важно учитывать, что пациенты с наиболее высокой предсказанной смертностью и традиционными показаниями для установки ИКД не получили пользы от имплантируемых устройств (Goldenberg I. et al., 2008; Levy W. et al., 2009; Scott P. et al., 2012).
Определен порог ежегодной общей смертности в 20–25%, выше которого эффективность лечения с помощью дефибрилляторов приближается к нулю, включая пациентов с СН II–III класса по NYHA. По-видимому, у пациентов группы высокого риска возрастает доля невнезапных смертей, при которых снижается польза ИКД.
Гипертрофическая кардиомиопатия — самое частое врожденное заболевание сердечной мышцы и ведущая причина ВСС людей молодого возраста (Elliott P. et al., 2016). Предложенные ранее алгоритмы отбора пациентов часто приводили к неоправданной установке ИКД, а частота неблагоприятных событий, связанных с выбором данного вида лечения (неадекватные разряды, осложнения имплантации), достигала 30% (O’Mahony C. et al., 2012, 2013).
Шкала HCM Risk-SCD. С целью оценки риска ВСС и определения показаний к установке ИКД в европейских рекомендациях советуют использовать шкалу HCM Risk-SCD, представленную в табл. 1.2 (O’Mahony C. et al., 2014).
Таблица 1.2. Шкала HCM Risk-SCD

Риск ВСС и максимальная толщина стенки ЛЖ связаны нелинейно, поэтому у пациентов с толщиной его стенки ≥35 мм модель применяют осторожно. Модель не применяется у пациентов моложе 16 лет, у элитных спортсменов, при метаболических расстройствах.
С-статистика шкалы HCM Risk-SCD в валидизирующих исследованиях существенно выше ранее используемых алгоритмов (Vriesendorp P. et al., 2015; O’Mahony C. et al., 2018). Вместе с тем разрешающая способность шкалы не столь высока и нередки случаи недооценки риска ВСС (Maron B. et al., 2015; Leong K. et al., 2016).
Алгоритм 2020 ACC/AHA. Уточненные критерии ВСС, предложенные в последних рекомендациях ACC/AHA, включают:
• семейный анамнез ВСС, определенно или вероятно вызванный гипертрофической кардиомиопатией, у ближайших родственников или других близких родственников 50 лет и моложе;
• гипертрофию ЛЖ с толщиной стенки ≥30 мм в любом сегменте;
• необъяснимый обморок, предположительно аритмогенный (нехарактерный для вазовагальной природы или не связанный с обструкцией выводного тракта левого желудочка);
• апикальную аневризму ЛЖ, независимо от размера;
• дисфункцию левого желудочка с ФВЛЖ <50%.
Использование уточненных критериев (наличие хотя бы одного) показало лучшую точность прогноза по сравнению со шкалой HCM Risk-SCD в оригинальной работе (0,81 vs 0,74) и проведенном позднее китайском исследовании (рис. 1.5; Dong Y. et al., 2021).
Рис. 1.5. Выживаемость пациентов с гипертрофической кардиомиопатией при использовании разных моделей оценки риска (Maron M. et al., 2019)

В ряде клинических ситуаций для принятия решения по имплантации ИКД можно использовать менее надежные предикторы: неустойчивую желудочковую тахикардию (≥3 эпизодов с ≥3 комплексов или ≥1 эпизода с ≥10 комплексов с частотой ≥130 в минуту) и диффузный или количественно ≥15% фиброз ЛЖ при МРТ с поздним гадолиниевым усилением.
Применение шкал. Шкала HCM Risk-SCD использована в последних европейских рекомендациях для выбора ИКД (рис. 1.6). Имплантация электрического устройства показана при высоком риске ВСС (≥6% в течение 5 лет).
Рис. 1.6. Алгоритм выбора имплантируемого кардиовертера-дефибриллятора ESC 2014. ЖТ — желудочковая тахикардия; ФЖ — фибрилляция желудочков

Вместе с тем европейский алгоритм оценки риска ВСС нельзя признать оптимальным, и небольшое число пациентов с отсутствием факторов риска и выраженных симптомов могут умереть с частотой 0,6% в год (Spirito P. et al., 2014).
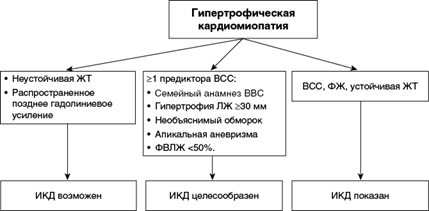
Учитывая лучшие показатели прогноза, предпочтительнее использовать американский алгоритм отбора пациентов с повышенным риском ВСС для ИКД (рис. 1.7).
Рис. 1.7. Алгоритм выбора имплантируемого кардиовертера-дефибриллятора 2020 ACC/AHA. ЛЖ — левый желудочек, ЖТ — желудочковая тахикардия; ФЖ — фибрилляция желудочков
В практике кардиолога чаще встречается вторичный синдром удлиненного интервала QT, обусловленный заболеваниями сердца, действием лекарственных препаратов, метаболическими расстройствами, и существенно реже — каналопатия, связанная с генетическими аномалиями.
Повышенный риск двунаправленной веретенообразной желудочковой тахикардии и фибрилляции желудочков обусловливает важность оценки риска ВСС и адекватной ее профилактики.
У пациентов с генетическими аномалиями, ассоциирующимися с синдромом удлиненного интервала QT, в 25 и 50% случаев регистрируют нормальный или пограничный интервал QTc, что связывают с вариабельной пенетрантностью, эффектом модифицирующих генов и индивидуальной изменчивостью интервала QT на ЭКГ (Sy R. et al., 2011). Соответственно изолированное определение интервала QTc на ЭКГ не позволяет диагностировать синдром удлиненного интервала QT.
Полагают, что мутация гена SCN5A (α-субъединица натриевого канала типа 5) связана с редким третьим вариантом синдрома (LQT3) и высоким риском ВСС. Однако наблюдение за пациентами с ИКД показало, что при LQT3 очень редко наблюдаются адекватные разряды, а большинству пациентов можно помочь назначением β-блокаторов, блокаторов натриевых каналов и симпатической денервацией (Horner J. et al., 2010; Etheridge S. et al., 2007).
Шкала M-FACT. Для оценки целесообразности и эффективности имплантации кардиовертера-дефибриллятора предложена шкала M-FACT, которая включает продолжительность интервала QTc на ЭКГ, остановку сердца в анамнезе, наличие событий (текущий обморок, остановка сердца, требующая проведения реанимационных мероприятий) на фоне лечения (β-блокаторы, антиаритмические препараты 1-го класса, симпатическая денервация) и возраст пациента при установке ИКД (табл. 1.3) (Schwartz P. et al., 2010). У пациентов с отсутствием всех признаков в течение 7 лет не наблюдалось адекватных разрядов ИКД, в то время как у 70% пациентов с наличием всех признаков они отмечались.
Таблица 1.3. Шкала M-FACT

Другие шкалы. Шкала RISQ-PATH включает 17 предикторов, в том числе наличие препарата в одном из списков лекарственных препаратов, удлиняющих интервал QT на ЭКГ, на сайте CredibleMeds (Vandael E. et al., 2017). Увеличением интервала QT на ЭКГ считали его продолжительность ≥450 мс у мужчин и ≥470 мс у женщин, а также прирост на ≥30 мс. Высокий риск развития синдрома удлиненного интервала QT при назначении лекарственного препарата определялся у пациентов со значением по шкале в 10 баллов и более. В случае низкого риска необходимость мониторинга ЭКГ отпадает.
Включение шкалы оценки риска удлинения интервала QTc в компьютерную систему поддержки клинических решений уменьшила число назначений потенциально опасных лекарственных препаратов и случаи удлинения интервала QTc с потенциальным риском двунаправленно-веретенообразной желудочковой тахикардии (Tisdale J. et al., 2014).
Применение шкал. При наличии удлиненного интервала QTс, который обычно выявляется при рутинной регистрации ЭКГ, целесообразно оценить возможность наличия вторичных причин (медикаментозное воздействие, заболевание сердца, электролитные нарушения) и постараться их устранить.
Если удлинение интервала QT на ЭКГ не связано с явной причиной, целесообразно уточнить критерии синдрома, включая генетические тесты, наличие обмороков, сердцебиений, собрать семейный анамнез внезапных смертей, провести оценку по шкале M-FACT.
В случае остановки сердца или рецидивирующих обмороков при высоком риске ВСС по шкале M-FACT наряду с β-блокаторами показана установка ИКД.
Наличие изолированного короткого интервала QT не всегда ассоциируется с повышенным аритмогенным риском и не должно быть эквивалентом синдрома короткого интервала QT (рис. 2.28). Соответственно диагноз должен учитывать и другие признаки синдрома.
Согласно современным рекомендациям, диагноз синдрома короткого интервала QT следует устанавливать при продолжительности интервала QTc ≤330 мс или при продолжительности интервала QTc на ЭКГ <360 мс в сочетании с аритмогенной мутацией, семейным анамнезом синдрома или внезапной смерти у пациентов в возрасте до 40 лет, эпизодами желудочковой тахиаритмии при отсутствии заболевания сердца (HRS/Европейская ассоциация сердечного ритма/APHRS).
Шкала Gollob. Для оценки вероятности синдрома короткого интервала QT разработана шкала Gollob (табл. 1.4). Диагностика каналопатии требует предварительного исключения вторичных причин (гиперкалиемии, гиперкальциемии, ацидоза, гипертермии, эффекта лекарственных препаратов, например дигоксина).
Таблица 1.4. Шкала Gollob

Позднее в исследовании с участием детей шкала для диагностики необъяснимых обмороков, ФП и ВСС была модифицирована — из нее были исключены клинические критерии (Villafañe J. et al., 2013). У детей без каких-либо клинических симптомов с суммой баллов по модифицированной шкале Gollob ≤3 сердечно-сосудистых события в течение 6 лет наблюдения отсутствовали.
В то же время в исследовании А. Mazzanti и соавт. (2014), включавшем данные 73 пациентов с синдромом короткого интервала QT, у 5 из 8 больных, перенесших остановку сердца, оригинальная и модифицированная шкалы показали невысокий риск. В современных рекомендациях шкала Gollob не используется в качестве критерия для диагностики синдрома короткого интервала QT (HRS/Европейская ассоциация сердечного ритма/APHRS).
Применение шкал. Установка ИКД показана пациентам с синдромом короткого QT, выжившим после остановки сердца, и/или с документированной спонтанной устойчивой желудочковой тахикардией.
Шкала Gollob не включена в клинические рекомендации для диагностики синдрома короткого интервала QT, поэтому ее применять необязательно, однако она может быть дополнительным инструментом принятия решений.
Поскольку первый эпизод желудочковой тахиаритмии бывает фатальным, прогноз высокой вероятности синдрома может оказаться полезным для решения вопроса об имплантации кардиовертера-дефибриллятора и снизить частоту неоправданного лечения.
С учетом повышенного риска осложнений и отсутствия адекватных разрядов у ряда пациентов важной задачей является разработка эффективной шкалы риска ВСС при синдроме короткого интервала QT.
Примерно в 20% случаев ВСС с отсутствием структурных изменений сердца выявляют синдром Бругада, который характеризуется косонисходящей элевацией сегмента ST в правых грудных отведениях ЭКГ V1–2, регистрируемых при расположении электродов во втором, третьем или четвертом межреберьях и может привести к обморокам и ВСС, обусловленным желудочковой тахикардией или фибрилляцией желудочков. Сложности диагностики связаны с отсутствием у большей части пациентов с синдромом Бругада спонтанных ЭКГ-признаков 1-го типа. При этом синдроме часто выявляют генетические аномалии, включая мутацию гена натриевых каналов SCN5A.
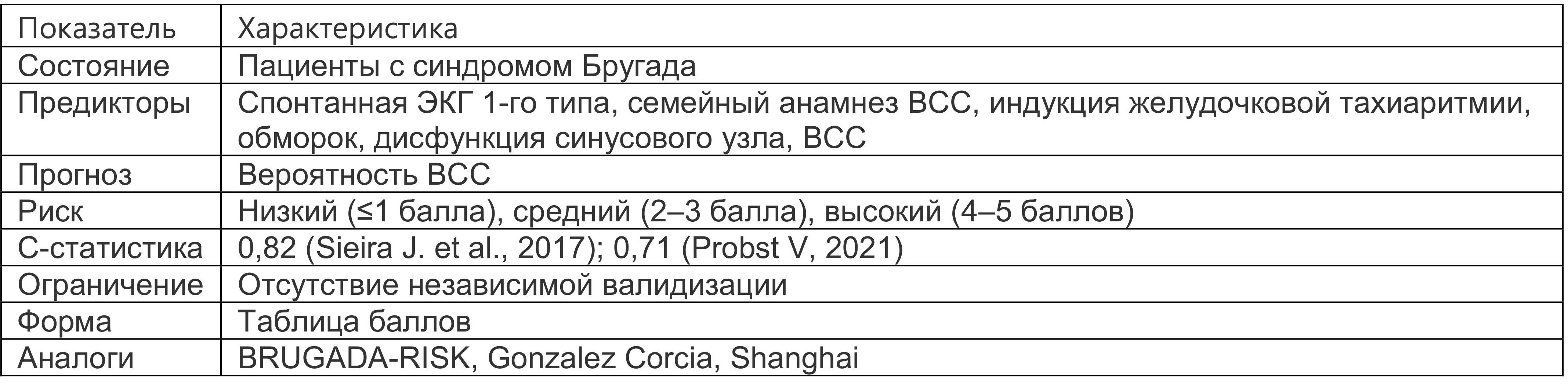
Шкала Sieira для оценки риска ВСС у пациентов с синдромом Бругада (табл. 1.5) (Sieira J. et al., 2017). В ряде исследований шкала показала приемлемые показатели оценки риска, однако ретроспективное исследование 2 английских центров выявило чувствительность 22% и специфичность 58%, C-статистику 0,58, при этом у 75% пациентов, выживших после остановки сердца, по данным шкалы до события не требовалась имплантация дефибриллятора (Chow J. et al., 2021).
Таблица 1.5. Шкала Sieira
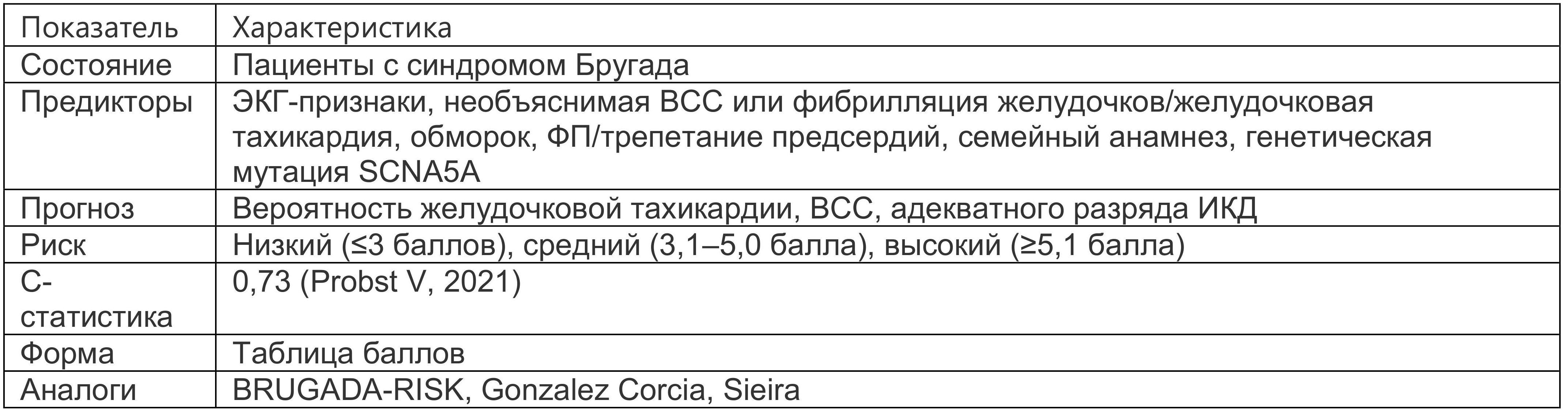
Шкала Shanghai включает более детальную градацию факторов риска, включая ВСС, ЭКГ-признаки, обмороки, семейный анамнез, предсердные аритмии, генетическую мутацию (табл. 1.6) (Kawada S, et al., 2018). Потенциально летальным событием считали внезапную смерть, устойчивую желудочковую тахикардию, фибрилляцию желудочков, адекватный разряд кардиовертера-дефибриллятора. Шкала также показала способность выделять группу риска у пациентов с ранней реполяризацией желудочков, которую ряд специалистов объединяют с синдромом Бругада в единый синдром J-волны (Yonezu K. et al., 2021).
Таблица 1.6. Шкала Shanghai
Применение шкал. Согласно современным рекомендациям, установка ИКД показана пациентам с синдромом Бругада, выжившим после остановки сердца и/или имеющим документированную спонтанную устойчивую желудочковую тахикардию. Для остальных может быть предпочтительнее прием хинидина.
При использовании прогностических шкал по аналогии с рекомендациями для пациентов с гипертрофической кардиомиопатией имплантация дефибриллятора может быть полезна у пациентов с 5-летним риском смерти выше 6%, что соответствует сумме ≥2 баллов по шкале Sieira или ≥5,5 балла по шкале Shanghai.
При выборе ИКД следует учитывать возможность осложнений терапии (зафиксированы у 29% пациентов), включая неоднократные неадекватные разряды (в 9% случаев) (Hernandez-Ojeda J. et al., 2017).
Международная исследовательская группа на данных многоцентрового 6-летнего наблюдения за 864 пациентами с аритмогенной кардиомиопатией правого желудочка разработала модель прогноза жизнеугрожающих желудочковых аритмий, включающую всего 4 предиктора (молодой возраст, пол, число желудочковых экстрасистолий за сутки, число отведений с инверсией зубца Т), и С-статистикой 0,74 (табл. 1.7) (Cadrin-Tourigny J. et al., 2021). В новой модели по сравнению с предыдущей сокращено число предикторов и прогнозируется более значимые жизнеопасные аритмии [ВСС, прерванная ВСС, фибрилляция желудочков, быстрая желудочковая тахикардия (>250 в минуту, устойчивая или прекращенная ИКД]), а не только устойчивая желудочковая тахикардия (Cadrin-Tourigny J. et al., 2019).
Таблица 1.7. Шкала ARVC

Другие шкалы. В рекомендациях международной экспертной группы ITFC предложен алгоритм выделения 4 групп риска (I, IIa–b, III) на основании жизнеопасных желудочковых аритмий, а также больших и малых критериев риска ВСС (Corrado D. et al., 2015). Проверка показала, что алгоритм достаточно хорошо дифференцирует группы риска показаний к ИКД по устойчивой желудочковой тахикардии/фибрилляции желудочков, однако частота последних недооценивается. Более того, если оценивать только фибрилляцию и трепетание желудочков, то невозможно различить I и IIа классы (Orgeron G. et al., 2018). Кроме того, алгоритм не дифференцирует классы I и IIa при оценке показаний к ИКД с целью первичной профилактики. Недавно была разработана шкала ARVCHF, которая оценивает прогноз прогрессирования СН, включая трансплантацию сердца и смерть, обусловленную СН (Chen S. et al., 2022).
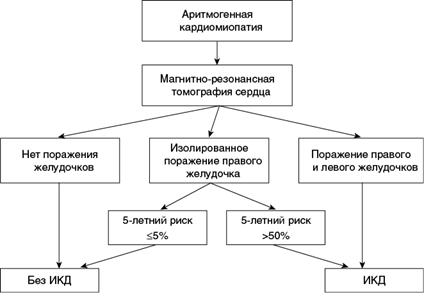
Применение шкал. У пациентов с высоким риском ВСС может быть оправдана имплантация ИКД. Предложен алгоритм использования магнитно-резонансной томографии (МРТ) для оценки поражения правого и левого желудочков вместе со шкалой ARVC для отбора пациентов на имплантацию кардиовертера-дефибриллятора (рис. 1.8).
Рис. 1.8. Общий алгоритм отбора пациентов для установки ИКД на основе оценки поражения желудочков и риска жизнеопасных желудочковых аритмий (Aquaro G. et al., 2020 с уточнением)
20.04.2023 | 15:37:41