Теории старения. Механизмы старения.
Раздел: Статьи
/
Общая врачебная практика.
/
Геронтология и гериатрия.
/
Теории старения. Механизмы старения.
Содержание
- Введение
- Митохондриальная свободнорадикальная теория старения
- Кризис митохондриальной свободнорадикальной теории старения
- Антиоксиданты не влияют на продолжительность жизни
- Пергидроксильный радикал как основная причина системного старения
- Изопростановое перекисное окисление липидов (ИППОЛ) митохондриальных мембран
- Изопростановое перекисное окисление липидов как основной механизм старения
- Важность окисления жирных кислот для повышенной продукции активных форм кислорода
- Новая парадигма механизмов старения
- Половая дифференциация в скоростях старения и продолжительности жизни
- Половые различия в использовании жиров в энергетическом метаболизме
- Половые различия в использовании энергетических субстратов при физических нагрузках
- Метаболический синдром как пострепродуктивная стадия онтогенеза
- Происхождение метаболического синдрома
- Заключение
Введение
Каждый человек хочет жить долго и не болеть. Как шутили в СССР по поводу пропаганды против пьянства и курения: «Кто не курит и не пьет, тот здоровеньким помрет». Однако, как мы увидим, отказаться от вредных привычек еще недостаточно для долголетия. Для этого нужна доля везения — «хорошие» гены от предков, а также некоторые важные условия, о которых пойдет речь далее.
Процесс поэтапных трансформаций организма от младенчества до старости, когда индивид переходит из младенчества в детство и юность, а затем в зрелость, называется постэмбриональным онтогенезом (далее — онтогенез). Каждый этап онтогенеза управляется отдельной группой генов и соответствующими гормонами. При переходе в новую стадию «старые», т.е. выполнившие свою роль гены, теряются, и начинают работать следующие. Так происходит глобальная потеря гетерохроматина хромосом человека в процессе онтогенеза.
Как мы увидим, с позиций онтогенеза механизмы старения и развития метаболического синдрома становятся намного более понятными и близкими к действительности.
Проблемы старения и продолжительности жизни не являются только медицинскими. Это фундаментальными проблемы биологии, связанной с эволюцией, онтогенезом, генетикой, эпигенетикой и взаимоотношениями с окружающей средой, которая у человека включает в себя не только климато-географические, но и социально-культурные условия. По этим причинам одни ученые изучали старение и продолжительность жизни на уровне простых организмов, таких как дрожжи и черви, другие — на более сложных лабораторных животных, в основном на мышах и крысах и даже птицах и крокодилах. В этом отношении люди изучены намного меньше, чем мыши. Однако время идет, и в разных отраслях науки постепенно накапливается новая информация, появляются новые открытия и гипотезы. Это приводит к объединению и осмыслению результатов нескольких наук, происходит быстрая смена парадигм, а старые проблемы становятся более понятными. Подобный скачок в смене основных гипотез и представлений о механизмах старения происходит в настоящее время. Рассмотрим этот процесс на примере свободнорадикальной теории старения организма человека и животных, являющейся ведущей теорией в науке о старении в течение примерно 60 лет.
Митохондриальная свободнорадикальная теория старения
Предположения об участии свободных радикалов кислорода в старении организма были сделаны в середине ХХ в. Harman (1956). Вскоре свободнорадикальная теория старения трансформировалась в митохондриальную свободнорадикальную теорию старения, поскольку было обнаружено, что основными источниками радикалов кислорода являются митохондрии (Harman, 1972, 1981, 2006; Murphy, 2009). Свободные радикалы, которые образуются в организме, были обозначены как АФК. В англоязычной литературе они называются reactive oxygen species.
Чтобы понять логику начальных исследований процесса старения, полезно оглянуться на интеллектуальные и научные идеи, существовавшие 40–50 лет назад. После фундаментального открытия, что митохондрии являются основным источником АФК в большинстве тканей (Boveris, Chance, 1973; Chance et al., 1979) среди ученых появилась надежда, что найден универсальный механизм развития старости и многих болезней.
В течение долгого времени биологические эффекты АФК назывались окислительным стрессом, а старение было только одним из многих последствий действий АФК на организм. Исследователи не понимали, что различные органы и ткани по-разному образуют АФК и реагируют на них, поэтому стареют с разной скоростью. Кроме того, условия внешней среды, индустриальные загрязнения также вносят свой вклад в процесс старения и появление патологий.
Важно отметить, что достаточно долго не были известны явные маркеры системного старения, за исключением мутаций митохондриальной ДНК. Существует четкий параллелизм между продукцией АФК и мутациями мтДНК (Beckman, Ames, 1998; Wallace, 2005b). До недавнего времени этот параллелизм объясняли тем, что десятки «голых» молекул мтДНК располагаются в матриксе митохондрий, поэтому легко становятся «жертвой» свободных радикалов. Накопление в клетках поврежденных АФК молекул мтДНК постепенно инактивирует информацию ДНК, необходимую для «ремонта» поврежденных органов. Таким образом накопленные мутации мтДНК запускают «часы старения» (Wallace, 2005b).
Понятно, что в этих условиях мутации мтДНК стали главным фактором в объяснении старения и связанных с ним болезней, а также чуть ли не всех основных заболеваний человека (Wallace, 2005b; Sequeira et al., 2012; Tranah et al., 2018; Volobuyeva et al., 2019). Лишь сравнительно недавно было показано, что мтДНК образует защищенный белковым «щитом» нуклеоид, и нет доказательств того, что АФК непосредственно повреждают мтДНК (Pinto, Moraes, 2015; DeBalsi et al., 2017; Szczepanowska, Trifunovic, 2017; Chocron et al., 2019).
Образование АФК происходит не только в митохондриях паренхимных органов и тканей. Они образуются также митохондриями клеток крови (за исключением эритроцитов), которые, очевидно, имеют несколько другие функции, отличные от паренхимных тканей. «Дыхательная вспышка» (respiratory burst) фагоцитарных клеток, когда они контактируют с бактериями или иммунными комплексами, отражает всплеск образования супероксидного радикала (СОР) (O2∙) и перекиси водорода. К фагоцитарным клеткам относятся нейтрофилы, моноциты, макрофаги и эозинофилы, образующие большие количества O2∙ (Halliwell, Gutteridge, 1984).
В некоторых клетках, особенно в гепатоцитах, основным источником АФК могут быть вовсе не митохондрии (Brown, Borutaite, 2012). В печени O2∙ и H2O2 образуются в ходе метаболизма ксенобиотиков микросомальными P-450-монооксигеназами (Veith, Moorthy, 2017) и в ходе катаболизма пуриновых нуклеотидов и нуклеозидов ксантиноксидазами (Battelli et al., 2016).
Почки также стареют сравнительно медленно и редко создают проблемы для пожилых людей, поскольку они активно работают, поэтому производят мало АФК. Напомним, что митохондрии производят АФК в состоянии покоя или при недостаточно большой функциональной загруженности органа. В активно работающих органах продукция АФК минимальна (Brand, 2016).
Самые высокие скорости АФК и старения наблюдаются в тех органах, которые имеют большой диапазон функциональной нагрузки, таких как скелетные мышцы, сердце и мозг. У этих органов высокая скорость потребления кислорода и продукции АТФ, чтобы обеспечить энергией свои потребности при больших нагрузках. Увеличение скорости образования АФК происходит при низких функциональных нагрузках и во время отдыха (Brand, 2016; Panov, 2019, 2020).
Так что старение не является процессом, равномерно распределенным по организму. Одни органы стареют быстрее, особенно если они не функционируют активно, другие почти совсем не стареют. К этому надо добавить, что и механизмы, которые вызывают старение, могут быть разными или смешанными в разных органах и тканях.
Кризис митохондриальной свободнорадикальной теории старения
Из описания различных форм АФК следует, что все они имеют потенциальную возможность повреждать клеточные и митохондриальные функции, хотя и через разные механизмы. Некоторые биологические молекулы и радикалы повреждают преимущественно определенные органы и ткани. Например, синглетный кислород (он не является радикалом) преимущественно повреждает кожные покровы и глаза; озон и двуокись азота — эпителий легких; окись азота и пероксинитрит — сосудистый эпителий и нервные клетки. Однако ни один из общеизвестных радикалов, включая супероксид, не имеют отношения к неизбежному процессу старения и мутациям мтДНК (Panov, Dikalov, 2018).
В ходе десятилетий исследований огромное количество накопленных фактов постепенно выявили серьезные несоответствия между фактами и положениями митохондриальной теории старения, что поставило под сомнение правильность теории в ее существующем виде.
Учитывая, что противоречия в значительной мере относились к различным видам животного мира, мы рассмотрим только те несоответствия, которые являются системными и непосредственно относятся к человеку и млекопитающим, поскольку у них механизмы старения и обмен веществ во многом схожи. К тому же животные часто используются для моделирования механизмов старения и патологических состояний (Paradies et al., 2009, 2011; Shabalina et al., 2017; Stefanova et al., 2019). Мы обсудим несколько важных фактов, которые подрывают митохондриальную гипотезу старения.
Митохондриальная дезоксирибонуклеиновая кислота защищена от прямого влияния радикалов кислорода
Уже сравнительно давно (но, как это часто случается, важные факты долго не замечаются многими исследователями) было установлено, что ни одна из известных АФК или биологических активных молекул не способна непосредственно вызывать мутации мтДНК.
Для многих исследователей мутации мтДНК были и остаются главными маркерами процесса старения и окислительного стресса и основным механизмом патогенеза многих заболеваний старческого возраста (Pinto, Moraes, 2015; DeBalsi et al., 2017; Szczepanowska, Trifunovic, 2017; Chocron et al., 2019). С самого начала возникновения митохондриальной свободнорадикальной теории старения мутации мтДНК были единственным надежным доказательством окислительного повреждения митохондрий. Собственно эта теория возникла на том основании, что продукция АФК всегда сопровождалась параллельным накоплением мутаций мтДНК (Beckman, Ames, 1998; Wallace, 2005b). Сравнительно недавно, однако, был сделан вывод, что не существует надежных доказательств того, что АФК непосредственно вызывают мутации мтДНК (Sanz, Stefanatos, 2008; Szczepanowska, Trifunovic, 2017). Имеется 2 главные причины для такого вывода. Во-первых, обычно рассматриваемые АФК недостаточно химически активны, чтобы вызвать мутации или не способны достичь мтДНК (Panov, Dikalov, 2018). Во-вторых, мтДНК заключена в белковую структуру — нуклеоид, что предотвращает прямой контакт радикалов с мтДНК (Szczepanowska, Trifunovic, 2017).
Антиоксиданты не влияют на продолжительность жизни
Одно из самых важных предположений митохондриальной теории старения было предположение, что антиоксиданты должны увеличивать продолжительность жизни. Однако многочисленные эксперименты в разных вариантах показали, что низкомолекулярные антиоксиданты не влияют на продолжительность жизни (Barja, 2104; Sanz et al., 2006; Abner et al., 2011).
Это было большим разочарованием для многих ученых и одним из главных аргументов против митохондриальной теории старения. Barja (2014) предположил, что отсутствие эффектов антиоксидантов на продолжительность жизни можно, по-видимому, объяснить пространственным разделением эффектов радикалов и антиоксидантов. АФК, которые вызывают старение, вероятно, действуют в липидной фазе мембран митохондрий, в то время как антиоксиданты оказывают свои эффекты по большей части в водной фазе клеток. Barja так суммировал многочисленные исследования по продолжительности жизни на разных видах организмов: «Только два параметра без исключения коррелируют правильно с продолжительностью жизни у разных видов: скорость образования активных форм кислорода митохондриями и степень ненасыщенности липидов мембран» (2014). Как мы увидим, это было очень правильное предположение.
Скорость образования супероксидного радикала (O2∙) контролирует продолжительность жизни независимо от активности супероксиддисмутаз (СОД)
Другим ожидаемым важным следствием митохондриальной теории старения было то, что активность удаления супероксида должна влиять на продолжительность жизни. Muller (2000) подчеркивал, что вариации активности СОД1 и СОД2 у млекопитающих не коррелируют с максимальной продолжительностью жизни (МПЖ) и активность ферментов антиоксидантной защиты отрицательно коррелирует с МПЖ. Однако есть сильная отрицательная корреляция между МПЖ и скоростями образования O2∙ и H2O2, выделенными митохондриями из тканей животных различных видов.
Таким образом, максимальная продолжительность жизни зависит не от количества АФК, а от скорости их образования (Muller, 2000). Для объяснения этого вывода Muller предположил, что значительная фракция (между 10 и 50%) СОР образуется не в водной среде, как O2∙, а в липидной фазе ВММ в виде HO2•, т.е. он предположил, что не O2∙ в водной фазе митохондрий, а его протонированная форма — гидропероксидный (пергидроксильный) радикал (HO2•) в липидной фазе мебран — вызывает старение (Muller, 2000). К сожалению, его предположение оставалось незамеченным в течение двух десятилетий, как и подобные попытки других ученых (Bielski et al., 1983; De Grey, 2002).
Пергидроксильный радикал как основная причина системного старения
В этом разделе мы кратко суммируем механизмы образования HO2• и активации изопростанового перекисного окисления ПНЖК и КЛ. Подробно эти механизмы рассмотрены в недавних публикациях (Panov, 2017, 2018, 2020; Panov, Dikalov, 2018, 2020).
Механизм образования •HО2 объясняет, почему процесс старения зависит только от скорости образования СОР, а не от активности СОД. Пергидроксильный радикал намного более сильный оксидант, чем супероксид, и имеет специфическое свойство абстрагировать Н-атомы α-токоферола, нейтрализуя тем самым этот антиоксидант, и ПНЖК — АК (C20:4 n6) и ДГК (C22:6 n3) (Gebicki, Bielski, 1981).
По не совсем понятным причинам пергидроксильный радикал до недавнего времени практически игнорировали при обсуждении окислительного стресса. Mitchell (2000) предположил, что •HО2 оказывает свое повреждающее действие через образование пероксинитрит-радикала в мембране. Эту ситуацию обсуждали Gebicki и Bielski (1981). Авторы указывали, что хотя оба радикала •NO and •HО2 являются гидрофобными, они пространственно разделены, поскольку в норме •NO присутствует в эндотелии сосудов, и таким образом образованный митохондриями пергидроксильный радикал имеет небольшую вероятность встретиться с радикалом окиси азота. Даже если это происходит, негативно заряженный ONOO- едва ли может служить системным фактором старения, поскольку он немедленно выбрасывается из липидной фазы мембран (Gebicki, Bielski, 1981). Однако в самом эндотелии сосудов, поскольку они содержат митохондрии, этот механизм вероятно может иметь место.
Bielski с соавторами (1983) изучали реакции •HО2 с линолевой (C18:2), линоленовой (C18:3) и арахидоновой (C20:4) кислотами в водно-спиртовых растворах (Bielski, 1978). Полученные кинетические параметры реакций указывают на то, что •HО2 реагирует с водородом двойных связей ПНЖК, и чем больше двойных связей в молекуле ПНЖК, тем более активной была реакция (Bielski, 1978). Поскольку реакции проводились в водно-спиртовых растворах, образовавшаяся перекись водорода гидролизовалась гетеролитически (2H2O2 → H2O + O2), и конечными продуктами окисления ЖК с •HО2 были стабильные гидропероксиды без больших вариаций в своей структуре (Bielski, 1978).
Изопростановое перекисное окисление липидов (ИППОЛ) митохондриальных мембран
Когда внутри липидной фазы мембраны митохондрий молекулы •HО2 реагируют с ПНЖК, которые находятся в составе ФЛ, продуктами реакции является рацемическая смесь очень большого количества различных стерео- и позиционных продуктов (Morrow et al., 1990). Многие из этих продуктов являются аналогами ПГ, в норме получающихся в ферментативных реакциях из свободных ЖК. По этой причине они были названы изопростанами, а тип аутоокисления ПНЖК — изопростановым путем перекисного окисления липидов (Morrow et al., 1990, 1992; Roberts et al., 1998). Изопростаны обладают биологической активностью, сходной с нормальными ПГ, поэтому могут вызывать ненормальные воспалительные процессы (Morrow et al., 1990; Montine, Morrow, 2005), например артриты в пожилом возрасте. Более того, многие продукты ИППОЛ очень токсичны — например, γ-кетоальдегиды. Они образуют аддукты с первичными аминами лизинсодержащих белков и ФЭ. Самыми активными являются ИзоЛГ, образующиеся при аутоокислении АК, которые обнаруживаются только в виде аддуктов с белками и ФЭ (Montine, Morrow, 2005).
Помимо АК (20:4 n6), наиболее часто продукты ИППОЛ обнаруживаются при аутоокислении эйкозапентоеноевой кислоты (20:5 n3) и ДГК (22:6 n3) (Milne et al., 2008). Поскольку ДГК в большом количестве присутствует в нейронах мозга, продукты ИППОЛ этой кислоты были названы нейропростанами и нейрокеталями. Из АК, которая имеет 4 ненасыщенных связи, рацемическая смесь продуктов ИППОЛ содержит около 800 различных молекул, а у ДГК, имеющей 6 двойных связей, количество продуктов приближается к 1,5 тыс. (Morrow et al., 1990, 1992; Roberts et al., 1998).
Ключевой момент реакции •HО2 с ПНЖК состоит в том, что после абстракции первого Н-атома от одной из двойных связей ПНЖК образуется H2O2, которая в гидрофобном окружении подвергается гомолитическому распаду с образованием, опять же в гидрофобной среде, 2 молекул гидроксильного радикала: H2O2 → 2•OH, которые мгновенно реагируют с 2 другими водородами ПНЖК с образованием 2 молекул воды. Остаток молекулы ПНЖК, имея совершенно расстроенные двойные связи, становится чрезвычайно неустойчивым и быстро, но совершенно случайным образом присоединяет 2 молекулы О2, а затем подвергается внутримолекулярной перестройке с образованием также случайным образом одного из сотен возможных продуктов. Поскольку в ЖК все атомы углерода оптически активны, это объясняет большое количество возможных стерео- и позиционных изомеров.
Изопростановое перекисное окисление липидов как основной механизм старения
В течение почти 20 лет исследователи из университета Вандербильта (Нэшвилл, США) оставались единственными, кто системно изучал ИППОЛ in vivo. Ими было доказано, что изопростаны и их аддукты являются наиболее ранними и надежными маркерами окислительного стресса и что ИППОЛ участвует в патогенезе многих заболеваний человека (Montuschi et al., 2004; Brame et al., 2004; Davies, Roberts, 2011). Согласно предложенной нами модели активации ИППОЛ радикалом HO2•, пергидроксильный радикал при столкновении с ПНЖК образует один из сотен вариантов изопростанов, γ-кетоальдегидов или ИзоЛГ. При реакции с ЖК с 2 ненасыщенными связями, такими как линолевая кислота, типичная для КЛ, HO2• образует соответствующие гидропероксиды. Paradies с соавторами были первыми, кто показал, что окисленный КЛ является надежным маркером окислительного повреждения митохондрий при старении (Paradies et al., 2009, 2011). Хотя HO2• имеет повышенную активность при реакции с ПНЖК с 3 и более ненасыщенными связями, окисление КЛ, который обычно имеет 4 линолевых кислоты с 2 двойными связями, можно объяснить тем, что в митохондриях HO2• образуется именно в местах скопления отрицательных зарядов КЛ.
Образование различных токсических продуктов в ходе ИППОЛ, очевидно, вызывает разные по своей природе повреждения липидов и белков и ложные информационные клеточные сигналы, которые какое-то время не проявляют себя в виде выраженной характерной клинической картины, а приводят к постепенному «износу» митохондрий и клеток.
Мы различаем 2 типа непосредственных повреждений митохондрий:
● первый тип связан с окислением и повреждением КЛ и ФЭ, в результате чего происходят нарушения структуры и функции респиросом и других мембранно-связанных белковых комплексов. Это приводит к нарушениям энергизации митохондрий и продукции АТФ;
● второй тип вызван непосредственными повреждениями белков токсическими продуктами типа ИзоЛГ, которые повреждают лизинсодержащие белки и ФЭ. Этот тип повреждений может объяснять, например, повреждение репликации мтДНК (Chocron et al., 2019; Anderson et al., 2020).
Anderson с соавторами [2020] показали, что exo-домен мтДНК репликазы, pol-gamma, намного более чувствителен к окислению, чем pol-домен. Авторы предположили, что при окислении АФК активность экзонуклеазы снижается быстрее, чем активность полимеразы. Поврежденная активность pol-gamma пропускает ошибки при редактировании, что приводит к наблюдаемому 20-кратному повышению мутаций мтДНК в сравнении с неокисленным ферментом (Anderson et al., 2020). Фосфолипид ФЭ, очевидно, может быть поврежден 2 путями: через повреждение ПНЖК при С2 в ходе аутоокисления пергидроксильным радикалом и через образование аддуктов этаноламина с ИзоЛГ. Примечательно, что большинство АФК имеют очень короткий период полужизни (самое большое порядка нескольких десятков секунд), в то время как ИзоЛГ образуют довольно стабильные аддукты (период полужизни измеряется днями), которые долгое время остаются связанными с белками и ФЛ и способны таким образом накапливаться при старении. Это может способствовать развитию характерных нарушений в наиболее подверженных старению органах — сердце, мозге и скелетных мышцах.
Важность окисления жирных кислот для повышенной продукции активных форм кислорода
Митохондрии млекопитающих производят АФК, в основном СОР и перекись водорода, на 11 различных местах дыхательной цепи в зависимости от типа субстратов и редокс-состояния электрон-транспортной цепи (Brand, 2016). Каждое место образования АФК имеет свои особенности (Brand, 2016; Quinlan et al., 2013). Brand (2016) подразделяет все такие места на 2 группы: 6 мест работают при редокс-изопотенциальном пуле НАДН/НАД+, равном ≈ –280 мВ, и 5 мест — при редокс-изопотенциальном пуле убихинол/убихинон (QH2/Q), равном ≈ +20 мВ (Brand, 2016; Quinlan et al., 2013). По мнению Brand (2016), с которым мы полностью согласны, большинство из опубликованных в литературе данных о вкладе отдельных дыхательных комплексов в общую продукцию АФК не имеют смысла по следующим причинам: во-первых, авторы часто использовали ингибиторы дыхательной цепи, которые создают условия, сильно отличающиеся от ситуации in situ; во-вторых, большинство авторов использовали только один субстрат для дыхания, в то время как in situ митохондрии одновременно метаболизируют несколько субстратов (Panov et al., 2009, 2014, 2018).
Однако главное отличие экспериментальных условий изучения митохондрий от реального состояния энергетического обмена in vivo состоит в том, что подавляющее большинство исследователей не использовали в качестве субстратов дыхания ЖК. Но именно ЖК являются основным энергетическими субстратами для большинства органов человека, включая мозг (Panov, 2014; Panov et al., 2014).
Brand с соавторами показали, что самая высокая скорость продукции АФК (O2∙ + H2O2) наблюдается при β-окислении ЖК (Brand, 2016; Quinlan et al., 2013; Perevoshchikova et al., 2013). Во время β-окисления ЖК мембранный пул CoQ становится восстановленным до CoQH2, и это может обратить перенос восстановительных эквивалентов (электронов от CoQH2) на уровне СДГ (дыхательный комплекс II) и далее активировать обратный перенос электронов на комплекс I, вовлекая таким образом комплексы I, II и III в продукцию АФК в добавление к продукции АФК на ферментах, участвующих в окислении ЖК (Brand, 2016; Perevoshchikova et al., 2013). Очень важно, что окисление ЖК в присутствии поддерживающих субстратов приводит к многократному увеличению скорости продукции АФК при дыхании митохондрий без АДФ (Panov, 2018; Panov et al., 2014).
Ранее мы предположили, что окислительному стрессу и, следовательно, ускоренному старению подвергаются те органы, которые имеют широкий диапазон физиологических нагрузок (Panov, 2018a, b). Когда эти органы находятся при пониженных физиологических нагрузках или в покое, эффективное окисление ЖК в присутствии поддерживающих субстратов может направлять избыточные электроны в производство АФК.
Новая парадигма механизмов старения
Итак, самые важные несоответствия между экспериментальными данными и митохондриальной свободнорадикальной теорией старения в ее традиционном виде могут быть разрешены, если принять, что основной механизм старения осуществляется протонированной формой супероксида — пергидроксильным радикалом. Однако остаются без ответа несколько «простых» вопросов, на которые до сих пор нет ответа. Что такое старение? И когда старение начинается?
С самого начала исследований механизмов старения с позиций митохондриальной теории исследователи придерживались той точки зрения, что старение представляет собой патологический процесс, вызванный окислительным стрессом, который влияет на наше здоровье, со временем мы подвергаемся множеству возрастных патологий и в конце концов умираем (Harman, 2003; Scialo et al., 2013). Но действительно ли старение — это просто процесс накопления ошибок в организме? Словарь науки и технологий определяет старение, как «процесс становления старше или изменений во времени» (Morris, 1992). Другими словами, человек после рождения, становясь старше, проходит через серию генетически предопределенных изменений, что называется постэмбриональным онтогенезом человека (Gould, 1977).
В другом параллельном мире науки ученые изучают метаболический синдром (МетС) — нозологическую единицу, созданную в конце 1980-х гг. МетС характеризуется одновременным присутствием нескольких факторов риска, включающих ожирение, нечувствительность (резистентность) к инсулину, атерогенную дислипидемию и гипертонию, которые связаны между собой, появляются в пожилом возрасте и имеют общие метаболические пути (Panov, Golubenko, 2020). Несомненно, что обе концепции «хрупкости» и МетС являются важными с медицинской точки зрения, но очевидно также, что сами по себе они мало что дают для понимания механизмов старения. Однако благодаря интенсивным исследованиям этих медицинских состояний было сделано важное открытие: скорость старения и энергетический метаболизм проявляют явную зависимость от пола. По нашему мнению, эти открытия являются критичными для понимания механизмов старения как процесса перехода индивидов от репродуктивного периода в последнюю стадию онтогенеза — старость.
Половая дифференциация в скоростях старения и продолжительности жизни
Большинство животных и растений имеют мужской и женский пол, несмотря на репродуктивные преимущества асексуальных вариантов размножения в биологии. Очевидно, в далеком прошлом существовали какие-то силы отбора, которые придали преимущества половому размножению и рекомбинации генов на индивидуальном или популяционном уровне. Влияние пола и генетической рекомбинации сказывается на эффективности естественного отбора, который является главным фактором эволюции (Barton, Charlesworth, 1998; Hoekstra, 2005). Было экспериментально показано, что наличие полового размножения увеличивает скорость адаптации вида к новым неблагоприятным условиям, но не влияет на приспособляемость к новым благоприятным условиям, где было мало селекции (Goddard et al., 2005). Тем не менее у нас все еще нет полного понимания, почему в живом мире половое размножение преобладает (Hoekstra, 2005). Недавно была высказана гипотеза, что внутренняя продукция АФК в клетках 2 млрд лет назад вызвала секс революцию у эукариот (Hörandl, Speijer, 2018). Было также отмечено, что предыдущие работы по половой репродукции игнорировали важные сложности, с которыми сталкиваются природные популяции, такие как генетический дрейф и пространственная структура популяций (Otto, Lenormand, 2002).
Накопленные к настоящему времени данные показывают, что у многих видов, включая человека, самки стареют намного медленнее и имеют бóльшую продолжительность жизни, чем самцы (Hoekstra, 2005; Vina et al., 2003, 2005; Ballard et al., 2007). Мы предполагаем, что эти качества имеют важное биологическое значение для самок: вынашивание и взращивание нового поколения, несмотря на трудности внешних условий и метаболические ограничения (голод).
Эти важные биологические цели требуют, чтобы самки были метаболически и физически достаточно эффективными, но не сверхэффективными с метаболической (термодинамической) точки зрения, устойчивыми к неблагоприятным внешним условиям и в соответствии с митохондриальной теорией старения производили меньше АФК. Многочисленные исследования разных видов животных показали, что, в общем, самки производят меньше АФК, чем самцы (Hoekstra, 2005; Ballard et al., 2007; Demeter et al., 2008; Sengupta, 2013). Как всегда, существуют исключения из общего правила, но опять же, они подчиняются общему условию: дольшеживущий пол продуцирует меньше АФК (Ali et al., 2006).
Половые различия в использовании жиров в энергетическом метаболизме
В большинстве экспериментов на животных долгое время использовались преимущественно самцы, поскольку ученые обычно избегали использовать самок из-за их репродуктивных циклов и колебаний уровней гормонов, что сильно влияет на точность результатов исследований (Zucker, Beery, 2010). По этим причинам исследования половых различий разнообразных функций и процессов в организме животных начались сравнительно недавно.
На сегодняшний день, однако, имеется огромное количество публикаций на эту тему. Исследования метаболических отличий между мужчинами и женщинами были стимулированы в основном прогрессом в развитии спортивной медицины. В этом разделе мы рассмотрим только те работы, которые непосредственно относятся к теме данного обзора: какие межполовые метаболические различия лежат в основе того, что у многих видов млекопитающих, включая человека, самки (женщины) живут дольше, чем самцы (мужчины) (Demeter et al., 2008).
Хорошо известно наблюдение, что женщины обычно имеют бóльшее количество жира в теле, чем мужчины. Распределение жира также разное: женщины хранят больше жира в бедренно-ягодичной области, в то время как у мужчин содержится больше жира в области живота (висцеральный жир) (Blaak, 2001; Lemieux et al., 1993). Нужно отметить, что метаболически висцеральный жир, особенно в сальнике, самый активный. Важно отметить, что накопление висцерального жира сопровождается множественными эндокринными нарушениями, включая повышенное содержание кортизола и андрогенов у женщин, а также гормона роста, а у мужчин — снижение секреции тестостерона. Последствия эффектов гормонов выражены больше для висцерального, чем для подкожного ожирения, поскольку жир сальника имеет более высокую целлюлярность, иннервацию и снабжение кровью. Более того, плотность рецепторов для кортизола и андрогенов также выше в висцеральном жире, чем в других областях жировой ткани (Bjorntorp, 1996). К этому нужно добавить, что имеются эпидемиологические и метаболические связи между центральным (висцеральным) ожирением и болезнями (Bjorntorp, 1996). Это важный факт, потому что висцеральное ожирение является распространенным симптомом у мужчин и женщин с МетС.
Физиологические эксперименты с пероральной администрацией триглицеридов с небольшим количеством меченой олеиновой кислоты показали следующие региональные различия в порядке потребления липидов: сальник = ретроперитонеальный жир > подкожный брюшной > подкожный бедренный жир у мужчин с подобным же рангом времени полужизни триглицеридов, что указывает на скорости оборота триглицеридов в этом же порядке. Тестостерон усиливал эти различия у мужчин. У женщин до менопаузы накопление висцерального жира было меньше, чем у мужчин, и подкожный брюшной жир имел более высокую скорость оборота, чем бедренный жир (Bjorntorp, 1996).
Приведенные выше эксперименты in vivo указывают на то, что зависимые от пола вариации метаболизма жиров контролируются половыми гормонами. Это предполагает, что в пострепродуктивный стадии онтогенеза половой диморфизм метаболизма жира должен быть меньше или отсутствовать.
Результаты исследований in vitro также указывают, что межполовые различия уменьшаются после менопаузы, но могут быть восстановлены приемом эстрогенов (Bjorntorp, 1996). Это предполагает, что функциональные эффекты эстрогенов у женщин сходны с таковыми тестостерона у мужчин. Как будет показано в следующем разделе, эффекты обоих гормонов направлены на субстраты митохондриального окисления и, соответственно, на продукцию АФК. Однако механизм влияния эстрогена на окисление жиров должен быть непрямым, поскольку жировая ткань человека не имеет специфических рецепторов эстрогена и прогестерона (Bjorntorp, 1996).
Что касается метаболизма белков, то половых различий в базовом уровне общего баланса белков в мышцах не было обнаружено (Tipton, 2001). В целом тестостерон увеличивает синтез белков и общий баланс белков и увеличивает мышечную массу. В детском возрасте мальчики и девочки имеют одинаковое количество тестостерона, в пубертатном периоде уровень тестостерона, так же как и общая мышечная масса, сильнее увеличивается у мальчиков. Более того, хотя это еще не показано на человеке, данные in vitro и на крысах предполагают, что гормоны яичников тормозят синтез мышечных белков (Tipton, 2001).
Половые различия в использовании энергетических субстратов при физических нагрузках
Непрямой эффект половых гормонов на метаболизм жиров подтверждается данными о половом диморфизме в использовании ЖК во время интенсивной физической активности (Blaak, 2001; Carter et al., 2001). Carter с соавторами (2001) исследовали использование субстратов всего организма, глюкозы и глицерола, у мужчин и женщин под влиянием тренировки на выносливость в течение 90 мин. Во время субмаксимальной физической нагрузки женщины показали более низкий уровень отношения дыхательного обмена, чем мужчины. Этот показатель демонстрирует отношение количества СО2, образуемого во время метаболизма, к потребленному О2. Отношение дыхательного обмена определяется путем сравнения выдыхаемого воздуха с комнатным воздухом. Этот параметр уточняет, какой субстрат преимущественно используется организмом в ходе метаболизма: жиры или липиды. Значение отношения 0,7 указывает, что основным источником энергии были жиры, значение 1,0 — преимущественное использование углеводов, а значения между этими величинами — смесь этих субстратов (Widmaier, 2018). В сравнении с женщинами, мужчины демонстрируют значительное увеличение окисления лейцина, но не лизина, что указывает на то, что при интенсивной физической нагрузке мужчины проявляют повышенную потребность в аминокислотах для получения энергии. Общий вывод был сделан, что, в сравнении с мужчинами, женщины при физической нагрузке используют больше жиров и меньше углеводов и аминокислот (Carter et al., 2001; Tarnopolsky, 2000; Lamont et al., 2003). Таким образом, физиологи поддерживают наш вывод, что окисление ЖК требует одновременного присутствия других митохондриальных метаболитов, получаемых из углеводов или белков. Поскольку женщины потребляют меньше субстратов, поддерживающих окисление ЖК, можно ожидать, что и скорость окисления жиров у них меньше, чем у мужчин. Это может объяснять, почему в целом при интенсивных физических нагрузках женщины обычно показывают более низкие результаты в спорте и, по-видимому, производят в покое меньше АФК (Joyner et al., 2008, 2017; Lepers, 2019).
Нами было показано, что митохондрии окисляют ЖК только в присутствии поддерживающих субстратов, получаемых из углеводов и белков (Panov et al., 2014, Panov, 2018). Представленные выше данные о различиях метаболизма у мужчин и женщин предполагают, что женщины требуют меньше поддерживающих субстратов для эффективного окисления ЖК. Мы можем предположить, что изолированные митохондрии скелетных мышц или сердца самок должны отличаться от таковых у самцов в потребности поддерживающих субстратов, а также продуцировать меньше АФК. Это новое и важное направление исследований метаболизма органов. К сожалению, до сих пор мы были единственными, кто изучал окисление и производство АФК при окислении ЖК с применением поддерживающих субстратов. При этом мы использовали в экспериментах только самцов, так что изучение этой проблемы на самках остается открытым.
Изучение полового диморфизма окисления ЖК выделенными митохондриями разных органов в системе in vitro, несомненно, требует дальнейшего продолжения. Поскольку мужчины показали в ходе интенсивных физических нагрузок более высокий уровень экспрессии генов, связанных с ПДГК, в сравнении с женщинами (Olivetti et al., 1995), и потребляли больше углеводов и аминокислот наряду с ЖК (Carter et al., 2001; Tarnopolsky, 2000; Lamont et al., 2003), мы можем предположить что бóльшая продолжительность жизни у женщин и меньшая скорость старения связаны с меньшей скоростью продукции АФК в результате менее эффективного с энергетической точки зрения окисления ЖК.
Метаболический синдром как пострепродуктивная стадия онтогенеза
Врачи давно заметили, что многие пациенты имеют похожие внешние признаки и биохимические показатели нарушения обмена веществ: резистентность к инсулину, ожирение, атерогенную дислипидемию и гипертоническую болезнь. В конце 1980-х гг. был принят термин «метаболический синдром» под его собственным диагностическим кодом 277.7 согласно Международной классификации болезней 9-го пересмотра (МКБ-9). Однако существующие определения МетС не дают оснований для понимания его сути и являются по большей части просто перечислением симптомов.
Ожидалось, что подробное определение МетС и его основных свойств ускорит понимание причин этих симптомов и поможет разработать нужные лекарства и рекомендации относительно образа жизни (Misra, Khurana, 2009). Однако анализ литературы, опубликованной за последние 30 лет после выделения МетС в отдельную нозологическую единицу, показал, что все еще нет глубокого понимания того, как и почему этот синдром развивается.
Даже тот факт, что возраст является одним из критических условий МетС, до сих пор не является общепризнанным. Значительная часть литературы посвящена дискуссии между теми, кто считает, что ведущим симптомом МетС является устойчивость к инсулину, и теми, кто считает таковым ожирение (Huang, 2009; Reaven, 1988, 2006; Björntorp, 1988). Эти различия во мнениях находили отражение в критериях диагностики МетС, которые были представлены несколькими международными учреждениями — подробное обсуждение можно найти в работе Huang (2009). В подобные споры масла в огонь подливали данные о том, что расовые и этнические факторы могут сильно влиять на критерии диагностики МетС (Misra, Khurana, 2009; Vikram et al., 2009).
Происхождение метаболического синдрома
Результаты генетических исследований потенциальной наследуемости предрасположенности к МетС были анализированы Stančakova и Laakso (2014). Авторы пришли к выводу, что на сегодня есть мало данных об общем генетическом фоне, который мог бы объяснить собрание метаболических характеристик, наблюдаемых при МетС. Кроме того, существующие данные указывают на важность эпигенетических механизмов (Stančakova, Laakso, 2014). Этот вывод согласуется с нашим предположением о том, что внешние проявления МетС отражают генетические свойства наших далеких предков и условия внешней среды (Panov, 2020; Panov, Dikalov, 2018b, 2020). По существующим представлениям старение и МетС представляют собой результат накопления различного рода повреждений, вызванных окислительным стрессом и/или неправильным образом жизни (Harman, 1981, 1983; Wilmot et al., 2012; Edwardson et al., 2012; Sun et al., 2014).
Как мы указывали ранее, все люди после рождения подвергаются изменениям, определенным генетически в процессе постэмбрионального онтогенеза. Одна из теорий старения предполагает, что с возрастом потеря гетерохроматина приводит к изменениям экспрессии генов (Villiponteau, 1997; Tsurumi, 2012).
Очевидно, что, когда мужчины и женщины входят в пострепродуктивную стадию, они уже теряют много гетерохроматина, который изначально содержится в генах новорожденного. Гены участков гетерохроматина, участвующие в стадиях онтогенеза, от рождения до половой зрелости включительно, подвергаются длительному естественному отбору и позволяют организмам приспосабливаться к изменяющимся условиям внешней среды. Гены пострепродуктивной стадии онтогенеза не подвергаются интенсивному отбору, поэтому представляют собой гены наших далеких предков.
Это проявляется во многих свойствах нашего тела, которые появляются после 55–60 лет: туловище становится объемным, на коже рук появляются темные пигментные пятна, увеличивается оволосение у мужчин и т.п. Очевидно, что после перехода организма в пострепродуктивную стадию онтогенеза появляются свойства метаболизма, отличные от предшествующих стадий и, очевидно, схожие с метаболизмом наших предков. Существует множество признаков того, что пожилые люди Северной Европы и Сибири приобретают внешние и метаболические свойства, типичные для современных народов Крайнего Севера, например инуитов, эскимосов или долган. Эти народы потребляют мало углеводной пищи, их диета состоит в основном из мяса и жира животных и рыбы.
Опять же, многое для понимания природы МетС мы можем найти в половых различиях энергетического метаболизма при переходе мужчин и женщин из репродуктивной в пострепродуктивную стадию онтогенеза, которая обычно считается началом стадии старения. Обычно это происходит между 50 и 55 годами. У женщин переход происходит довольно быстро и связан с менопаузой, при этом меняются внешний вид и метаболизм, и, по мнению некоторых исследователей, риск МетС увеличивается на 60% (Park et al., 2003).
Важно, что у женщин проявление МетС в постменопаузе не зависит от индекса массы тела и физической активности (Carr, 2003), но может зависеть от динамики уменьшения эстрогенов с возрастом (Kim et al., 2012). Интересно, что исследования по замещению половых гормонов у животных показали, что самцы, получавшие тестостерон, показали ухудшение симптомов МетС, в то время как самки при замещении эстрогена показали значительное уменьшение симптомов МетС, например гипертонии (Baños et al., 2013). Это согласуется с предположением о том, что генетически предопределенный переход в пострепродуктивную стадию во время нормального онтогенеза, который сопровождается изменениями в гормональном статусе, является основной естественной причиной МетС у женщин. При этом некоторые симптомы МетС, такие как нечувствительность к инсулину и увеличение висцерального жира, на самом деле отражают новый гормональный и генетический статус, сопровождающийся изменениями в метаболизме с увеличением потребления жиров в качестве основного источника энергии. С этой точки зрения, диабет 2-го типа отражает ненужность углеводов в пострепродуктивной стадии.
Половые различия в переходе из репродуктивной в пострепродуктивную стадию онтогенеза. Женщины гораздо менее эффективно окисляют ЖК, являющиеся основным источником энергии во всех возрастах индивида, чем мужчины, и, вероятно, медленнее продуцируют при этом АФК (Carter et al., 2001; Tarnopolsky, 2000; Lamont et al., 2003).
В этой связи представляют интерес данные Olivetty с соавторами (1995), которые изучали возрастные изменения в одноядерных и двуядерных кардиомиоцитах, используя метод ферментной диссоциации миокарда сердец, полученных при аутопсии. Исследованный возрастной интервал охватывал мужчин и женщин с 17 до 95 лет. Авторы обнаружили, что по ходу старения сердца женщин сохраняли желудочковую массу миокарда, агрегатное число моно- и двухядерных миоцитов, а также средний клеточный диаметр и объем. У мужчин же авторы обнаружили потерю миокарда со скоростью 1 г/год и в целом возрастную потерю за 79 лет примерно 64 млн клеток. В оставшихся клетках объем кардиомиоцитов увеличивался с примерной скоростью 158 мкм/3 года в левом желудочке и 167 мкм/3 года — в правом. Эти изменения в сердцах мужчин происходили линейно от 17 до 95 лет. В этот же возрастной промежуток структурные свойства миокарда женщин не менялись (Olivetty et al., 1995).
Таким образом, оказывается, что женщины входят в пострепродуктивный период с относительно «молодым» сердцем, в то время как мужчины теряют много кардиомиоцитов, а оставшиеся клетки увеличивают свой объем, что с метаболической точки зрения (доставка с периферии в центр клетки субстратов и кислорода) является недостатком.
Olivetty с соавторами (1995) сообщают, что практически с начала репродуктивного периода онтогенеза у мужчин по какой-то причине происходит гибель кардиомиоцитов. Мы можем предположить, что такой причиной является окислительный стресс.
Особенности метаболизма ЖК, которые вызывают симптомы МетС и ускоряют старение. Среди всех млекопитающих человеческие самки имеют удивительно продолжительный пострепродуктивный период онтогенеза (Bove et al., 2018), который, по-видимому, в большой степени связан с метаболической защитой, снижающей скорость старения в репродуктивном периоде (Ventura-Clapier et al., 2020). Есть несколько аргументов в пользу утверждения о том, что в основе ускоренного старения мужчин и сравнительно медленного старения женщин, а также половых различий в метаболизме и физической производительности лежат особенности β-окисления митохондриями ЖК. Независимо от возраста и пола жиры являются главным источником энергии и углерода для анаплеротических реакций.
Окисление митохондриями НАД-зависимых субстратов, которые поставляются за счет окисления глюкозы и аминокислот, не может обеспечивать высокую скорость потребления АТФ, поскольку окисление НАДН митохондриальной НАДН-дегидрогеназой является лимитирующим скорость дыхания этапом (Panov et al., 2007). Энергетическая эффективность β-окисления ЖК в присутствии поддерживающих субстратов способна обеспечивать самые высокие потребности в АТФ при максимальных физических нагрузках сердца и скелетных мышц. Высокая скорость дыхания обеспечивается не только за счет восстановления НАД-системы митохондрий, но и за счет восстановления мембранного пула убихинона, поэтому при окислении ЖК электроны в дыхательную цепь митохондрий поступают не только через комплекс I, но и через комплексы II и III благодаря обращению транспорта электронов от QH2-мембраны на уровне СДГ (комплекса II). Однако когда потребление энергии АТФ органом снижается, избыток электронов направляется на производство СОР и, следовательно, HO2• (Panov, 2020; Panov, Dikalov, 2020).
Brandt (2016) отмечал, что скорость продукции АФК может увеличиваться, когда митохондрии имеют обильное снабжение субстратами окисления и низкий уровень потребления АТФ (низкая функциональная нагрузка), и уменьшаться, когда потребление энергии велико или лимитировано поступление субстратов, что объясняет, почему появление симптомов МетС сильно зависит от образа жизни.
Это, вероятно, является главной причиной, почему мужчины начинают стареть раньше и быстрее, чем женщины. В возрасте 45–50 лет многие мужчины снижают физическую активность, едят больше, чем нужно, и потребляют алкоголь, что значительно увеличивает скорость образования АФК и скорость старения.
После менопаузы у женщин гормональный статус становится ближе к мужскому, поэтому характер окисления ЖК у них также становится другим и повышается скорость образования АФК. Самое главное, мы предполагаем, что и мужчины, и женщины в пострепродуктивной стадии онтогенеза имеют метаболизм, схожий с метаболизмом наших далеких предков, которые не потребляли углеводов в качестве основного источника энергии.
Этим может объяснить появление резистентности к инсулину и само происхождение симптомов МетС, в частности изменение структуры тела, сопровождающееся увеличением отложения висцерального жира. Подобные симптомы являются не патологией, а указанием на смену типа метаболизма. Они становятся патологическими только при избыточном употреблении углеводов: возникает диабет 2-го типа и висцеральное ожирение. С пониженной чувствительностью к инсулину большая часть углеводов направляется на производство жира и ускоряет ожирение, в особенности центральное. Избыточное потребление пищи и снижение физической и умственной активности ускоряют производство СОР и пергидроксильного радикала, который активирует ИППОЛ. При активации ИППОЛ образуется больше токсичных продуктов, которые активируют воспалительные процессы в суставах и других органах, повреждают белки, КЛ и ФЭ, нарушая функции митохондрии и в конечном итоге вызывая старение органов. В первую очередь стареют скелетные мышцы, сердце и мозг.
Какое-то время постепенное накопление самых разных незначительных повреждений не сопровождается выраженной клинической картиной. Это можно объяснить самим характером ИППОЛ, когда сотни разнообразных продуктов изопростанового перекисного окисления ПНЖК вызывают самые разные поврежденияи и дисрегуляции (Панов, 2018). У людей, предрасположенных к раннему старению, клиническая картина может иметь характер неопределенных симптомов в виде повышенной усталости, слабости и других признаков «хрупкости». Со временем накопление «износа», дисрегуляций и снижение энергетики приобретают более определенный характер, отражающий дисфункции, такие как сердечная недостаточность, болезнь Альцгеймера или что-то еще и, наконец, смерть.
Заключение
Мы обсудили свидетельства того, что активация ИППОЛ пергидроксильным радикалом позволяет понять механизм медленного и неизбежного старения, и получили объяснение важным противоречиям митохондриальной свободнорадикальной теории старения в ее существующей парадигме. Мы также высказали предположение, что концентрирование только на повреждениях, которые сопровождают старение, непродуктивно, потому что это не дает ответы на вопросы, почему и когда начинается старение, а также почему женщины стареют медленнее и живут обычно дольше мужчин. Мы придерживаемся точки зрения, что старение является развитием во времени, когда мужчины и женщины проходят через последовательность генетически предопределенных стадий. Поскольку мужчины и женщины играют разные биологические роли, они также имеют разные метаболические стратегии. Во всех стадиях онтогенеза ЖК являются основными субстратами для обеспечения организма энергией и промежуточными метаболитами для обеспечения роста и поддержания организма. Энергетическая эффективность β-окисления ЖК контролируется митохондриальными метаболитами, которые окисляются одновременно с ЖК. Однако высокая эффективность окисления ЖК сопровождается многократным увеличением продукции СОР и, следовательно, пергидроксильного радикала. Мы предполагаем, что половые гормоны определяют качество и количество субстратов, поддерживающих окисление ЖК. Это приводит к различным скоростям окисления ЖК и продукции АФК. Женщины окисляют больше ЖК, но с меньшей, чем мужчины, энергетической эффективностью и меньшей скоростью производства АФК, а значит, они стареют медленнее, чем мужчины. Когда женщины входят в пострепродуктивную стадию онтогенеза, меняется их гормональный фон. Кроме того, эта последняя стадия онтогенеза управляется генами, по которым не было эффективного естественного отбора, поэтому эти гены отражают метаболические свойства и болезни наших далеких предков.
На рис. 1.1 мы суммировали имеющуюся в научной литературе информацию в виде схемы, графически показывающей различия между женщинами и мужчинами в продукции АФК, которая определяет скорость старения в ходе постэмбрионального онтогенеза.
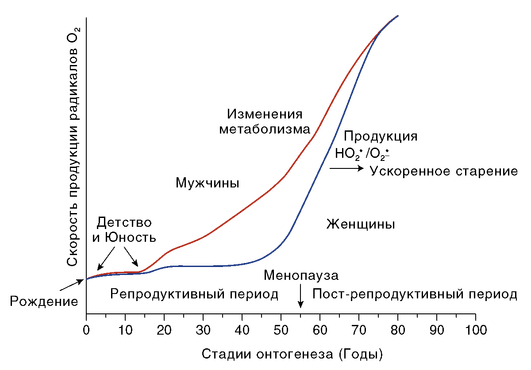
Рис. 1.1. Схематическая презентация различий между мужчинами и женщинами в продукции активных форм кислорода в ходе онтогенеза. Схема построена на основании данных следующих работ: Olivetty et al., 1995; Blaak, 2001; Carter et al., 2001; Tarnopolsky, 2000; Lamont et al., 2003; Kim et al., 2012
МетС, который обычно развивается в возрасте после 45 лет у мужчин и примерно в 55 лет у женщин, отражает 2 главных события во время и после перехода из репродуктивной в пострепродуктивную стадию онтогенеза: смена гормонального фона у женщин и новый тип метаболизма с преимущественным использованием жиров и белков в качестве источника энергии. Высокая энергетическая эффективность окисления ЖК в присутствии поддерживающих субстратов при сниженной физической активности приводит к ускоренному старению, особенно органов с большим диапазоном функциональной активности (скелетные мышцы, сердце и мозг).
Какие симптомы МетС будут превалировать, зависит для каждого индивида, от метаболического фенотипа его предков и его образа жизни и питания. Поскольку в пострепродуктивном периоде работают гены наших далеких предков, которые не употребляли сахар и лапшу, постепенное развитие устойчивости к инсулину является нормой, а не патологией. Нужно только резко ограничить быстрые углеводы (сахар, сладости, а также напитки, содержащие много сахара). Большое потребление углеводов может приводить к развитию диабета 2-го типа и ожирению. Но главное условие продления жизни в старости — правильное питание: ограниченное по калориям, но полноценное по белкам и витаминам, а также высокая умственная и физическая активность. По собственному опыту могу сказать, что питание 2 раза в день очень помогает сохранить стройность, а кратковременное голодание (8–10 ч) способствует сохранению здоровья и избавлению от лишнего веса.
03.01.2023 | 14:35:13