Хеликобактериоз. Helicobacter pylori. Хеликобактер пилори. Определение, история изучения, распространенность Helicobacter pylori. Пути передачи, характеристика, патогенез хеликобактериоза.
Раздел: Статьи
/
Общая врачебная практика.
/
Гастроэнтерология
/
Хеликобактериоз. Helicobacter pylori. Хеликобактер пилори. Определение, история изучения, распространенность Helicobacter pylori. Пути передачи, характеристика, патогенез хеликобактериоза.
Содержание
Определение понятия «хеликобактериоз»
Хронология изучения Helicobacter pylori
Распространенность Helicobacter pylori
Пути передачи H. pylori
Биологическая характеристика H. pylori
- Морфологические варианты Helicobacter pylori
- Физиология H. pylori
-- Локомоционная способность Helicobacter pylori
-- Helicobacter pylori – хемогетероорганотроф
-- Характеристика механизма дыхания бактерий H. pylori
-- Факторы патогенности Helicobacter pylori
-- Факторы колонизации эпителия желудка Helicobacter pylori
-- Факторы персистенции Helicobacter pylori
Патогенез хеликобактериоза
- Гистологическая структура слизистой оболочки желудка
- Патогенное воздействие на слизистую оболочку желудка

Хеликобактериоз – инфекционный процесс, этиологически детерминированный Helicobacter pylori, хеликобактер пилори и патогенетически ассоциированный с хроническим гастритом, язвенной болезнью, дистальной (некардиальной) аденокарциномой и MALT-лимфомой желудка.
•Впервые бактерии, своим морфотипом напоминающие Helicobacter pylori, были обнаружены в содержимом желудка человека профессором Ягеллонского университета (Краков, Польша) Валерием Яворски (Walery Jaworsky) в 1889 году.
•В 1892 итальянским патологоанатомом Джулио Бизозеро (Giulio Bizzozero) были описаны изогнутые бактерии в слизистой оболочке желудка собак, по-видимому, являющиеся Helicobacter felis.
•Наиболее близко к открытию Helicobacter pylori подошёл английский микробиолог Говард Стир (Howard Steer), в 1975 году с помощью электронной микроскопии показавший присутствие изогнутых палочек в слизистой оболочке желудка, однако не сумевший выделить их в чистой культуре.
•В 1979 году австралийский патологоанатом Робин Уоррен (John Robin Warren) описал изогнутую грамнегативную бактерию, закономерно обнаруживающуюся в слизистой оболочке желудка при хроническом активном гастрите.
Рис. 1. H. pylori в слизистой оболочке желудка

1. Согласно общепризнанной наиболее взвешенной комплексной оценке степени распространённости Helicobacter pylori, Хеликобактер пилори, этой бактерией инфицировано не менее половины человеческой популяции.
2. Население индустриально развитых стран инфицировано Helicobacter pylori в значительно меньшей степени, нежели население стран с экономикой переходного типа.
3. Среди лиц в возрасте 35-40 лет частота встречаемости Helicobacter pylori составляет:
в Австрии – 18%
в Великобритании – 20%
во Франции – 26%
в Новой Гвинее – 60%
во Вьетнаме – 80%
в Кот-д’Ивуаре – 82%
в Индии – 92%
4. Различия в распространённости Helicobacter pylori отмечаются также и в отдельных возрастных группах.
5. В частности, в Японии частота встречаемости Helicobacter pylori составляет (в среднем, для соответствующей возрастной группы):
9 лет – 22%
16 лет – 48%
24 года – 64%
30 лет – 71%
38 лет – 82%
46 лет – 88%
54 года – 90%
70 лет – 92%
6. Встречаемость Helicobacter pylori при хроническом гастрите составляет 92%, при язвенной болезни желудка – 80%, язвенной болезни двенадцатиперстной кишки – 98%, дистальной (некардиальной) аденокарциноме желудка – 92%.
1. Гастро-оральный путь передачи Helicobacter pylori является путём профессионального заражения персонала эндоскопических кабинетов и реализуется в результате систематического заглатывания инфицированных аэрозолей, возникающих в ходе выполнения процедуры верхней эзофагогастродуоденоскопии.
2. Гастро-гастральный путь передачи Helicobacter pylori является путём ятрогенного заражения пациентов эндоскопических кабинетов через ненадлежащим образом продезинфицированный инструментарий.
3. Фекально-оральный путь передачи Helicobacter pylori естественным путём реализуется лишь в детском возрасте – в условиях несовершенства кислотообразующей функции желудка.
4. Инфицирующая доза при фекально-оральном пути передачи Helicobacter pylori составляет не менее 103 бактериальных клеток.
5. Внедрение в бытовую практику предметов ухода за младенцем однократного применения значительно снизило частоту инфицирования Helicobacter pylori вследствие пресечения естественного фекально-орального пути передачи.
6. Прочие, неэволюционно сложившиеся пути передачи H. pylori (орально-оральный, гастро-оральный и гастро-гастральный), реализуются исключительно по горизонтали.
7. Инфицирующая доза при гастро-гастральном пути передачи Helicobacter pylori составляет несколько десятков бактериальных клеток.
8. Высокая эффективность гастро-гастрального пути передачи Helicobacter pylori обусловлена отсутствием необходимости преодоления бактериальными клетками кислотного барьера желудка.
Морфологические варианты Helicobacter pylori
Helicobacter pylori является изогнутой палочковидной бактерией. Описано несколько морфологических вариантов палочковидной структуры Helicobacter pylori: одиночные (почковидные) и парные (собственно палочковидные, S-образные, С-образные, U-образные, V- образные, крючковидные).
Парные морфологические варианты сформированы двумя неразошедшимися после деления бактериальными клетками.
Палочковидные варианты способны трансформироваться в так называемую «кокковидную форму» - морфологический вариант Helicobacter pylori, имеющий форму, приближающуюся к сферической.
К формированию «кокковидных форм» Helicobacter pylori предрасполагают особенности его ультраструктуры.
Термин «кокковидные формы» является неточным, не отражающим биологического смысла образования таких форм; следует пользоваться методологически строгим термином «формы с дефектной клеточной стенкой».
Рис. 2. Трансмиссионная микроскопия H. pylori

Рис. 3. Сканирующая микроскопия H. pylori

Физиология H. pylori
Локомоционная способность Helicobacter pylori
• Наличие жгутикового аппарата обеспечивает Helicobacter pylori способность к активной локомоции – интенсивному движению вперёд, сопровождающемуся вращением вокруг собственной длинной оси.
• Скорость передвижения Helicobacter pylori составляет 2-3 мкм/сек – в воде и 0,5-1,0 мкм/сек – в растворе глицерина, вязкость которого приближается к вязкости слизи желудка.
• Направление движения Helicobacter pylori не является случайным: в естественных условиях существования он демонстрирует положительный хемотаксис в направлении апикальной поверхности эпителиоцитов желудка, устьев и протоков желудочных желез.
Helicobacter pylori – хемогетероорганотроф
• В качестве источников углерода H. pylori использует глюкозу, свободные аминокислоты и органические кислоты, поступление которых в бактериальную клетку происходит как пассивно, так и в результате активного транспорта.
• В своём периплазматическом пространстве Helicobacter pylori способен ферментировать олигопептиды до свободных аминокислот.
• Помимо аминокислот, в качестве дополнительного источника азота H. pylori использует аммиак, образующийся в результате гидролиза мочевины.
• В естественных условиях существования Helicobacter pylori питается продуктами, освобождающимися из разрушающихся погибших эпителиоцитов желудка, а также олигопептидов, образующихся в результате переваривания пищи пепсином желудочного сока.
• In vitro питательные потребности Helicobacter pylori могут быть восполнены на искусственных питательных средах с высоким содержанием свободных аминокислот (высоким индексом аминного азота).
Характеристика механизма дыхания бактерий H. pylori
Дыхание – серия сопряжённых окислительно-восстановительных реакций, суть которых состоит в переносе электронов от молекул доноров к молекулам акцепторов, сопровождающемся формированием трансмембранного протонного потенциала и синтезом макроэргических соединений.
Helicobacter pylori свойственен аэробный тип дыхания: в качестве конечного акцептора электронов он использует кислород.
Ключевым этапом дыхания Helicobacter pylori является цикл трикарбоновых кислот (цикл Кребса), носящий у него, однако, незамкнутый характер: на стадии превращения фумарата в сукцинат цикл прерывается.
В результате одного незавершённого цикла трикарбоновых кислот синтезируется одна молекула аденозинтрифосфата (АТФ) либо гуанозинтрифосфата (ГТФ) – основных макроэргических соединений бактериальной клетки.
Эффективность процесса дыхания достаточно высока: до 95% молекул кислорода связываются с протонами с образованием молекул воды.
При этом, 5% молекул кислорода переходит в активные формы: супероксид-анион О2‒, синглетный кислород О2•, перекись водорода Н2О2
Активные формы кислорода чрезвычайно агрессивны: их деструктивному действию, в первую очередь, подвержены цитоплазматические мембраны, разрушение которых неминуемо приводит к гибели бактериальной клетки.
Агрессивному действию активных форм кислорода противостоит антиоксидантная система Helicobacter pylori: супероксиддисмутаза, каталаза, алкилгидропероксидредуктаза. Helicobacter pylori испытывает выраженный дефицит компонентов антиоксидантной защиты: уровень продукции её компонентов значительно уступает уровню продукции активных форм кислорода.
Вследствие этого, Helicobacter pylori способен существовать лишь при низком парциальном давлении кислорода.
В природном биотопе – слизистой оболочке желудка – популяция Helicobacter pylori существует именно при таких условиях: парциальное давление кислорода здесь сильно уступает таковому в атмосферном воздухе, где содержание кислорода составляет 21% (об/об).
Культивирование Helicobacter pylori in vitro также возможно лишь в обеднённой кислородом искусственной атмосфере следующего состава (об/об): кислород (О2) – 5%, углекислый газ (СО2) – 10%, азот (N2) – 85%.
Таким образом, Helicobacter pylori является микроаэробной (микроаэрофильной) бактерией: безусловно дышащей кислородом, но выдерживающей лишь низкое его содержание в окружающей среде.
Факторы патогенности Helicobacter pylori
Факторы патогенности Helicobacter pylori подразделяются на факторы колонизации, обеспечивающие первичное заселение им природного биотопа – слизистой оболочки желудка; факторы персистенции, обеспечивающие стабильное существование популяции Helicobacter pylori в условиях противостояния системам коррекции гомеостаза хозяина; и факторы реализации инфекционного процесса, обеспечивающие формирование разнообразных патологических изменений в гастродуоденальной области.
Приведенное деление факторов патогенности Helicobacter pylori на три группы весьма условно: с одной стороны, одни и те же факторы могут принимать участие в различных фазах инфекционного процесса (например, как в колонизации, так и в персистенции), с другой стороны, факторы патогенности не могут действовать изолировано друг от друга: патогенез инфекционного процесса представляет собой результат согласованного воздействия полного комплекса факторов патогенности на чувствительную иммунокомпетентную систему – организм человека.
Факторы колонизации эпителия желудка Helicobacter pylori
1. К факторам колонизации H. pylori относятся: гель-динамическая форма, жгутики, уреаза, хеморецепторы и адгезины.
2. Жгутики, вращающиеся единым пучком, обеспечивают Helicobacter pylori штопорообразное движение с относительно высокой скоростью в слое слизи желудка – среде, отличающейся повышенной вязкостью.
3. Эффективность локомоции в вязкой среде значительно повышается благодаря гель-динамической форме бактериальной клетки Helicobacter pylori, поддерживающейся пептидогликаном клеточной стенки.
4. Часть белков наружной мембраны выполняют функцию хеморецепторов, обеспечивающих Helicobacter pylori ориентацию в слое слизи желудка в направлении эпителиального пласта.
Выживаемость Helicobacter pylori в кислой среде желудочного содержимого (рН 1-2) обеспечивается уреазой, катализирующей гидролиз мочевины:
CO (NH2)2 + H2O = NH3 + HCO2 NH2
HCO2 NH2 = NH3 + CO2
NH3 + H2O = NH4+ + OH –
Гидроксил-ион нейтрализует хлористоводородную кислоту желудочного содержимого. Адгезию бактериальных клеток Helicobacter pylori к эпителиоцитам желудка обеспечивают адгезины – молекулы липополисахарида и белков наружной мембраны (BabA, SabA, OipA, AlpA и др.). В качестве рецепторов адгезинов выступают поверхностные структуры эпителиоцитов желудка – гликопротеины группы Lewisb, богатые фукозой, и гликопротеины, богатые производными сиаловой кислоты.
Факторы персистенции Helicobacter pylori
1. Под персистенцией подразумевается способность популяции микроорганизмов к длительному существованию в условиях динамического равновесия с организмом-хозяином.
2. К факторам персистенции Helicobacter pylori относятся: способность к размножению, способность к формированию биоплёнки, способность к образованию протопластов, способность к проникновению в цитоплазму клеток покровного эпителия желудка.
3. Источником питательных субстратов являются слущенные лизирующиеся клетки столбчатого эпителия и олигопептиды частично переваренной пищи.
4. Бактериальные клетки сформировавшейся популяции Helicobacter pylori синтезируют богатый полисахаридами матрикс, объединяющий их в биоплёнку: структурированное сообщество бактериальных клеток, ведущих согласованное существование, обусловленное возможностью обмена сигнальными метаболитами.
5. Биоплёнка повышает резистентность популяции Helicobacter pylori к бактерицидным факторам желудочного содержимого, фагоцитозу, антителам, антибиотикам.
6. Бактериальные клетки сформировавшейся популяции Helicobacter pylori способны сбрасывать клеточную стенку, чему способствует нерегулярность структуры их пептидогликана.
7. В результате исчезновения наружного скелета, обеспечивающего поддержание палочковидной формы, образуются персистеры – протопласты сферической формы, зачастую не вполне точно именующиеся «кокковидными формами Helicobacter pylori».
8. Персистеры отличаются устойчивостью к фагоцитозу, антителам, антибиотикам; накопление их в популяции способствует её выживанию.
9. В результате адгезии бактериальных клеток Helicobacter pylori к апикальной поверхности эпителиоцитов желудка, характер поведения последних резко меняется: в результате реаранжировки внутреннего скелета, эпителиоцит выпускает псевдоподии и осуществляет фагоцитозоподобный захват бактериальных клеток.
10. Захваченная бактериальная клетка Helicobacter pylori локализуется в цитоплазме эпителиальной клетки в составе квазифагосомы, однако, не подвергается перевариванию вследствие отсутствия у эпителиальной клетки способности к продукции лизосомальных ферментов.
11. В составе квазифагосомы бактериальные клетки Helicobacter pylori защищены от агрессивного воздействия бактерицидных факторов желудочного содержимого, фагоцитоза, антител, антибиотиков.
12. Helicobacter pylori лишён инвазинов, почему процесс проникновения его клеток в цитоплазму эпителиоцитов не является истинной инвазией: бактериальная клетка индуцирует эпителиальную клетку к поведению, свойственному непрофессиональным фагоцитам, осуществляющим незавершённый фагоцитоз, ограничивающийся лишь поглощением, но не перевариванием фагоцитированного объекта.
Рис. 4. Биопленка H. pylori in vitro

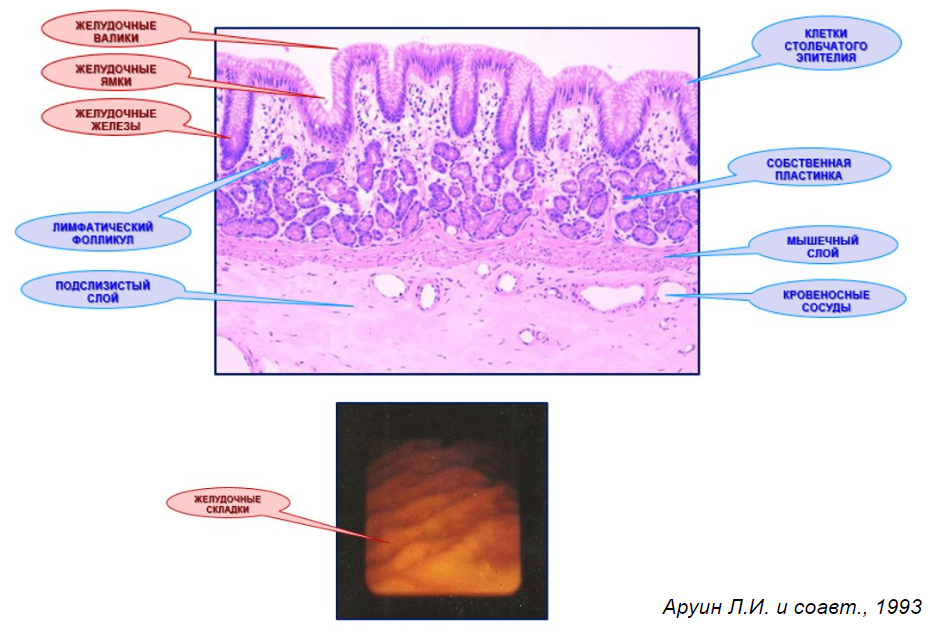
Гистологическая структура слизистой оболочки желудка
Хеликобактериоз – инфекционный процесс, детерминированный H. pylori – разыгрывается в слизистой оболочке желудка.
• Клетки столбчатого эпителия слизистой оболочки желудка покрывают желудочные валики, желудочные ямки, устья, шейки и дно желудочных желез.
• В желудочных железах имеются париетальные клетки, продуцирующие хлористоводородную (соляную) кислоту, а также G- и D-клетки, осуществляющие гормональную регуляцию процесса её секреции.
• Одной из функций клеток столбчатого эпителия желудка является выработка слизи, вязкость которой обусловлена наличием в её составе муцина – гликопротеина, богатого кислыми полисахаридами.
Рис. 5. Эндоскопическая картина желудка
Патогенное воздействие на слизистую оболочку желудка
Проникнув фекально-оральным путём в просвет желудка, бактериальные клетки Helicobacter pylori, благодаря интенсивной локомоции, обеспеченной согласованным вращением жгутикового пучка, направляются к слою слизи, покрывающему пласт клеток столбчатого эпителия желудка.
Направление движения бактериальных клеток Helicobacter pylori задаётся хемокинами, продуцируемыми эпителиальными клетками; в состав белков наружной мембраны бактериальных клеток Helicobacter pylori входят рецепторы к хемокинам.
Защиту бактериальных клеток Helicobacter pylori от сильнокислого содержимого желудка обеспечивает уреаза, катализирующая гидролиз мочевины с образованием гидроксил-иона, нейтрализующего хлористоводородную кислоту и создающего, тем самым, область локального защелачивания в непосредственной близости от бактериальной клетки.
Достигнув поверхности эпителиального пласта, бактериальные клетки Helicobacter pylori адгезируют к их апикальной поверхности благодаря взаимодействию адгезинов и соответствующих им рецепторов.
ЛПС адгезировавших бактериальных клеток Helicobacter pylori активирует систему комплемента по альтернативному пути в непосредственной близости от апикальной поверхности эпителиоцитов, что приводит к перфорации мембран последних и их слущиванию с образованием точечных дефектов эпителиального пласта.
Ионы аммония, образующиеся в результате гидролиза мочевины, оказывают токсическое действие на клетки покровного эпителия, заключающееся, в частности, в блокировании секреции этими клетками желудочной слизи.
Адгезировавшие бактериальные клетки Helicobacter pylori немедленно приступают к размножению с образованием микроколоний.
Часть бактериальных клеток Helicobacter pylori подвергаются трансэпителиальному захвату дендритными клетками.
По мере увеличения числа и численности микроколоний наступает так называемый “quorum sensing” – согласованное поведение бактериальных клеток, заключающееся, в первую очередь, в активации генов синтеза полисахаридной субстанции, объединяющей бактериальные клетки Helicobacter pylori в биоплёнку: функциональный консорциум бактериальных клеток, заключённый в продуцируемый ими экзополимерный матрикс.
Небольшая часть адгезировавших бактериальных клеток Helicobacter pylori (3-5% популяции) подвергается квазифагоцитозу со стороны клеток столбчатого эпителия и оказывается заключённой в квазифагосому, защищающую их от антител и фагоцитоза.
Под действием вакуолизирующего токсина Helicobacter pylori в цитоплазме эпителиоцитов возникают множественные вакуоли с кислым содержимым, что способствует отторжению эпителиальных клеток и возникновению множественных дефектов эпителиального пласта.
Вакуолизирующий токсин также индуцирует выход цитохрома с из митохондрий, что приводит к активации каспаз и индукции апоптоза – запрограммированной гибели эпителиальной клетки, сопровождающейся фрагментацией её ядра и цитоплазмы.
Претерпевшие апоптоз эпителиальные клетки отторгаются, что приводит к возникновению множественных дефектов эпителиального пласта.
Возникновение множественных дефектов эпителиального пласта способствует проникновению бактериальных клеток Helicobacter pylori в подслизистый слой.
Вакуолизирующий токсин также индуцирует выход цитохрома с из митохондрий, что приводит к активации каспаз и индукции апоптоза – запрограммированной гибели эпителиальной клетки, сопровождающейся фрагментацией её ядра и цитоплазмы, отторжением апоптировавших клеток и возникновению множественных дефектов эпителиального пласта.
Пептидогликан бактериальных клеток Helicobacter pylori, проникших в эпителиальную клетку, взаимодействует в качестве паттерна патогенности (РАМР) с цитоплазматическим паттерн-распознающим рецептором врождённого иммунитета (РАР) – нуклеотидсвязывающим олигомеризирующим доменом типа NOD1
Аналогичным образом ЛПС бактериальных клеток Helicobacter pylori, адгезировавших к апикальной поверхности эпителиальной клетки, взаимодействует в качестве паттерна патогенности (РАМР) с Toll- подобным рецептором 4-го типа (TLR4) – мембранным паттерн- распознающим рецептором врождённого иммунитета (РАР).
Рис. 6. Схема патогенетического воздействия H. pylori на слизистую желудка

При инфицировании штаммом Helicobacter pylori типа I, обладающего островом патогенности cagPAI, адгезировавшие к эпителиальным клеткам бактериальные клетки Helicobacter pylori выстраивают “молекулярный шприц” и транслоцируют CagA-белок в цитоплазму эпителиоцита, что способствует реаранжировке цитоскелета эпителиоцитов, приводящей к элонгации их клеток и приобретения ими формы “колибри”, неспособной к поддержанию эпителиального монослоя.
Кроме того, штаммы Helicobacter pylori типа I способны индуцировать более высокий уровень выхода интерлейкина IL-8.
Провоспалительные цитокины – в первую очередь, интерлейкин IL-8 – являются аттрактантами фагоцитирующих клеток – нейтрофилов, моноцитов, макрофагов, а также наивных ТН0-лимфоцитов и В-лимфоцитов.
Проникшие в подслизистый слой бактериальные клетки Helicobacter pylori фагоцитируются нейтрофилами, моноцитами, макрофагами.
Фагоцитоз бактериальных клеток Helicobacter pylori моноцитами и макрофагами стимулирует продукцию ими набора провоспалительных цитокинов: фактора некроза опухоли альфа (TNF), интерлейкинов IL-1, IL-6, IL-12.
Интерлейкины IL-1 и IL-18, взаимодействуя с соответствующими мембранными рецепторами наивных ТН0-лимфоцитов, стимулируют их дифференцировку в лимфоциты ТН1, ТН17, Тreg
ТН1-лимфоциты способствуют интенсификации воспаления благодаря своей способности к выбросу провоспалительных факторов: IL-2, TNF и интерферона гамма IFN.
В начальной фазе воспаления, индуцированного Helicobacter pylori, действие провоспалительных факторов (TNF, IFN, IL-1, IL-2, IL-6, IL-12, IL-17, IL-18) существенно преобладает над действием противовоспалительного (IL-10).
В результате сформировавшейся трёхклеточной кооперации (антигенпрезентирующая клетка – ТН1-лимфоцит – В-лимфоцит) В-лимфоциты трансформируются в бластные клетки, продуцирующие иммуноглобулины классов IgM, IgG, IgA, IgE – антитела к антигенам Helicobacter pylori.
Противохеликобактерные иммуноглобулины всех четырёх классов локализуются в собственной пластинке слизистой оболочки желудка, а также всасываются в лимфатическую и, далее, в кровеносную систему.
Провоспалительная фаза воспалительного процесса сменяется противовоспалительной, характеризующейся как снижением числа фагоцитирующих клеток, так и угнетением функции презентации антигена, что неизбежно приводит к снижению уровня продукции противохеликобактерных антител.
В сложившихся условиях несомненно имеющий место иммунный ответ оказывается непротективным: популяция Helicobacter pylori вступает в состояние динамического равновесия с иммунной системой хозяина.
В состоянии динамического равновесия с популяцией Helicobacter pylori уровень продукции иммунной системой противохеликобактерных антител оказывается недостаточным для самопроизвольной эрадикации популяции Helicobacter pylori.
Таким образом, воспалительный процесс, индуцированный Helicobacter pylori – хеликобактериоз – приобретает хронический характер.
Попытки нервной и эндокринной систем усилить провоспалительную составляющую хеликобактериоза также оказываются несостоятельными, и хронический воспалительный процесс манифестируется в форме хронического активного гастрита (К29 по МКБ-10).
Антитела к антигенам Helicobacter pylori способны перекрёстно взаимодействовать с антигенами мембран апикальных поверхностей клеток покровного столбчатого эпителия слизистой оболочки желудка и париетальных клеток желез желудка, что приводит к атрофическим изменениям этих клеток и, в конечном счёте, атрофии эпителия слизистой оболочки желудка той или иной степени выраженности.
Хронический гастрит развивается у 100% лиц, инфицированных Helicobacter pylori.
Язвенная болезнь (К25; К26 по МКБ-10) развивается у 10% лиц, инфицированных Helicobacter pylori.
Дистальная (некардиальная) аденокарцинома желудка (С16 по МКБ-10) развивается у 1% лиц, инфицированных Helicobacter pylori.
Частота обнаружения MALT-лимфомы желудка (С83.8 по МКБ-10) составляет 5% от общего числа раков желудка.
Хронический гастрит с одинаковой частотой ассоциируется со штаммами Helicobacter pylori как I, так и II типа.
С язвенной болезнью, дистальной (некардиальной) аденокарциномой и MALT-лимфомой желудка статистически достоверно чаще ассоциируются штаммы Helicobacter pylori I типа – обладающие островом патогенности cagPAI.
Несомненную роль в формировании язвенного дефекта играет вакуолизирующий токсин VacA, манифестация повреждающего действия которого на слизистую оболочку желудка обусловливается состоянием микроциркуляторного русла желудка.
Весьма важной остаётся роль активных форм кислорода, генерируемых как самими бактериальными клетками Helicobacter pylori, так и нейтрофилами, эти бактериальные клетки фагоцитировавшими: в результате их повреждающего действия, в ДНК эпителиоцитов возникают повреждения, приводящие к малигнизации.
Наконец, в роли онкопротеина выступает CagA-белок Helicobacter pylori, обладающий высокой способностью к тирозин-фосфорилированию киназами различного типа, содержащимися в цитоплазме эпителиальных клеток.
Рис. 7. Канцерогенез, ассоциированный с H. pylori

27.09.2023 | 17:16:17