Гиперплазия гипофиза. Причины, синдромология. Псевдогиперплазия.
Раздел: Статьи
/
Общая врачебная практика.
/
Эндокринология.
/
Гиперплазия гипофиза. Причины, синдромология. Псевдогиперплазия.
Содержание
- Общее понятие о гиперплазии аденогипофиза
- Физиологическая гиперплазия
- Патологическая гиперплазия аденогипофиза при поражении органов-мишеней
- Гиперплазия гипофиза при эктопической гиперпродукции рилизинг-факторов или пострецепторной активации в клетках аденогипофиза при редких генетических синдромах
- Псевдогиперплазия
- Заключение
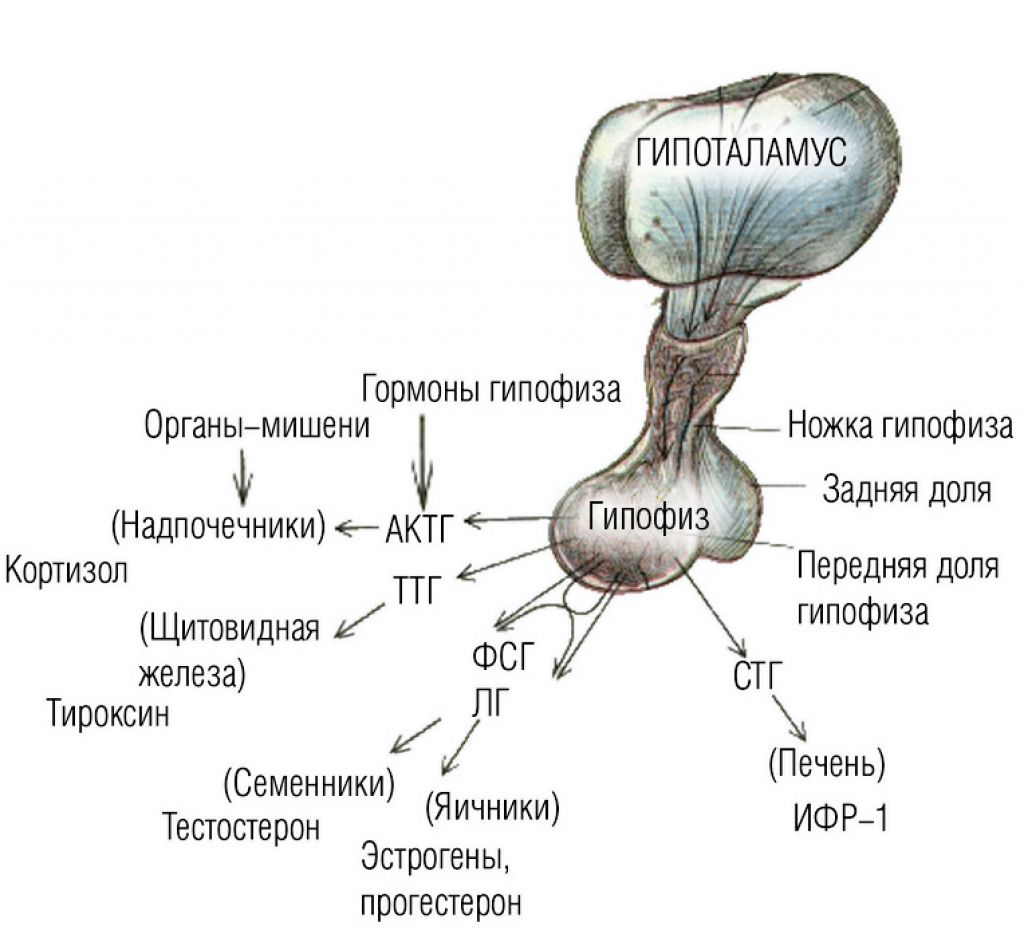
Гиперплазия гипофиза — это абсолютное увеличение числа одного или нескольких подтипов клеток аденогипофиза. Гистологически факт гиперплазии подтверждается обнаружением полиморфной клеточной популяции, при этом использование дополнительного импрегнации препарата серебром позволяет выявить сохраненную нормальную аргириновую ретикулярную сеть гипофиза.
Возникает вопрос, когда, собственно, к морфологу попадает полностью аденогипофиз, структура которого гиперплазирована. Очевидно, что биопсия малоинформативна из-за клеточных вариаций ткани аденогипофиза, да и вряд ли фрагмент, полученный в анатомических сложных условиях, полностью отражает структуру аденогипофиза. Оперативное же вмешательство проводится либо вследствие ошибки диагностики, когда гиперплазия принимается за опухоль, либо в связи с необходимостью срочной декомпрессии хиазмы или осложнившейся апоплексией гиперплазии, либо (чаще при гиперкортизолизме в прошлом) предпринималось при отсутствии выявляемой опухоли. Эти данные, как и данные аутопсий, несомненно, подтверждают, что клеточная гиперплазия из различных аденогипофизарных клеток существует и может быть причиной гиперпродукции гипофизарных тропных гормонов.
Представление о «нормальных» размерах было построено на данных небольшого количества наблюдений, и вначале предполагалось, что гиперплазия — явление редкое. Установлено при оценке МРТ 1200 пациентов без каких бы то ни было признаков эндокринопатий, что вертикальный размер гипофиза у женщин в среднем больше, чем у мужчин (5,35 мм vs 4,93 мм) с максимумом в 20–29 лет (женщины 6,48 мм, мужчины 5,63 мм), снижается с годами, за исключением периода менопаузы (50–59 лет) у женщин (5,44 мм), и только у одного из 1200 обследованных вертикальный размер гипофиза составлял >9 мм в 20–29 лет и >8 мм в более старшем возрасте. Превышение этого отрезного параметра может указывать на патологию.
То есть гиперплазия гипофиза — это симптомокомплекс неопухолевого увеличения аденогипофиза в силу различных физиологических или патологических обстоятельств, проявляющегося радиологически как превышение нормального объема гипофиза, с видимым на МРТ диффузным и симметричным увеличением, с выбуханием верхнего контура, изоинтенсивным серому веществу мозга и гомогенным захватом гадолиниума.
Гиперплазию от аденомы отличают два опорных момента.
1. Преоперативно: МРТ гиперплазированного гипофиза практически всегда выявляет симметричное увеличение всего гипофиза, в отличие от аденомы, которая в громадном большинстве случаев латерализована и/или инфильтрирует один или оба кавернозных синуса. Более того, аденомы, как правило, гиповаскулярны, в то время как ткань гипофиза (нормального или гиперплазированного) гиперваскулярна. Как результат, МРТ с контрастом в случае аденомы показывает гипоинтенсивную массу с прилегающими по периферии очагами или даже «рамкой» нормального гипофиза. Гиперплазия же представлена диффузно и симметрично гиперинтенсивным гипофизом, без дифференциально контрастированных участков нормального гипофиза.
2. Постоперативно: гипофиз — это железистая ткань с ацинарной структурой. Поэтому при гиперплазии ретикулиновые волокна, окружающие увеличенные островки секреторных клеток, нормальны и ацинарная структура сохранена. В отличие от этого, ретикулиновые волокна в ткани аденом беспорядочны, фрагментированы и разорваны.
Несомненно, радиологический диагноз гиперплазии намного более предпочтителен, так как он может сделать хирургическое вмешательство ненужным. В отдельных случаях, как, например, акромегалия, вызванная эктопической секрецией соматолиберина, визуализация гиперплазии соматотрофов может стать решающим фактором, определяющим дальнейшее ведение больного.
Спонтанное течение гиперплазии доброкачественное, и процесс регрессирует либо самостоятельно, либо (при поражении органов-мишеней) на фоне адекватной заместительной терапии.
Можно выделить три варианта гиперплазии аденогипофиза.
1. Физиологическая гиперплазия — при беременности, в постменопаузе, в пубертате.
2. Патологическая гиперплазия, развившаяся вследствие:
o ортотопической гиперпродукции гипоталамических рилизинг-факторов в ответ на поражение органов-мишеней;
o эктопической гиперпродукции рилизинг-факторов нейроэндокринными опухолями;
o активации пострецепторного сигналинга рилизинг-факторов при генетических нарушениях (активирующие соматические мутации в гене GNAS, инактивирующие мутации в гене PRKAR1A, дупликация гена GPR101).
3. Псевдогиперплазия вследствие:
o гиперплазии эмбриональных недифференцированных клеток с их последующим апоптозом при мутации в гене PROP1;
o лимфоидной инфильтрации при гипофизите.
Как физиологическая, так и патологическая гиперплазия гипофиза протекает с повышенной секрецией тропных гормонов, в отличие от псевдогиперплазии (см. ниже), когда увеличение размеров происходит не за счет гиперплазии гормон-секретирующих клеток аденогипофиза.
В физиологических условиях гиперплазия гипофиза бывает у подростков с их бурной активацией работы аденогипофиза и чрезмерным вниманем к кажущемуся дисгармоничным половому созреванию, особенно если исследованные в эту пору «все гормоны на всякий случай» имеют отклонения от референса или (чаще) если обследуется высокорослый подросток и МРТ входит в число исследований «на всякий случай», выявленная при этом гиперплазия становится источником тяжелых эмоциональных переживаний.
Механизм ее формирования понятен — пубертатная активная продукция половых гормонов и гормона роста приводит к увеличению числа гонадо- и соматотрофов гипофиза. При проведении МРТ 169 пациентам в возрасте до 30 лет без эндокринной патологии было показано, что в группе до 12 лет высота гипофиза не превышала 6 мм, тогда как в группе подростков 11–20 лет размер гипофиза увеличивался (у 12% девочек он составлял 8–10 мм, тогда как у мальчиков не превышал 7 мм), 56% девочек-подростков имели выпуклую верхнюю часть гипофиза, а у 25% гипофиз имел сферическую форму, после завершения пубертата (у молодых взрослых 21–30 лет) размеры гипофиза были статистически значимо меньше.
Несмотря на свою «физиологичность», гиперплазия гипофиза у подростков, особенно с неглубоким турецким седлом, может сопровождаться нарушением зрительных функций (битемпоральной гемианопсией) и особенно на фоне усиленных физических упражнений может сочетаться с апоплексией в гипофиз. Обычно гиперплазия регрессирует спонтанно, но при сочетании с апоплексией требуется ургентная трансфеноидальная декомпрессия хиазмы.
Относительно физиологичным можно считать увеличение гипофиза у детей с идиопатическим гонадотропин-зависимым преждевременным половым развитием. Гиперплазия гипофиза у детей с преждевременным половым развитием объясняется ранней активацией системы гипоталамус-гипофиз-гонады и увеличением пула гонадотрофов и частично соматотрофов гипофиза, по аналогии с истинным пубертатом. Размеры гипофиза также увеличиваются до пубертатных показателей, но интересно, что на фоне терапии пролонгированными аналогами гонадотропин-рилизинг-гормона, когда происходит подавление синтеза гонадотропинов и регресс вторичных половых признаков, размеры гипофиза не уменьшаются до прежних значений.
У беременных гиперплазия достигается в основном за счет лакторофов, которые вне беременности составляют 10–30% аденогипофизарных клеток, но их число возрастает до 70% в беременность. Эта гиперплазия не полностью обратима, и у многорожавших гипофиз больше, чем у нерожавших. Гестационная гиперплазия лактотрофов, вероятно, происходит за счет превращения плюрипотентных клеток в лактотрофы или трансдифференцировки других клеток, чаще соматотрофов.
На МРТ 78 беременных показано прогрессирующее увеличение вертикального размера гипофиза, достигающего максимума после родов (ср. 8,76 мм, максимум 10,2 мм) с нормализацией через 2–6 мес, по другим данным, с максимумом 10,0 мм в беременность и 11,8 мм после родов.
Согласно результатам ряда исследований, с возрастом отмечается уменьшение вертикального размера гипофиза, начиная с 30 лет, но у женщин, в отличие от мужчин, обращает на себя внимание временное увеличение размеров гипофиза в возрастной группе 50–59 лет, что совпадает с повышением концентрации гонадотропинов в менопаузальный период и, вероятно, объясняется гиперплазией гонадотрофов.
Гиперплазия тиреоцитов — не единственный пример гиперплазии клеток аденогипофиза, развивающейся по механизму обратной связи под влиянием избытка либеринов вследствие нехватки периферических гормонов. В литературе описаны варианты патологической гиперплазии гипофиза на фоне первичного гипогонадизма любой этиологии: синдроме Кляйнфельтера, преждевременной овариальной недостаточности, синдроме Тернера или гонадэктомии по поводу рак.
Описаны и случаи гиперплазии гипофиза при первичном гипокортицизме. Однако, в отличие от гиперплазии гипофиза при гипотиреозе, которая бывает больших размеров и часто выявляется на МРТ, при гипогонадизме и гипокортицизме гиперплазия выявляется в основном по результатам гистологического исследования и редко визуализируется при проведении МРТ.
E. Horvath и соавт. в 1999 г., суммируя более чем 25-летний опыт оценки образцов аденогипофиза, удаленных при оперативных вмешательствах, отмечают, что все типы клеток могут быть вовлечены в процесс, но частота их вовлечения различна.
• Пролактотрофы обладают наиболее высокой способностью к неопухолевой гиперплазии, что проявляется во время беременности и лактации. Интересно, что в допубертатном возрасте размеры гипофиза у мальчиков даже несколько больше, чем у девочек, тогда как начиная с пубертата высота гипофиза у женщин превышает этот показатель у мужчин. Большие размеры гипофиза у девочек могут отражать гиперплазию гипофиза и развитие аденом на фоне высоких доз эстрогенов. Патологическая гиперплазия лактотрофов может развиваться за счет потери гипоталамической дофаминергической регуляции при повреждении гипофизарного стебля или ятрогенным образом при приеме психотропных препаратов — антагонистов дофамина. Нокаутированные мыши, лишенные дофаминовых рецепторов (DRD2), демонстрируют гиперплазию лактотрофов, а в итоге — развитие пролактиномы.
• Основным механизмом гиперплазии гипофиза за счет тиреотрофов является реализация механизма отрицательной обратной связи. Это подтверждается опытами на мышах, которые демонстрируют при некомпенсированном первичном гипотиреозе выраженную гиперплазию гипофиза. Гиперплазия из тиреотрофов, абсолютно курабельная форма, не должна становиться предметом нейрохирургического вмешательства, но некоторые подобные случаи идентифицированы вследствие ошибочно проведенного вмешательства из-за большого объемного образования, имитирующего ТТГ- или пролактинпродуцирующую аденому. Эта гиперплазия сочетается нередко с гиперплазией пролактотрофов, поскольку тиролиберин стимулирует гиперплазию обеих клеточных линий.
• В отличие от гиперплазии тиреотрофов, развитие гиперплазии кортикотрофов на фоне некомпенсированной первичной надпочечниковой недостаточности описано в единичных случаях. Это объясняется длительностью существования гипотиреоза, тогда как отсутствие терапии при надпочечниковой недостаточности быстро приводит к фатальному исходу. Но это не может быть единственной причиной, поскольку пациенты с изолированным дефицитом глюкокортикоидов, которые длительное время могут находиться без терапии и иметь экстремально высокие показатели АКТГ (синдром резистентности к АКТГ или вирильная форма врожденной дисфункции коры надпочечников), не демонстрируют гиперплазии гипофиза по данным МРТ. Возможно, особенности регуляции системы гипоталамус–гипофиз–надпочечники, участвующей в реакции на стресс, когда уровень АКТГ должен периодически повышаться в ответ на неблагоприятные факторы, не приводят к выраженной гиперплазии кортикотрофов.
• За счет гиперплазии гонадотрофов происходит увеличение гипофиза в пубертатном возрасте и в период менопаузы у женщин. В пубертатный период гиперплазия развивается за счет все возрастающей частоты и амплитуды импульсной секреции гонадотропин-рилизинг-гормона. Одновременно в пубертатный период происходит и гиперплазия соматотрофов под действием половых стероидов, в первую очередь эстрогенов. В период наступления менопаузы у женщин происходит небольшое увеличение размеров гипофиза с последующим обратным развитием через 5–6 лет. Существует гипотеза, что увеличение аденом гипофиза с возрастом, особенно у женщин, может быть связано с гиперплазией гонадотрофных клеток и последующим включением механизмов многоступенчатого онкогенеза. За счет реализации механизма отрицательной обратной связи происходит гиперплазия клеток, продуцирующих ЛГ и ФСГ при первичной гонадной недостаточности, как врожденной, так и приобретенной.
• Механизм отрицательной обратной связи не вызывает гиперплазию соматотрофов при синдроме Ларона (резистентность к гормону роста). Описание гиперплазии гипофиза за счет соматотрофных клеток, продуцирующих гормон роста, встречается редко, и механизм гиперплазии в данном случае связан либо с эктопической секрецией опухолями соматолиберина (рилизинг-гормона ГР), либо, что чаще, с генетически обусловленными нарушениями пострецепторного сигналинга рецептора к соматолиберину.
Соматолиберин — рилизинг ГР участвует в дифференцировке и пролиферации соматотрофов и является стимулом для секреции гормона роста. Соматолиберин соединяется с G-протеин-связанным рецептором на мембране соматотрофов, запуская внутриклеточный каскад реакций, где участниками передачи сигнала от рецептора в ядро является Gsα, активация которой приводит к накоплению цАМФ, что в свою очередь активирует протеинкиназу А, которая перемещается в ядро и фосфорилирует CREB, который и усиливает транскрипцию ГР и пролиферацию соматотрофов.
Синдром МакКьюна–Олбрайта–Брайцева обусловлен активирующими постзиготными мутациями в гене GNAS, кодирующем α-субъединицу G-белка. Таким образом, в отсутствие стимулирующего сигнала соматолиберина происходит постоянная активация внутриклеточной передачи сигнала, что приводит к гиперпродукции гормона роста и гиперплазии соматотрофных клеток гипофиза. Классической клинической триадой синдрома МакКьюна–Олбрайта–Брайцева являются кожные проявления в виде пятен цвета кофе с молоком с неровными «географическими» контурами, фиброзно-кистозная гиперплазия костей и преждевременное гонадотропин-независимое половое развитие в основном у девочек вследствие эстрогенпродуцирующих кист яичников. Помимо основных клинических симптомов, для данного заболевания характерны также токсический многоузловой зоб, гипофосфатемический рахит, тахикардия и автономная гиперсекреция гормона роста и пролактина на фоне гиперплазии гипофиза, редко с образованием аденом гипофиза. На сегодняшний день самая большая группа пациентов с синдромом МакКьюна–Олбрайта–Брайцева описана в Национальном институте здоровья (США), она включает 140 пациентов, и автономная гиперпродукция гормона роста выявлена у 21% пациентов. В ФГБУ НМИЦ эндокринологии база пациентов с данным синдромом насчитывает 85 человек, у 18 (22%) выявлена гиперсекреция гормона роста, а у 5 из них имеется аденома гипофиза. Особенностью гиперсекреции гормона роста при синдроме МакКьюна–Олбрайта–Брайцева является хороший ответ на терапию пролонгированными аналогами соматостатина.
Другим наследственным синдромом, при котором развивается автономная гиперпродукция гормона роста на фоне гиперплазии гипофиза, является Карни-комплекс. Данное заболевание обусловлено инактивирующими герминативными мутациями в гене PRKAR1α, кодирующим регуляторную субъединицу протеинкиназы А, что приводит к повышенной активности протеинкиназы А в отсутствие стимулирующего действия соматолиберина. Компонентами Карни-комплекса являются миксомы сердца, кожный лентигиноз, пигментная микроузелковая гиперплазия надпочечников, Сертоли-клеточные опухоли яичек, карцинома щитовидной и молочных желез и гиперсекреция гормона роста на фоне гиперплазии и аденомы гипофиза. Гиперпродукция гормона роста встречается в 80% случаев среди пациентов с Карни-комплексом, тогда как соматотропиномы выявляются только у 15% пациентов. Интересно, что как при синдроме МакКьюна–Олбрайта–Брайцева, так и при Карни-комплексе течение акромегалии мягкое, при длительном существовании высокого уровня ИФР1 и отсутствии подавления СТГ при нагрузке глюкозой клинические проявления гигантизма и акромегалии могут отсутствовать. Другой общей чертой двух этих генетических синдромов является редкое развитие аденом на фоне гиперплазии соматотрофов, хотя описаны мультифокальные аденомы гипофиза. Гистологическая картина удаленных аденом демонстрирует обязательную гиперплазию клеток, экспрессирующих гормон роста и пролактин, вокруг удаленных опухолей. Видимо, гиперплазия соматотрофов предшествует развитию аденом гипофиза при Карни-комплексе и синдроме МакКьюна–Олбрайта–Брайцева, в отличие от синдрома МЭН1 (синдрома множественных эндокринных неоплазий 1-го типа), при котором по результатам гистологического исследования отсутствует гиперплазия окружающей аденому ткани аденогипофиза, но выявляется гиперплазия и аденомы паращитовидных желез или гиперплазия и опухоли островковых клеток поджелудочной железы. Генетические изменения, необходимые для образования аденомы на фоне доброкачественной гиперплазии, неизвестны, но, по-видимому, они множественные. Согласно гипотезе «двойного удара» Кнудсена первичным поражением являются мутации в генах GNAS или PRKAR1, что вызывает гиперплазию соматотрофов, а для возникновения опухоли требуется «второй удар» в виде потери гетерозиготности или других факторов.
Помимо редких генетических вариантов активации передачи сигнала от рецептора соматолиберина, гиперплазию соматотрофов вызывает эктопическая гиперсекреция самого соматолиберина нейроэндокринной опухолью. По данным литературы, менее 1% всех случаев акромегалии обусловлено эктопической секрецией рилизинга ГР. В большой выборке пациентов с эктопической акромегалией из 99 пациентов чаще всего выявлялся карциноид легких (51,5%) и нейроэндокринные опухоли (НЭО) поджелудочной железы (34,5%), также встречались НЭО желудочно-кишечного тракта (7%), тимуса (2%), надпочечников (2%), гипофиза (1%), средостенья (1%). Заподозрить и подтвердить эктопическую акромегалию крайне сложно, поскольку клиническая и лабораторная картина при эктопической продукции соматолиберина не отличается от классической соматотропиномы.
Ключевым моментом в дифференциальной диагностике является МРТ гипофиза, где выявляется диффузная гиперплазия или отсутствие патологических изменений при эктопическом варианте акромегалии. Однако отличить гиперплазию от аденомы иногда затруднительно, и до 25% пациентов перенесли хирургическое лечение на гипофизе до установления эктопической секреции соматолиберина. Наиболее информативным методом визуализации опухоли, секретирующей рилизинг ГР, на сегодняшний день можно считать ПЭТ для выявления соматостатиновых рецепторов (Ga68 DOTATATE). Резюмируя, можно сказать, что поводом подозревать эктопический вариант акромегалии является отсутствие визуализации аденомы гипофиза или наличие внегипофизарной опухоли (легкие, поджелудочная железа, тимус, надпочечники) у пациента с акромегалией, а для подтверждающей диагностики целесообразно использовать ПЭТ/КТ Ga68 DOTATATE.
Аналогичный механизм вызывает гиперплазию гипофиза у пациентов с эктопической секрецией кортикотропин-рилизинг-гормона (КРГ) за счет стимуляции кортикотрофов. Гиперкортицизм, обусловленный секрецией КРГ нейроэндокринной опухолью, вызывает много сложностей в диагностике, поскольку у части пациентов отмечается гиперплазия гипофиза, что приводит к ошибочному диагнозу — кортикотропиномы и необоснованному хирургическому лечению. Так, Karageorgiadis A.S. и соавт. описали 7 случаев АКТГ-зависимого гиперкортицизма вследствие эктопической секреции АКТГ/КРГ у детей, которые были выявлены в National Institutes of Health [(NIH) — национальный институт здоровья США] за 20 лет. Среди этих семи пациентов трое подверглись необоснованному транссфеноидальному хирургическому вмешательству по причине гиперплазии гипофиза, выявленной по данным МРТ у двух пациентов или результатам селективного забора крови из каменистых синусов. Интересно, что все семь нейроэндокринных опухолей (локализация: поджелудочная железа, тимус, бронхи и печень) при иммуногистохимическом исследовании давали положительное окрашивание как на КРГ, так и на АКТГ. Одному из пациентов была проведена повторная МРТ головного мозга через некоторое время после удаления нейроэндокринной опухоли тимуса и было отмечено уменьшение размеров гипофиза. Среди всех вариантов гиперкортицизма эктопическая продукция КРГ является самым редким вариантом, вызывающим самые большие сложности в диагностике и поиске источника секреции КРГ. В литературе описаны нейроэндокринные опухоли, секретирующие КРГ или КРГ/АКТГ, локализующиеся в легких, тимусе, поджелудочной железе, печени, а также имеются описания КРГ-секретирующих феохромоцитом, интраселлярных ганглиоцитом и даже единичные случаи саркомы Юинга.
В отличие от истинной гиперплазии гипофиза, как физиологической, так и патологической, которые протекают с повышенной секрецией тех или иных гормонов аденогипофиза, при псевдогиперплазии гиперсекреции тропных гормонов не происходит. Псевдогиперплазия гипофиза может быть результатом лимфоидной инфильтрации гипофиза при различных вариантах гипофизита, что проявляется, наоборот, выпадением функции, чаще всего несахарным диабетом, иногда в сочетании с гипопитуитаризмом.
Гиперплазия гипофиза была выявлена у пациентов с врожденным гипопитуитаризмом вследствие мутаций в гене PROP. Ген PROP является одним из ключевых факторов эмбриональной дифференцировки клеток аденогипофиза. Гиперплазию гипофиза при патологии гена PROP связывают с гиперплазией и кистозной дегенерацией недифференцированных эмбриональных клеток аденогипофиза. Инактивирующие мутации в гене PROP — один из самых частых вариантов врожденного гипопитуитаризма в Восточной Европе. При анализе МРТ у 52 пациентов с гипопитуитаризмом вследствие дефектов гена PROP было отмечено, что гиперплазия выявляется в 27% случаев. Отмечено, что размеры гипофиза у пациентов с дефектом PROP меняются на протяжении жизни с максимальным увеличением в период пубертата и с исходом в гипоплазию в старшем возрасте. Проведение генетического тестирования у пациентов с гиперплазией гипофиза и клинической картиной врожденного гипопитуитаризма позволит избежать ненужных хирургических вмешательств.
С широким внедрением МРТ в практическую медицину врачи могут столкнуться со случайной находкой в виде гиперплазии гипофиза, что требует дальнейшей интерпретации и определения тактики. Учитывая разнообразие причин, вызывающих гиперплазию гипофиза, необходима комплексная оценка клинической картины. Нужно помнить о физиологических причинах гиперплазии; оценка возраста, стадии полового развития, акушерского анамнеза позволят избежать дополнительных обследований пациента. В то же время оценка клинической картины и проведение гормонального обследования необходимо для выявления первичного гипотиреоза или первичного гипогонадизма. Проведение функциональных проб на выявление автономной продукции СТГ может служить ключевой точкой к постановке диагноза синдромов генетической предрасположенности к опухолевым заболеваниям (Карни-комплекс, синдром МакКьюна–Олбрайта–Брайцева) и определять тактику ведения пациентов. Выявление гиперплазии гипофиза у пациентов с клиническими проявлениями гипопитуитаризма и несахарного диабета определяет дальнейший диагностический поиск и подходы к терапии.
09.10.2022 | 21:03:54