Атрофические рубцы. Лечение атрофических рубцов.
Раздел: Статьи
/
Общая врачебная практика.
/
Дерматовенерология.
/
Атрофические рубцы. Лечение атрофических рубцов.
Содержание
Пилинг и криотерапия
Криотерапия
Малоинвазивные методы лечения атрофических рубцов
- Контурная инъекционная пластика
- Аутотрансплантация жировой ткани
- Мезотерапия
- Терапия аутологичной плазмой с тромбоцитами
Аппаратные методы дермабразия
- Радиочастотная микроигольчатая терапия
- Терапия интенсивным импульсным (широкополосным) светом
- Форез лекарственных препаратов
- Микротоковая терапия
Лазерная терапия атрофических рубцов
Хирургические методы лечения атрофических рубцов
Топическая терапия при атрофических рубцах проводится с использованием препаратов, влияющих на активность фибробластов, улучшающих трофику тканей. По мнению авторов, в виде монотерапии наружные средства либо слабо эффективны, либо вообще не эффективны.
Из топических средств наибольшим эффектом обладают пилинги.
Химический пилинг - отшелушивание поверхностных слоев кожи с помощью кератолитических средств. При атрофических рубцах наиболее показаны срединные пилинги (табл. 4.1).

При проведении пилинга необходимо соблюдать правила пред- и постпроцедурного ухода. В предпроцедурный период (за 1 нед до пилинга) необходимо исключить прием фотосенсибилизирующих препаратов (продуктов), рекомендуется подготовка кожи к пилингу (для срединного или глубокого) с использованием 4% бензол-1,4-диола (Гидрохинона*) или гликолевой кислоты за 1 мес до процедуры. Пациентам с частыми обострениями герпесвирусной инфекции назначаются противовирусные препараты по схеме терапии рецидива за 3 дня до процедуры и 3 дня после либо по схеме супрессивной терапии однократно в день процедуры (табл. 4.2.).
Постпроцедурный период: в раннем постпроцедурном периоде использование реэпителизирующих топических средств (с окклюзионным эффектом для уменьшения трансэпидермальной потери воды) обязательна фотозащита с SPF (sun protection factor - фактор защиты от солнца) не менее 30+ (на период до 6 мес). Также необходимо исключить применение уходовой косметики, которой обычно пользовался пациент, на срок до 1 мес.
Рекомендованная техника криовоздействия:
• используется жидкий азот - 195,8 °С с помощью аппликатора или струи;
• время воздействия 10 с - 2 мин, цикл оттаивания 15-20 с, 8-10 процедур с интервалом 3 нед;
• противопоказана при криоглобулинемии, сахарном диабете;
• можно использовать у пациентов, инфицированных вирусом иммунодефицита человека;
• побочные эффекты включают болезненность во время процедуры, гиперпигментацию, умеренную атрофию, появление пузырей с заживлением под струпом.
Показания: гипертрофические и атрофические рубцы различной этиологии, стрии.
Контурная инъекционная пластика
Инъекционные имплантаты (препараты для контурной и объемной пластики мягких тканей, или филлеры) используются для восполнения дефицита объема тканей при атрофических рубцах. Преимущественно используются две методики: введение филлера в подлежащие рубцу ткани (например, при стриях) и введение филера после предварительного подсечения подлежащих тканей (рубцы постакне, посттравматические рубцы) (рис. 4.1, 4.2).
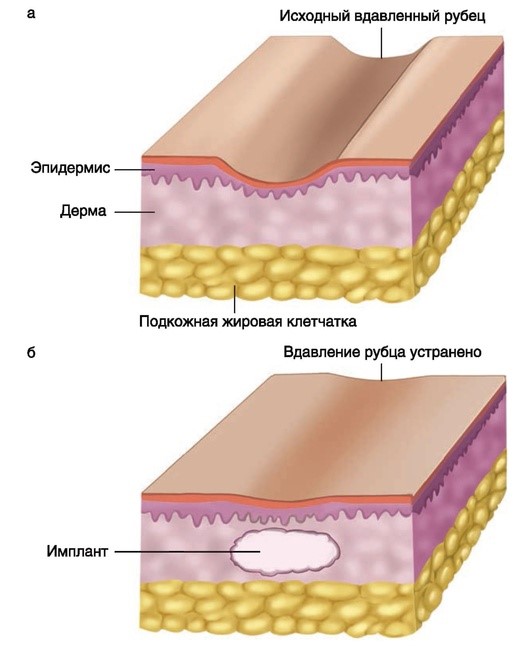
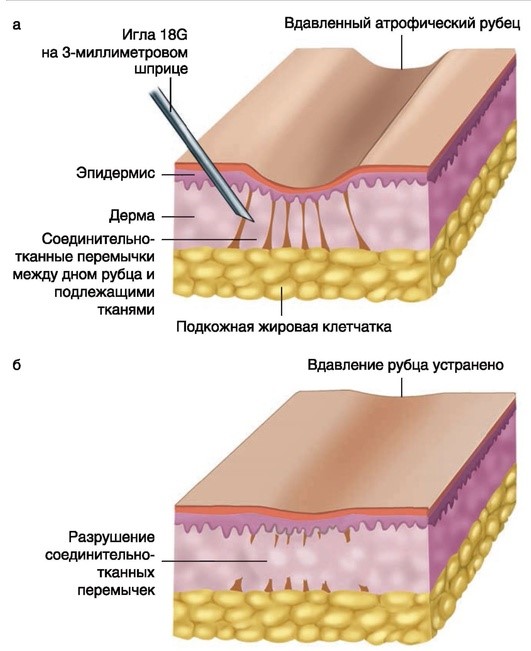
Рис. 4.2. Введение филлера после подсечения рубцово-измененной кожи при атрофических рубцах. а - вдавленный атрофический рубец; б - вдавление устранено
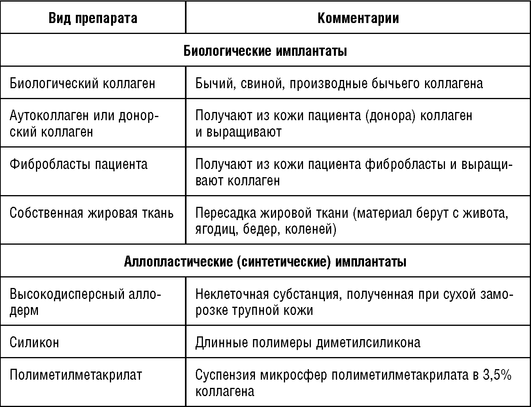
Для контурной инъекционной пластики существует два основных вида филлеров: биологические и синтетические (табл. 4.3).
Методика введения имплантата: в складку кожи вводится игла под углом 45° и ретроградно (при извлечении иглы) вводится препарат. Введение препарата продолжается до полного выравнивания рубца с окружающей тканью.
Суть второй методики заключается в подсечении рубцово-измененной кожи над подлежащими тканями в пределах устраняемой рубцовой деформации, формировании внутритканевой полости и заполнения ее инъекционными имплантатами.
Синтетический коллаген вводится иглой 30G, эффект сохраняется 3-18 мес. Данная процедура может осложняться аллергической реакцией замедленного типа. При использовании человеческого коллагена аллергические реакции встречаются реже, но и эффект более краткосрочный. Возможно использовать гиалуроновую кислоту, эффект при этом сохраняется до 8 мес.
Более длительно сохраняется эффект от имплантатов, в состав которых входят активные вещества, стимулирующие образование коллагена. Такие имплантаты вводятся небольшими порциями в глубокие слои дермы. К данным имплантатам относятся суспензия микросфер полиметилметакрилата с частично денатурированным бычьим коллагеном, изомер молочной кислоты, гидроксиапатит кальция, силикон.
Аутотрансплантация жировой ткани
Имплантация жировой ткани требует не только специального оборудования, но и навыков выполнения процедуры. В среднем 50% имплантатов аутологичной жировой ткани рассасываются через 1 год. Техника: проводится забор жировой ткани (живот, ягодицы, бедро, колено), очищается от примесей крови и вводится в область рубца с помощью 16-18G иглы ретроградным способом до полного выравнивания рубца с окружающей тканью. Повторный курс проводится через 6-12 нед.
Мезотерапия
Мезотерапия атрофических рубцов используется, как правило, в составе терапевтического комплекса с аппаратными методами. Для мезотерапии используются витаминные, улучшающие микроциркуляцию и трофику тканей биологически активные препараты, гиалуроновая кислота.
Наиболее часто используются препараты на основе гиалуроновой кислоты (2 протокола коррекции для лица):
• 3 процедуры по 1 мл с интервалом 3-4 нед;
• 2 процедуры 2 и 1 мл с интервалом 4 нед.
Введение скинбустеров хорошо сочетается с аппаратными методами (лазерная терапия, RF-терапия) и может проводиться с использованием различных техник (рис. 4.3).
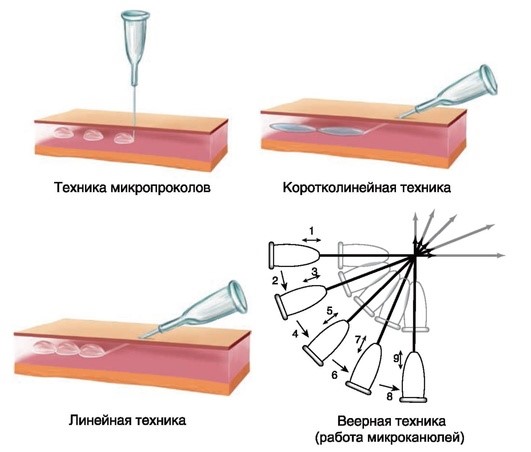
Рис. 4.3. Техники введения скинбустеров при атрофических рубцах
Терапия аутологичной плазмой с тромбоцитами
Наиболее эффективной методикой коррекции атрофических рубцов является терапия аутологичной плазмой с тромбоцитами - PRP-терапия (Platelet Rich Plasma), в основе которой лежит применение препаратов аутологичной плазмы с тромбоцитами, полученной из цельной крови пациента. Группа препаратов для терапии аутологичной плазмой с тромбоцитами остается качественно неоднородной, так как существуют различные способы их получения, имеющие не только общие ключевые технологические моменты (забор крови, использование антикоагулянта, центрифугирование крови, активация тромбоцитов), но и специфические для каждого типа препарата аутологичной плазмы с тромбоцитами (PRP) особенности самой технологии.
Различия в способах забора крови, режимах центрифугирования, методах активации тромбоцитов, в соотношении факторов активации, дополнительных компонентах в составе получаемого препарата и результирующей концентрации тромбоцитов имеют решающее значение, определяя свойства конечного продукта и механизмы его действия.
Использовать для лечебных целей можно только изделия медицинского назначения (пробирки и специальные наборы), зарегистрированные в Российской Федерации для проведения процедур. Использование медицинских изделий (пробирок), зарегистрированных для диагностических манипуляций с кровью, незаконно и чревато высоким риском побочных реакций при низкой эффективности.
Согласно современной международной классификации, существуют 4 основных класса препаратов для терапии аутологичной плазмой с тромбоцитами (PRP), которые отличаются по способу приготовления, составу и области практического применения:
• чистая обогащенная тромбоцитами плазма крови (в англоязычной литературе используется аббревиатура P-PRP - Pure Platelet-Rich Plasma);
• обогащенная лейкоцитами и тромбоцитами плазма крови (в англоязычной литературе используется аббревиатура L-PRP - Leucocyte and Platelet-Rich Plasma);
• чистый обогащенный тромбоцитами фибрин (в англоязычной литературе используется аббревиатура P-PRF - Pure Platelet-Rich Fibrin);
• обогащенный лейкоцитами и тромбоцитами фибрин (в англоязычной литературе используется аббревиатура L-PRF - Leucocyte and Platelet-Rich Fibrin).
Препараты P-PRP и L-PRP в неактивированном состоянии являются суспензиями, которые представляют собой тромбоцитарный или тромбоцитарно-лейкоцитарный (в зависимости от способа получения) концентрат соответственно в небольшом объеме плазмы крови человека. Рассматривая применение препаратов L-PRP, важно отдавать предпочтение технологиям, обеспечивающим высокоселективное устранение из конечного препарата провоспалительных лейкоцитов-гранулоцитов и сохранение в препарате аутоплазмы клеток агранулоцитов (преимущественно моноцитов). Наиболее совершенные технологии предполагают активацию данных препаратов, путем добавления к ним физиологического активатора дегрануляции тромбоцитов - аутологичного тромбина, при этом также запускающего коагуляционный каскад и полимеризацию молекул растворимого фибриногена в плотные, но слабо сшитые нити фибрина, что сопровождается трансформацией суспензии в обогащенный тромбоцитами фибриновый гель. Полученные по такой методике гели P-PRP и L-PRP в сравнении с их суспензиями обеспечивают наиболее оптимальные условия для полноценной реализации биологического потенциала факторов роста, а также позволяют достичь более локализованного и пролонгированного воздействия на ткани. И неактивированная (суспензия) и активированная аутологичным тромбином (гель) формы P-PRP и L-PRP являются достаточно жидкими, благодаря чему доставка препарата в поврежденную ткань может осуществляться как аппликационным, так и инъекционным способом.
Препараты чистого обогащенного тромбоцитами и обогащенного лейкоцитами и тромбоцитами фибрина существенно отличаются по своей биохимической структуре от описанных выше. Они представляют собой сильно полимеризованный фибриновый сгусток, который состоит из более прочно сшитых молекул фибрина, организованных в трехмерную сеть, и содержит тромбоцитарный или тромбоцитарно-лейкоцитарный концентрат соответственно. Этот фибриновый сгусток может рассматриваться как оптимизированный сгусток естественной крови, полученный в клинически пригодной форме, и использоваться на практике в таком виде или в виде мембраны. Высокая плотность чистого обогащенного тромбоцитами и обогащенного лейкоцитами и тромбоцитами фибрина по сравнению с жидкими формами PRP ограничивает возможность инъекционного введения этих препаратов и позволяет только апплицировать или имплантировать их в ткань, что может быть полезным при выраженных атрофических рубцах постакне.
Способы получения, состав и агрегатное состояние препарата для терапии аутологичной плазмой с тромбоцитами (PRP) определяют возможности применения и результаты PRP-терапии. Доказано, что технологические расхождения в протоколах получения PRP, наиболее существенно отражаются на таких параметрах препарата, как степень выделения тромбоцитов, их жизнеспособность (подтверждается для конкретной системы получения PRP соответствующими тестами - способность тромбоцита к адгезии на коллагене, устойчивость тромбоцитов к гипотоническому стрессу, способность к экскреции P-селектина), конечная концентрации тромбоцитов, и уровень биологически доступных факторов роста, а следовательно, влияют на эффективность терапии аутологичной плазмой с тромбоцитами (PRP-терапии).
Относительно содержания тромбоцитов и факторов роста в аутологичной плазме крови человека в литературе пока существуют противоречивые данные, среди которых преобладают две основные концепции. Ряд авторов полагают, что клинические эффекты от применения терапии аутологичной плазмой с тромбоцитами (PRP-терапии) имеют прямой дозозависимый характер - наиболее выраженные эффекты достигаются при использовании препаратов с высоким (превышающими физиологический показатель) содержанием тромбоцитов, благодаря пропорциональному росту концентрации факторов роста. В связи с распространением такой точки зрения большая доля разработчиков PRP длительное время стремилась к созданию технологий, позволяющих эффективно выделять максимально возможное количество тромбоцитов. Эффективность выделения тромбоцитов для многих исследователей остается по-прежнему актуальной проблемой, хотя интерес к ней в свете современных тенденций в развитии данных технологий существенно снизился.
В настоящее время в разработке технологии получения препаратов терапии аутологичной плазмы с тромбоцитами на первый план выходит альтернативный взгляд на количественную составляющую тромбоцитов в аутологичной плазме крови человека. Выявленная в ранних работах прямая зависимость между выраженностью клинических эффектов терапии аутологичной плазмой с тромбоцитами (PRP-терапии) и дозой тромбоцитов в конечной аутологичной плазме с тромбоцитами проявляется в ограниченном диапазоне концентрации тромбоцитов. Реализация их биологических свойств становится возможной при содержании не менее 1×106 мкл. При низких концентрациях тромбоцитов в PRP стимулирующий эффект препарата не проявляется. Аналогичный вывод был получен при изучении высококонцентрированных препаратов. Избыточные концентрации оказывают негативный цитотоксический эффект и вызывают ингибирование факторов роста тромбоцитов. Ингибирующее влияние аутологичной плазмы с тромбоцитами с высоким содержанием последних было установлено при изучении влияния препаратов с различной концентрацией тромбоцитов на заживление кишечных анастомозов у крыс. Согласно имеющимся данным, PRP с физиологической концентрацией тромбоцитов показывает лучшие терапевтические результаты по сравнению с высококонцентрированными препаратами. А наиболее оптимальной для проведения терапии аутологичной плазмой с тромбоцитами (PRP-терапии) является концентрация тромбоцитов, в 1,5-2,5 раза превышающая исходный уровень в цельной крови.
Эффективность PRP при рубцах обусловлена составом препарата с множеством биологически активных веществ, содержащихся в α-гранулах тромбоцитов, среди которых более 30 различных факторов роста, однако наибольший интерес с точки зрения терапевтического воздействия на рубцы представляют: фактор роста эндотелия сосудов (VEGF - vascular endothelial growth factor), тромбоцитарный фактор роста (PDGF - platelet-derived growth factor), эпидермальный фактор роста (EGF - epidermal growth factor), основной фактор роста фибробластов (β-FGF - β-fibroblast growth factor), трансформирующий фактор роста-β1 (TGF-β1), инсулиноподобный фактор роста (IGF - insulinlike growth factor). Перечисленные выше молекулы проявляют избирательную активность по отношению к эндотелиальным и эпителиальным прогениторным клеткам, запуская их пролиферацию, дифференцировку и миграцию. Стимулированные клетки эндотелия сосудов включаются в неоангиогенез, в результате чего создаются условия для адекватной васкуляризации и трофического обеспечения тканей с атрофией. Индукция пролиферации, дифференцировки и миграции мезенхимальных стволовых клеток и фибробластов кожи, опосредованная факторами роста тромбоцитов, сопровождается комплексным ремоделированием межклеточного матрикса дермы. А обновление резидентных клеточных популяций и увеличение их синтетической активности влекут за собой интенсивную продукцию его основных компонентов: коллагена, эластина, гликозаминогликанов и др.
Апробированной и доказавшей свою эффективность в терапии рубцов является технология RegenLab. Отличительными особенностями данной технологии являются: концентрация тромбоцитов в 1,5-2,5 выше физиологической, отсутствие блокирующих дегрануляцию тромбоцитов и их адгезию на фибрине необратимых антиагрегантов (например, гепарина), высокая жизнеспособность тромбоцитов, наличие дополнительного матрикса и физиологического активатора - аутологичного тромбина, минимальное количество гранулоцитов, при сохранении в клеточном препарате моноцитов. Процедуры проводятся 1 раз в 2-3 нед, на курс 3-5.
В современных литературных источниках сообщается о разработке новых комплексных форм препаратов, которые сочетают в себе один из перечисленных выше базовых вариантов терапии аутологичной плазмой с тромбоцитами (PRP) и дополнительную фармацевтическую субстанцию, например «L-PRP + гиалуроновая кислота». К таким технологиям относится RegenLab Клеточный Матрикс (Cellular Matrix), которая обеспечивает немедленное формирование насыщенного жизнеспособными тромбоцитами матрикса из специально разработанной гиалуроновой кислоты и PRP. Состав: 2 мл неретикулированной гиалуроновой кислоты (1550 кДа) в концентрации 20 мг/мл (в каждой пробирке 40 мг), 4 мл смеси A-PRP и гиалуроновой кислоты можно приготовить за один этап из 4 мл крови пациента в полностью замкнутом цикле. Комплекс «гиалуроновая кислота и A-PRP» обладает значительно более высокой вязкостью, чем PRP. Данная характеристика позволяет не только воздействовать на трофику ткани, но и заполнять дефект атрофического рубца, что дает немедленный эстетический результат. Также может использоваться техника введения с интрадермальной стимуляцией рубцовой ткани (Skinbiogeting) - механическое отделение рубца от нижележащих тканей (сепарация ткани) с ретроградным введением препарата. Для коррекции атрофических рубцов постакне рекомендуется проведение 3-4 процедур с кратностью 1 раз в 2-3 нед.
Использование незарегистрированных комбинаций PRP c другими препаратами недопустимо, так как изменения pH, осмотического равновесия и прочих условий приводят к снижению или прекращению функциональной активности тромбоцитов и моноцитов.
Дермабразия используется для выравнивания поверхности рубца и активации репаративных процессов и коллагенообразования. Чаще всего используется механическая дермабразия. Техника проведения процедуры: за 1 мес до процедуры назначается третиноин (для усиления процессов эпителизации) и 4% бензол-1,4-диол (Гидрохинон*) (профилактика гиперпигментации). Проводится обработка очага с захватом здоровой кожи (около 0,5 см), при этом важно, чтобы обработанная поверхность плавно переходила на окружающую ткань. Эпителизация длится в среднем 7 дней, однако эритема может сохраняться до 3 мес.
Относительно новый метод - плазменная дермабразия позволяет контролировать глубину повреждения за счет миллисекундных импульсов подачи высокочастотного излучения. Плазменную дермабразию можно проводить в различных режимах: с низкой энергией (требуется несколько процедур) или с высокой энергией (однократная процедура). Процедура хорошо переносится, реабилитационный период короткий (зависит от энергии). Преимущество - отсутствие рисков гиперпигментации и рубцов.
Радиочастотная микроигольчатая терапия
Появление технологий фракционных радиочастотных микроигл позволило решить проблему воздействия на глубокие слои кожи, не оказывая значительного воздействия на эпидермис. Главным действующим агентом любого радиочастотного устройства является высокочастотный переменный ток. В зависимости от частоты радиоволны, напряжения и формы действие на ткани может выражаться в разных процессах, начиная от пролиферации клеток и заканчивая коагуляционным некрозом. Действие радиочастотной волны на биологические ткани достигается путем выделения тепла при протекании тока через биологические структуры. В основе данного процесса лежит принцип диатермии (рис. 4.4).
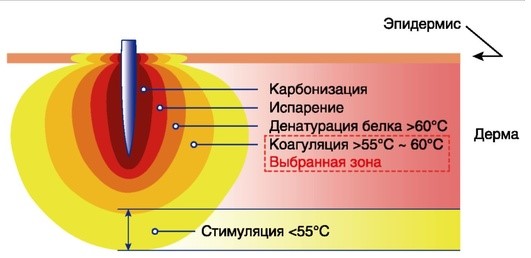
Рис. 4.4. Механизм действия радиочастотной терапии
Изменения в тканях напрямую зависят от степени их нагрева. При прохождении высокочастотной радиоволны через биологические ткани количество выделяемого тепла варьирует не только в зависимости от параметров волны (частоты колебаний, плотности и частоты тока), но и от электрической проводимости самих тканей. Таким образом, существует возможность путем подбора плотности тока и частоты колебаний добиться преимущественного выделения тепла в целевых биологических тканях, т.е. обеспечить селективный электротермолиз.
Весь спектр существующих в настоящее время методик воздействия на биологические ткани посредством высокочастотного переменного тока можно разделить на неинвазивные (уровень проникновения энергии ограничен толерантностью эпидермиса) без нарушения целостности кожи (термолифтинг моно-, би-и триполярными электродами) и малоинвазивные. К последним относится радиочастотная микроигольчатая терапия, механизм действия которой основан на тепловом эффекте, локальной фракционной коагуляции и возникающем асептическом воспалении в месте дозированной микротравмы, при этом происходит нагрев эпидермиса и дермы на заданной глубине, с механическим микропроколом, в свою очередь, механорадиочастотное воздействие индуцирует репаративные процессы в дерме (рис. 4.5).

Прототипом RF-микроигольчатой терапии является методика терапии акне инсулиновыми иглами Kobayashi. Данный метод был основан на принципе селективного электротермолиза: инсулиновая игла вводится в сальную железу, после чего подается радиочастотный импульс. Таким образом, происходит избирательное повреждение сальной железы. Однако недостатком данного метода является слишком длительная продолжительность процедуры, что особенно актуально при локализации высыпаний на всей поверхности кожи лица или распространение на другие анатомические зоны.
В современных системах, использующих радиочастотные микроиглы, данный недостаток исправлен оснащением сменными одноразовыми насадками с закрепленными на ней иглами, как правило, в количестве 25-36 шт. (в зависимости от производителя и модели их количество варьирует). На некоторых устройствах поверхность каждой иглы изолирована, кроме участка 0,2 мм на конце иглы, через который проходит радиочастотный импульс. Таким образом, термическое воздействие оказывает только участок на конце иглы, что снижает риск появления поствоспалительной гиперпигментации и позволяет применять данные устройства при всех фототипах кожи. Кроме того, эпидермальный барьер восстанавливается быстрее.
Устройства, использующие радиочастотные микроиглы, могут быть монополярными, биполярными и минимально-аблятивными поверхностными. Монополярные радиочастотные микроиглы могут воздействовать глубже, чем биполярные. Минимально-аблятивные поверхностные RF применяются для сглаживания тона кожи и коррекции пигментных очагов.
В коррекции атрофических рубцов могут быть использованы все типы радиочастотных микроигл, однако наибольшее применение получил метод фракционных биполярных радиочастотных микроигл. Данная методика при атрофических рубцах превосходит результаты неаблятивного фракционного фототермолиза, что обусловлено в том числе и глубиной проникновения (важный фактор при рубцовых поражениях) (рис. 4.6).
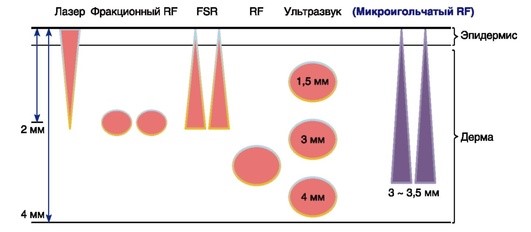
Установки, использующие RF-микроиглы, оказывают термическое повреждение на заданные слои кожи путем быстрой механической пенетрации. Глубина воздействия может варьировать с от 0,5 до 3 мм. Мощность радиочастотного воздействия колеблется от 0 до 2,4 Дж. Продолжительность энергетического импульса занимает 0,04-0,1 с. Таким образом, основная зона термического воздействия наблюдается на уровне дермы при неповрежденном эпидермисе. Метод отличают низкая болезненность и быстрая реабилитация, а также отсутствие кровотечений и побочных эффектов.
Терапия интенсивным импульсным (широкополосным) светом
Используется интенсивный импульсный свет, с большой плотностью энергии (флюенсом), но меньшей травматичностью для кожи. Суть метода заключается в применении уникальных фильтров, осуществляющих преобразование неиспользуемой части спектра (коротковолновая и ультрафиолетовые части) в дополнительное околоинфракрасное излучение. Таким образом, наличие фильтра способствует использованию полезной энергии без увеличения мощности. Длина волны - 440-950 нм, плотность энергии - 5-30 Дж/см2. Параметры воздействия при IPL-терапии: для свежих рубцов: флюенс - 10-12 Дж/см2, импульс - 12 мс; размер пятна - 6,4 см2; для длительно существующих атрофических рубцов: флюенс - 15-19 Дж/см2, импульс 12-15 мс. Количество проходов 1-3 до появления слабо выраженной эритемы.
Форез лекарственных препаратов
Используют электрофорез, фармафорез, фонофорез с препаратами, улучшающими репаративные процессы, трофику тканей. Применяются биостимуляторы: мадекасол, солкосерил, актовегин, экстракт алоэ, коктейли с микроэлементами. Возможно применение фармафореза плацентарного препарата Лаеннек*.
Микротоковая терапия
В основе методики лежит использование слабых, низкочастотных, модулированных импульсных токов в диапазоне от 10 до 600 мкА, частотой от 0,1 до 300 Гц и напряжением от 11 до 14 В. Под их действием в клетках кожи происходит целый ряд процессов - это синтез аденозинтрифосфорной кислоты, поддержание постоянства ионного состава, водного баланса, ускоряются обменные процессы. Микротоковый массаж стимулирует выработку коллагена фибробластами, восстановление структурной цепи коллагена. Рекомендованный курс от 8 до 12 процедур, проводимых через день или 2 раза в неделю.
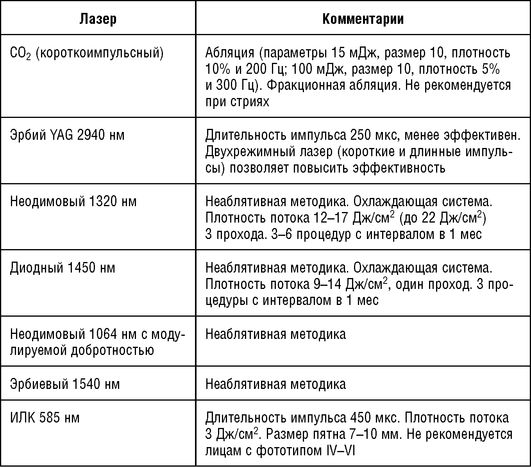
Таблица 4.4 Лазерная терапия в коррекции атрофических рубцов
Тактика ведения пациентов после лазерных аблятивных методик требует применения топических средств, способствующих активации репаративных процессов и восстановлению барьерной функции кожи. Масло Bio-Oil разрабатывалось с целью ухода за кожей с рубцовыми деформациями в виде атрофических рубцов (стрий). Топическое нанесение масла на проблемную зону в течение 3 месяцев способствует улучшению внешнего вида рубца и субъективных ощущений. Масло Bio-Oil представляет собой комплекс экологически чистых масляных растительных экстрактов с добавлением витаминов А и Е и бисаболола. Масло содержит уникальный ингредиент PurCellin Oil, обеспечивающий быстрое впитывание. Комплекс защитных и успокаивающих компонентов растительных экстрактов, а также важных для кожи жирных кислот способствует восстановлению барьерных свойств кожи, обеспечивает достаточный уровень гидратации, отвечает за профилактику воспалительных процессов. Как следствие - разглаживается микрорельеф кожи, улучшается ее рисунок, нормализуется цвет, исчезают неприятные субъективные ощущения стянутости, зуда, раздражения.
Выбор хирургического метода при атрофических рубцах зависит от формы и глубины рубца.
Подсечение рубцов используется в случаях, когда дно рубца плотно фиксировано к подлежащим тканям. Контролируемая травма приводит к активации фибробластов и формированию новой соединительной ткани. Техника проведения: используется игла 18G и 3-миллиметровый шприц, игла вводится параллельно коже (поверхностный слой), движениями вверх/вниз и в стороны разрушается соединительнотканная перемычка, наилучший результат при проведении процедуры с разных сторон рубца. Данный метод хорошо сочетается с инъекциями филлеров или аутологичного материала.
Пункционное иссечение используется для коррекции «колотых» и глубоких атрофических рубцов. Техника проведения: растянуть кожу перпендикулярно естественным линиям, иссечение проводится трубчатым ножом для пункционной биопсии диаметром 1,5-3 мм.
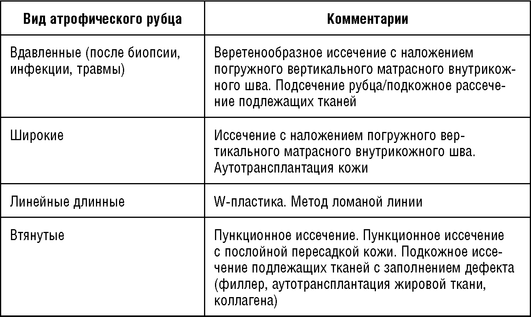
Метод подъема дна рубца подходит для больших прямоугольных рубцов (диаметром более 3 мм). Техника выполнения: диаметр трубчатого ножа (для панч-биопсии) должен соответствовать диаметру рубца, вращательным движением поднимается дно рубца, следующим этапом необходимо освободить края от подлежащих тканей, закрепить дно к краям с помощью клея (Дермабондρ) или пластыря.
Пункционное иссечение с послойной пересадкой кожи используется крайне редко из-за риска осложнений. Метод показан для лечения глубоких стянутых рубцов (прямоугольные, неправильной формы). Техника: проводится иссечение дна рубца трубчатым ножом, дефект заполняется тканью, взятой в заушной области. На донорский участок накладывают швы.
Аутотрансплантация кожи показана для глубоких и широких атрофических рубцов. Техника проведения операции: выполняется подкожное рассечение мягких тканей иглой 18G за 10-14 сут до трансплантации. Затем удаляют эпидермис (дермабразия, лазерная абляция), срезают дерму до глубокой фасции в виде столбиков высотой 3 мм, образовавшийся дефект (полость) заполняются тканью, взятой из заушной области. Полость зашивают поверхностным косметическим швом.
Источник: Рубцы кожи. Клинические проявления, диагностика и лечение / Н. Е. Мантурова, Л. С. Круглова, А. Г. Стенько. - Москва: ГЭОТАР-Медиа, 2021.
05.05.2021 | 12:06:55