Келоидный рубец. Общие сведения, лечение келоидных рубцов.
Раздел: Статьи
/
Общая врачебная практика.
/
Дерматовенерология.
/
Келоидный рубец. Общие сведения, лечение келоидных рубцов.
Содержание
Общие сведения
Консервативное лечение келоидных рубцов.
Малоинвазивные методы лечения келоидных рубцов.
- Глюкокортикостероиды
- Интерферон
- Фторурацил (5-фторурацил-эбеве*), блеомицин, верапамил
- Применение препаратов ботулинического токсина типа а
- Криотерапия
Аппаратные методы лечения келоида
Лазерная терапия келоидного рубца
Хирургическое лечение келоидного рубца
Результаты лечения келоидных рубцов.
Большие келоиды представляют собой наиболее сложную клиническую проблему, многие из них резистентны ко всем доступным способам лечения. Прежде чем принимать решение об операции, следует информировать пациента о высокой вероятности рецидива. Для некоторых больных единственно возможным способом лечения является симптоматическая терапия. При использовании лучевой терапии следует учитывать вероятность отсутствия положительного эффекта. Новые способы лечения, такие как инъекции блеомицина или фторурацила (5-Фторурацила-Эбеве*), ботулинотерапия могут оказаться полезными в будущем, так же как исследования возможности влияния на трансформирующий фактор роста и синтез коллагена. Важными составляющими лечения являются постоянное наблюдение за состоянием пациентов и консультирование их по вопросам профилактики патологического рубцевания в дальнейшем.
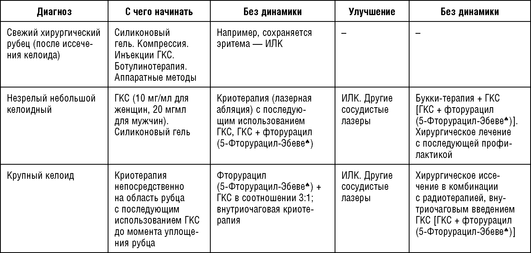
Терапевтическая тактика при келоидах первично включает стероидные препараты, силиконовый гель, давящие повязки, хирургическое лечение, криотерапию, лучевую терапию, лазерную и иные виды терапии (табл. 1.1).
Таблица 1.1 Методы терапии келоидных рубцов (этапность ведения пациентов)
В соответствии с международными стандартами лечения и профилактики келоидных рубцов средства на основе силикона являются препаратами первого выбора для профилактики после хирургического иссечения или иного вида удаления келоида. Длительность применения не менее 12 ч ежедневно на протяжении до 12 мес.
Компрессионные повязки главным образом применяются при несформированных патологических рубцах и обычно неэффективны в стадии их стабилизации. Поэтому также используются после иссечения. Рекомендованная длительность компрессионной терапии 16-18 ч в сутки, необходимая величина давления - 24-30 мм рт.ст. Рекомендуемая длительность компрессии 6-12 мес.
Показания: после аблятивных лазеров, дермабразии или крио-воздействия, после хирургического иссечения.
Имихимод (Имиквимод*) (1-[2-метилпропил]-1Н-имидазо [4,5-с] хинолин-4-амин) принадлежит к семейству имидазохинолинов. Имихимод (Имиквимод*) индуцирует фактор некроза опухоли α, интерферон-α, интерферон-γ, интерлейкин-1, интер-лейкин-4, интерлейкин-5, интерлейкин-6, интерлейкин-8 и интер-лейкин-12, а также изменяет экспрессию маркеров апоптоза. Имеются данные об эффективности применения аппликаций 5% крема Имихимода (Имиквимода*) в течение 8 нед после иссечения келоида (препарат назначается через 2 нед после операции). После аппликации имихимода (Имиквимода*) отмечалось легкое раздражение, а некоторые пациенты нуждались в перерыве применения препарата. Гиперпигментация наблюдалась более чем у половины пациентов.
Показания: после аблятивных лазеров, дермабразии или крио-воздействия, после хирургического иссечения для профилактики рецидива.
Глюкокортикостероиды
Инъекции триамцинолона в рубцовую ткань рассматриваются как терапия первой линии для лечения келоидов. Результаты лечения лучше, если комбинировать стероиды с другими методами, например с хирургическим иссечением или деструкцией (криодеструкция, лазерная деструкция). Даже в стандартно рекомендуемых дозах (максимальная 40 мг/мл для раствора триамцинолона) примерно у 65% пациентов развиваются побочные эффекты, такие как атрофия кожи, гипер- или депигментация, телеангиэктазии, длительная эритема. Побочные эффекты напрямую связаны с техникой введения: препарат необходимо вводить в рубцовую ткань. С осторожностью (относительные противопоказания) инъекции проводятся у лиц с сахарным диабетом, гипертонической болезнью.
Из-за плотной текстуры рубца введение препарата сопряжено с определенными сложностями: болезненность, трудности в введении самой иглы и нагнетания в ткань препарата. Для облегчения введения препарата рекомендуется предварительное крио-воздействие (10-15 с) или обезболивание лидокаином. Техника введения, как правило, ретроградная: вводить лекарственное вещество и извлекать иглу необходимо с осторожностью, во избежание попадания препарата в подлежащие или окружающие ткани. Ориентиром правильного введения ГКС является увеличение объема рубца и изменение цвета на желтый или белый.
Рекомендуются троекратные инъекции триамцинолона с одноразовой дозой 10-40 мг/мл в течение первых 3 нед после хирургического иссечения патологического рубца, а последующие 3-недельные курсы - через интервал длительностью до 4-6 нед или по мере появления симптомов активации патологического рубцевания. Возможно использование дюрантного кортикостероида триамцинолона (Кеналог*) 2,5-10 мг/мл на 1 см2, бетаметазона (Дипроспан*) - 0,5 мл/см2, курсами по 3-4 инъекции, проводимые 1 раз в 7-10 дней. Повторный курс не ранее чем через 3 мес.
Показания: в раннем послеоперационном периоде в комбинации с силиконовым гелем (пластиной), компрессионной терапией и другими методами.
Интерферон
Имеется опыт внутриочагового введения интерферонов-γ, -α и -2β при несформированных келоидах. Основываясь на предположении, что интерферон может снижать продукцию I и III типов коллагена фибробластами, данным механизмом можно объяснить его эффективность при келоидах. Несмотря на то что положительная динамика отмечается в 50% наблюдений, эффективность интерферона в лечении рубцовых изменений кожи остается спорной. В настоящее время предпочтение отдается интерферонам-α и -2β. Среди побочных эффектов внутриочаговой интерферонотерапии авторами нередко отмечается синдром, имеющий клинические признаки гриппа. Следует учитывать также два обстоятельства: а) интерферон-γ является весьма дорогостоящим препаратом, а преимущества его над стероидами в отдаленные сроки неочевидны; б) из-за болезненности инъекции данного препарата обычно требуется дополнительно выполнение местной анестезии.
Фторурацил (5-фторурацил-эбеве*), блеомицин, верапамил
Методика применения фторурацила (5-Фторурацила-Эбеве*):
0,5-2 мл в концентрации 50 мг/мл вводится 1 раз в неделю на протяжении 12 нед.
Фторурацил (5-Фторурацил-Эбеве*) может использоваться в виде монотерапии, однако для повышения эффективности чаще используется комбинация фторурацила (5-Фторурацила-Эбеве*) и бетаметазона (лучше использовать дюрантный) в соотношении 1:1. Хотя описана методика введения 0,1 мл триамцинолона (10 мг/мл) + 0,9 мл фторурацила (5-Фторурацила-Эбеве*) (50 мг/мл), в своей практике авторы придерживаются схемы 1:1. Техника введения линейная ретроградная или инфильтративная (нагнетательная). Количество композитного препарата 0,5 мл/см2, один курс составляет 3-4 инъекции, проводимые 1 раз в 14 дней. Повторный курс не ранее чем через 3 мес. Как правило, бывает достаточно одного курса.
Инъекции блеомицина вызывают некроз кератиноцитов с формированием смешанного воспалительного инфильтрата. Несколько исследований показали, что блеомицин может эффективно использоваться для лечения келоидных рубцов. Методика введения блеомицина: внутрирубцовые инъекции 0,1% блеомицина в концентрации 1,5 МЕ/мл каждые 3-4 нед, или 3-5 инфильтраций блеомицина в течение 1 мес, или 3 инъекции выполняются с 15-дневными интервалами, а 4-я и последняя - через 2 мес.
В такой же концентрации возможно введение препарата методом электропорации. Комбинация блеомицина с внутриочаговыми инъекциями ГКС (триамцинолон, бетаметазон) показывает высокую эффективность при келоидах. Используется 0,75 МЕ блеомицина и 4 мг триамцинолона ацетонида на 1 см2, это считается приемлемой методикой для лечения келоидных рубцов. Наилучшие результаты были получены при лечении келоидных рубцов размером не более 1 см2. После внутриочаговой инъекции блеомицина практически у всех пациентов наблюдается гиперпигментация.
Верапамил является блокатором кальциевых каналов, который блокирует синтез и секрецию молекул внеклеточного матрикса (например, коллагена, гликозаминогликанов, фибронектина) и увеличивает концентрацию фибриназы. По данным ряда авторов, верапамил сопоставим по эффективности с ГКС. Отмечается высокая эффективность применения после хирургического иссечения рубца методом W-пластики или пересадки кожи. Проводятся инъекции верапамила: 5 процедур верапамила в дозе 2,5 мг/мл с варьированием дозы в диапазоне 0,5-5 мл в зависимости от размера келоида в течение 2 мес. Эффективно комбинированное лечение, включающее хирургическое иссечение, силиконовые повязки и внутриочаговое введение верапамила.
Показания: в виде монотерапии при неэффективности других методов лечения, в комбинации с инъекциями ГКС, после иссечения в сочетании с силиконовым гелем.
Применение препаратов ботулинического токсина типа А
Ботулинический токсин типа А - это нейротоксин, который вызывает периферический паралич локальной мускулатуры и уменьшает растяжение кожи. Это уменьшение силы растяжения кожи в процессе заживления ран может представлять новую терапевтическую мишень для лечения келоидных рубцов.
Механизм действия препарата заключается в снижении экспрессии TGF-β1 и угнетении пролиферации фибробластов келоидного рубца. Улучшение субъективных ощущений может
объясняться противовоспалительным и аналгетическим действием ботулинического токсина типа А.
В настоящее время достаточно часто в клинической практике используется ботулинотерапия как патогенетический метод профилактики формирования патологических рубцов и их коррекции. Ботулинотерапия хорошо комбинируется с лазерными процедурами, криодеструкцией, дермабразией, до/после хирургического иссечения. Также рекомендуется проводить инъекции ботулинического токсина типа А в ткань рубца для купирования болевого синдрома.
Методики применения при келоидах:
• инъекции ботулинического токсина типа А в мышцы, прилегающие к ране (15 ЕД ботулинического токсина типа A-гемагглютинин комплекса (Ботокса*) на каждые 2 см интраоперационной длины раны), в течение 24 ч после ее закрытия;
• ботулинический токсин в общей дозе 70-140 ЕД (количество единиц рассчитывается в зависимости от препарата) вводится непосредственно в ткань келоидного рубца. Процедуры проводятся несколько раз с интервалами в 3 мес в течение максимум 9 мес;
• инъецирование ботулинического токсина типа А в ткань рубца и в кожу вокруг него, 1 раз в 2-4 мес при лечении болезненных рубцов и 1 раз в 4-6 мес в случае неблагоприятной клинической картины.
Показания: инъекции ботулинического токсина являются методом дополнительной терапии келоидных рубцов, при определенных локализациях показана за 2-3 нед до иссечения, в ранние сроки после операции, хорошо сочетается с внутриочаговым введением ГКС и аппаратными методами.
Криотерапия
Эффективность криотерапии напрямую зависит от того, используется ли она в виде монотерапии или в комбинации с другими методами. Изолированное использование 2 и более сеансов криотерапии приводит к уплощению келоидов у 51-74% пациентов, однако риски рецидива составляют более 70%. В результате криотерапия обычно используется для лечения очень маленьких по размеру рубцов и в комбинации с другими методами.
Проводится 1, 2 или 3 цикла замораживания-оттаивания продолжительностью 10-30 с каждый. Лечение может повторяться каждые 20-30 дней. Новые способы применения жидкого азота включают введение иглы для поясничной пункции через длинную ось келоида с одной стороны на другую и последующим введением в него жидкого азота через внутривенную капельницу за 2 цикла замораживания-оттаивания по 20-30 с каждый в течение 5-10 сеансов. Возможно использовать методику внутриочагового введения криозонда.
Показания: перед инъекциями ГКС, в составе комбинированных методик. Являясь бескровной процедурой, криотерапия может проводиться у лиц с вирусными гепатитами или вирусом иммунодефицита человека.
Лучевая терапия (Букки-терапия) для лечения келоидов используется как монотерапия или в комбинации с хирургическим вмешательством.
Реакция на лучевую терапию без дополнительных методов лечения наблюдается у 10-94% пациентов, частота рецидивирования келоидов 50-100%. Такая высокая частота рецидивов понятна, учитывая резистентность рубцов к другим методам лечения. Наилучшие результаты были получены при использовании доз излучения 5-10 Гр в течение 5 или 6 сеансов в раннем послеоперационном периоде. По разным данным, частота объективного ответа при применении лучевой терапии после хирургического иссечения келоидов составляла от 25 до 100%.
Показания: ранний послеоперационный период для профилактики рецидива, в комплексе с инъекционными методами.
Фотодинамическая терапия представляет собой многообещающее неинвазивное лечение, которое дает хороший косметический результат с минимальными побочными эффектами.
Фотодинамическая терапия с топическим фотосенсибилизатором широко используется при лечении поверхностного базальноклеточного рака, актинического кератоза и болезни Боуэна. Совсем недавно фотодинамическая терапия была предложена в качестве нового терапевтического подхода для лечения келоидов. Фотодинамическая реакция генерирует активные формы кислорода, что, в свою очередь, приводит к апоптозу клеток, повреждению мембран и митохондрий и активирует различные сигнальные молекулы, такие как фактор некроза опухоли α. Было показано, что фотодинамическая терапия снижает синтез коллагена I типа и пролиферацию фибробластов in vitro, что может быть причиной улучшения, наблюдаемого при келоидных рубцах. Рекомендуется 3 курса фотодинамической терапии (37 Дж/см2) с недельным интервалом.
Лазерная терапия используется для неспецифической деструкции тканей с целью снижения вероятности патологического рубцевания, однако она в существенной степени была дискредитирована после публикации неоднозначных результатов большого продолжительного исследования эффективности лечения СО2 и аргоновым лазером. СО2-лазеры вначале показали обнадеживающие результаты в иссечении келоидов, но позднее не подтвердилась их способность угнетать рост и рецидивирование келоидов. Сейчас используется два новых типа СО2-лазеров: высокоэнергетические короткоимпульсные СО2-лазеры и сканирующие непрерывно-волновые СО2-лазеры, которые эффективны в послеоперационном лечении келоидных рубцов. В настоящее время СО2-лазеры в виде монотерапии не рекомендуются для лечения келоидов из-за высокой частоты рецидивов в отдаленные сроки. Процедуры лазеротерапии целесообразно комбинировать с инъекциями ГКС (триамцинолон 40 мг/мл). Эффективна комбинация абляции СО2-лазером с инъекциями интерферона альфа-2b. Следует отметить, что в настоящее время нет исследований, посвященных изучению эффективности фракционных абляционных лазеров при келоидных рубцах.
Более современные лазеры: лазер на иттриум-алюминиевом гранате (ErYAG) и ИЛК используют для селективной абляции кровеносных сосудов, при этом частота ответа составляет от 36 до 47%. ИЛК может быть рекомендован в раннем послеоперационном периоде (2 нед после иссечения), что значительно снижает риск рецидива.
Пример методики применения ИЛК при келоидных формирующихся рубцах: длина волны 585 нм, плотность потока 3-4 Дж/см2 (до 5 Дж/см2), размер лазерного пятна 10 мм, длительность импульсов 450 мкс. При применении излучателя меньшего размера (5-7 мм) энергию излучения следует увеличить. При первых процедурах плотность потока должна быть небольшой с последующим ее увеличением. Более эффективны параметры с коротким импульсом, так как у рубцов (включая келоиды) сосуды имеют небольшой диаметр, следовательно, в соответствии с теорией фототермолиза короткая длительность импульса будет удерживать тепло внутри сосудов и, таким образом, приведет к лучшему результату. После хирургического иссечения ИЛК проводится в день снятия швов и в дальнейшем 1 раз в 1-3 мес.
Имеются данные об эффективности фотодинамической лазеротерапии с длиной волны 585 нм с плотностью потока 3,5 и 7 Дж/см2 для лечения келоидных рубцов.
Интенсивные импульсные источники света: BBL (broad band light -широкополосный свет) и IPL (intensive pulse light - интенсивный импульсный свет) обычно рассматриваются как аналоги импульсных лазеров на красителях и могут применяться в составе терапевтического комплекса [внутрирубцовое введение ГКС, фторурацила (5-Фторурацила-Эбеве*)] или после иссечения.
Показания: ранний послеоперационный период для профилактики рецидива, в комплексе с инъекционными методами.
Очень важным аспектом при хирургическом иссечении келоидных рубцов являются подготовка к оперативному вмешательству, правильно выбранная тактика оперативного вмешательства и профилактика рецидива.
Предоперационная подготовка включает контроль уровня глюкозы у пациентов с сахарным диабетом, сокращение курения, курация сопутствующей соматической патологии. По сути, любой фактор, который даже опосредованно влияет на репаративные процессы и микроциркуляцию, увеличивает риск образования рубцов. Оперативное вмешательство должно быть отложено как минимум на 6 мес после приема ретиноидов, проведения абляционных процедур, требующие реэпителизации (например, лазерная шлифовка, дермабразия, химический пилинг). Пациенты с частыми обострениями герпесвирусной инфекции должны профилактически принимать противовирусные препараты.
Интраоперационно профилактика рецидивирования келоида включает:
• мероприятия по снижению риска инфекции (очистка раны, удаление избытка раневого экссудата для предотвращения скопления избыточной жидкости);
• фиксация свежих краев раны вдоль разреза, чтобы стимулировать эпителизацию.
Чтобы свести к минимуму дефект ткани, желательно проводить разрезы с прямыми линиями и углами, а не круглые разрезы. При циркулярных разрезах небольшое количество ткани может быть дополнительно удалено, чтобы преобразовать круговой дефект в ромбическую форму. Минимизация травмы мягких тканей также имеет большое значение в создании наилучшего послеоперационного исхода. Необходимо использовать наиболее подходящий инструментарий для каждой анатомической области: для лица целесообразно использование маленьких, зубчатых атравматических пинцетов (0,5 мм) или небольших крючков (Guthrie), что помогает избежать избыточного повреждения окружающих тканей. Более того, захватывая дерму, а не эпидермис, во время закрытия раны можно предотвратить повреждение эпидермиса. При исправлении дефекта с кожным трансплантатом сокращение раны играет главную роль в профилактике рецидива. Кожные трансплантаты полной толщины, которые сжимаются меньше, чем трансплантаты разделенной толщины, должны использовать при работе в области лица, так как данная локализация наиболее уязвима для дальнейшего сокращения раны и может давать функциональный дефицит ткани (например, подвижные ткани области лица: веко, лоб, ноздри и периоральная область).
В раннем послеоперационном периоде профилактика рецидивирования келоида состоит:
• в защите раны от травм;
• в случае инфицирования назначаются соответствующие пероральные и местные антибиотики на срок от 7 до 10 дней;
• в проведении компрессионной терапии, силиконовых гелей, инъекций ГКС.
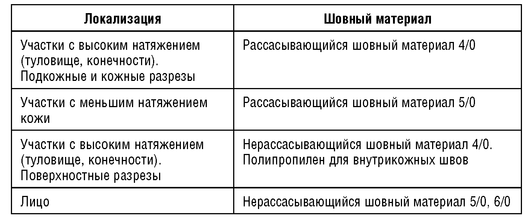
Хирургическое иссечение келоидов широко используется в клинической практике, чаще в комбинации с инъекциями стероидов, силиконовым гелем, компрессионной терапией. Применение эксцизионной хирургии келоидов без дополнительной терапии имеет высокую частоту рецидивов (45-100%). Необходимое условие: аккуратное совмещение краев раны, без излишнего натяжения, правильное расположение разреза, использование инертного шовного материала (табл. 1.2).
Таблица 1.2 Рекомендации по выбору шовного материала
Можно использовать вертикальные погружные матрасные швы, что обеспечивает плотное прилегание слоев дермы и подкожной клетчатки. Данная методика позволяет восстановить естественные складки. Важный аспект - правильное прохождение шва через дерму. Игла должна войти и выйти в соответствующий слой дермы на уровне одной и той же глубины на каждой стороне, чтобы выровнять рельеф поверхности кожи. Для получения хороших результатов важно, чтобы края кожи были слегка вывернуты во время закрытия, и необходимо исключить любое напряжение (рис. 1.1).
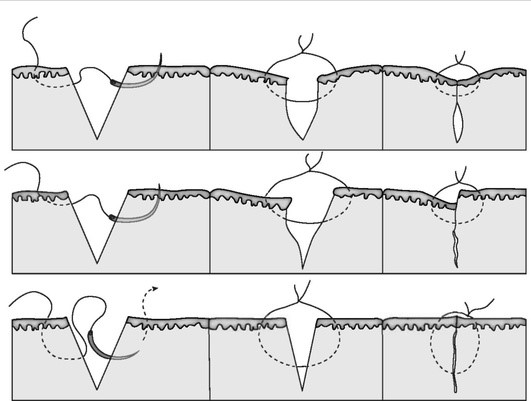

Рис. 1.1. Наложение швов при хирургическом иссечении. Верхний ряд: поверхностные швы расположены слишком поверхностно, оставляя более глубокое пустое пространство, которое сжимается и вызывает зазубренный рубец. Средний ряд: поверхностные швы расположены неровно. Нижний ряд: оптимальное приближение шовного материала при одинаковой глубине вкола
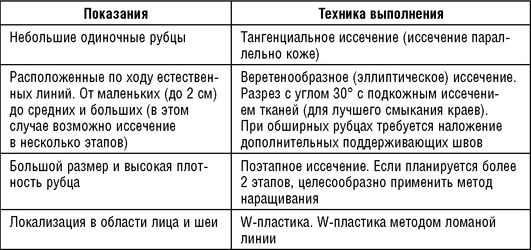
Вид хирургического иссечения келоидного рубца зависит от многих факторов: размер, расположение, давность (табл. 1.3.).
Таблица 1.3 Виды хирургического иссечения келоидного рубца
Несмотря на активную терапию в послеоперационном периоде, размер келоида при рецидиве нередко может превосходить размер первоначального поражения, когда рост его выходит за пределы участка иссечения, распространяясь на окружающие ткани. К тому же при сочетании хирургического иссечения со свободной кожной пластикой для закрытия образовавшегося раневого дефекта имеется вероятность развития поражения на донорском участке или на границе пересаженного трансплантата.
В области лица и шеи нарушение функции является прямым показанием к операции, даже при молодых келоидах, однако ввиду высокой вероятности рецидива не следует прибегать к хирургическому лечению пациентов с поствоспалительными и множественными рубцовыми поражениями, не использовав максимально возможности терапевтических мероприятий. Особенно высока вероятность рецидивирования при келоидных рубцовых поражениях, локализующихся в передненижней и заднебоковых поверхностях шеи. Высокой частоте рецидивов келоидов способствуют три основные причины: а) проведение хирургической коррекции в стадии активного рубцового процесса; б) нарушение техники выполнения оперативного вмешательства; в) пренебрежение важностью ранней послеоперационной терапии.
Существует способ частичного хирургического иссечения крупных келоидов, сущность которого заключается в отпрепаровывании на границе со здоровой кожей узких полосок эпидермиса, покрывающего поражение, после чего выполняется удаление рубцовой ткани по типу вылущивания и накладываются внутридермальные швы без отсепаровки краев образовавшейся раны. Это позволяет предотвратить послеоперационное стяжение в центральной части формирующегося послеоперационного рубца и тем самым уменьшить риск развития рецидива. Частичное удаление келоидной ткани и повторное использование при ушивании раны отслоенных эпидермальных лоскутов дают возможность избежать необходимость заимствования кожного трансплантата, при котором имеется риск образования келоидов на донорском участке.
Как показали исследования, при послеоперационном внутри-очаговом введении кортикостероидного препарата и интерферона альфа-2b частота рецидивов снижается соответственно до 50 и 18,7%. При комбинации хирургического иссечения с последующей лучевой терапией частота рецидивов снижается до 16-24% и до 10% - если облучение начинается в раннем послеоперационном периоде. Имеются данные о снижении рисков рецидива после местного применения 5% крема имихимода (Имиквимода*).
При локализации келоидов в области мочек ушных раковин при сочетании операции с внутриочаговой гормональной терапией рецидив отмечается менее чем у 5% пациентов.
Могут применяться основные методы обработки мягких тканей на участках восстановления первичной раны. Тщательно планируйте ушивание раны с минимальным натяжением ее краев, параллельно линиям натяжения кожи. Используйте при необходимости погружные шовные материалы для послойного закрытия и уменьшения натяжения. Всякий раз по возможности применяйте на раны давящие повязки, силиконовый гель в течение ближайшего и отдаленного (до 1 года) послеоперационного периода.
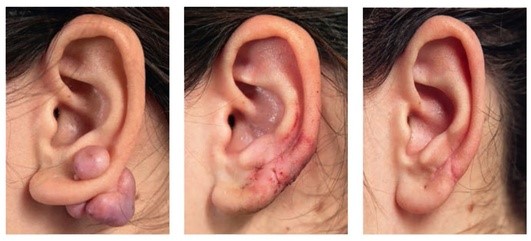
Рис. 1.2. Келоидный рубец. После хирургического иссечения, с последующим проведением Букки-терапии и курса инъекций бовгиалуронидазы азоксимера (Лонгидазы*) (№ 10)
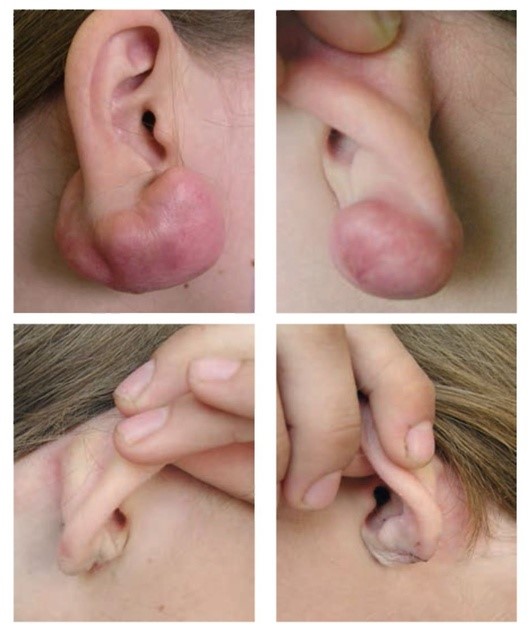
Рис. 1.3. Келоидный рубец. После хирургического иссечения с последующим проведением инъекций глюкокортикостероида и Букки-терапии
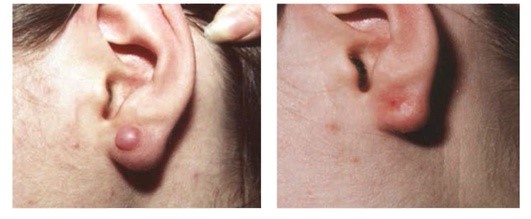
Рис. 1.4. Келоидный рубец. После однократной криодеструкции и 2 инъекций глюкокортикостероида
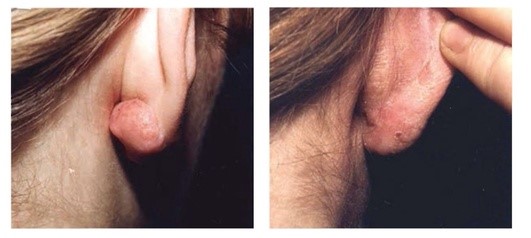
Рис. 1.5. Келоидный рубец. После однократной криодеструкции и 3 инъекций глюкокортикостероида (дипроспана) + фторурацила (5-Фторурацила-Эбеве*) (соотношение 1:1)
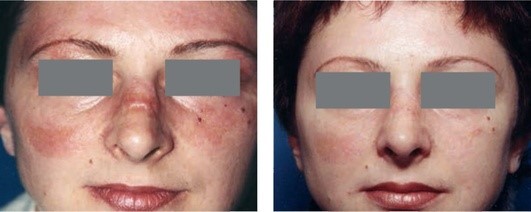
Рис. 1.6. Формирующийся келоидный рубец. После 2 инъекций глюкокортикостероида (дипроспан) с интервалом 2 нед
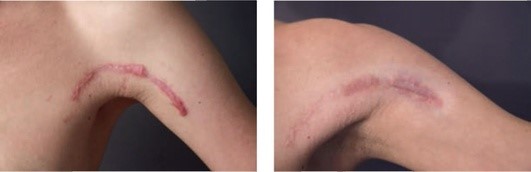
Рис. 1.7. Послеоперационный гипертрофический рубец (длительность 1,5 мес). После 2 процедур импульсного лазера на красителях
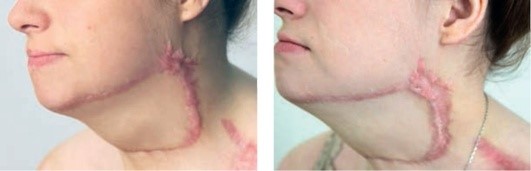
Рис. 1.8. Келоидный рубец (длительность 3,5 мес). После 1 процедуры импульсного лазера на красителях и фракционного фототермолиза
Источник: Рубцы кожи. Клинические проявления, диагностика и лечение / Н. Е. Мантурова, Л. С. Круглова, А. Г. Стенько. – Москва: ГЭОТАР-Медиа, 2021.
12.04.2021 | 13:39:28