Мышечная ткань. Строение мышц. Функции мышц.
Содержание
- Гистогенез скелетной мышечной ткани
- Строение миосимпласта
- Передача возбуждения в нервно-мышечном синапсе
- Механизм сокращения мышц
- Рост, регенерация и атрофия мышечной ткани
- Возрастные изменения мышц
Способность к передвижению является неотъемлемым свойством всех живых организмов. У одноклеточных это реснички и жгутики, которые приводятся в действие структурами, расположенными в цитоплазме. У многоклеточных организмов движение становится возможным благодаря появлению мышечной ткани. Мышечная ткань специализируется на выполнении двигательных реакций — перемещении тела в пространстве и сокращении во внутренних органах.
В организме человека мышечная ткань представлена поперечнополосатой (скелетная, сердечная) и гладкой.
Положение и идентичность клеток, которые образуют три зародышевых слоя (эктодерму, мезодерму и энтодерму), определяются на ранних сроках беременности. Формирование мышечной ткани происходит от мезодермальных клеток-предшественников — миотома. Миотом представляет собой парный зачаток скелетной мускулатуры. Миотом, в свою очередь, происходит из сомитов. Сомиты являются билатеральными парными эпителиальными скоплениями, которые образуются при эпителизации параксиальной мезодермы и сопровождаются сегментацией.
Процесс гистогенеза скелетной мышечной ткани проходит несколько стадий. На первой стадии гистогенеза, которая называется миобластической, происходит интенсивное деление клеток с крупными ядрами (рис. 1).

Рис. 1. Схема гистогенеза скелетной мышечной ткани: 1 — миосателлитоцит; 2 — мышечное волокно
Это промиобласты, которые состоят из крупных овальных ядер и небольшого количества цитоплазмы. В результате увеличения количества промиобластов митотическая активность замедляется и в цитоплазме последних появляются неупорядоченные миофиламенты. Промиобласты превращаются в миобласты. Миосимпатическая стадия начинается, когда прекращается дифференцирующий митоз. Миосимпласты приобретают способность к слиянию, и в их цитоплазме начинается процесс миофибриллогенеза (см. рис. 1). На следующей стадии гистогенеза (стадия мышечных трубочек) симпатический тяж удлиняется. Объем цитоплазмы и количество миофибрилл увеличиваются. На стадии мышечных трубочек происходит формирование базальной мембраны (см. рис. 1). Процесс гистогенеза заканчивается стадией формирования дефинитивных мышечных волокон. Миоциты сливаются, образуя многоядерные зрелые сокращающиеся мышечные волокна. Ядра перемещаются на периферию цитоплазмы, центральную часть занимают миофибриллы (см. рис. 1).
Необходимо отметить, что процесс гистогенеза регулируется экспрессией генов и миогенными регуляторными факторами: MRFs, MYOG1, MYOD, MRF4 и MYF5. По литературным данным, фактор транскрипции PAX3 контролирует миграцию мышечных клеток-предшественников посредством регулирования LBX1 и cMet. Считается, что два фактора транскрипции SIX1 и SIX4 находятся на вершине регуляторного каскада, который устанавливает миогенную линию клеток-предшественников. Миобласты активируют регуляторные факторы MYF5 и MYOD1, два MRF, которые контролируют спецификацию головных, эпаксиальных, гипаксиальных и конечностных мышечных предшественников эмбриона позвоночных. Экспрессия фактора MYOD1 сохраняется и после дифференцировки, в то время как экспрессия MYF5 прекращается на этом этапе. Активация второй волны регуляторных факторов MRFs (MYOG и MRF4) запускает терминальную дифференцировку миобластов в миоциты, которые дополнительно экспрессируют специфические для мышц гены, такие как сократительные белки мышц (миозин, актин), и мышечную КФК.
На поздней фазе эмбрионального гистогенеза определенная популяция клеток-предшественников, полученных из сомита, остается в спокойном недифференцированном состоянии и тесно связана с миофиб¬рами. Эти клетки получили название «клетки-сателлиты».
Скелетная (поперечнополосатая) мышечная ткань образует мышцы скелета. Основным назначением скелетной мышечной ткани является сократительная функция. Необходимо отметить, что скелетная мышечная ткань также принимает участие в процессе терморегуляции и в углеводном обмене.
Скелетная мышечная ткань имеет симпластическое строение. Миосимпласт — это ограниченный плазмолеммой протяженный метамерный цитоплазматический тяж с большим количеством ядер (рис. 2).

Рис. 2. Строение скелетной мышечной ткани: 1 — эндомизий; 2 — ядра; 3 — плазмолемма; 4 — цитоплазма; 5 — ядро; 6 — миосимпласт
Данное строение необходимо для преодоления инерции связанных с мышцей частей скелета и быстрого приведения их в движение. Миосимпласт является стержневым компонентом мышечного волокна.
Мышечное волокно включает миосимпласт, базальную мембрану, которая состоит из фибрилл и аморфного вещества. Между базальной мембраной и плазмолеммой располагаются миосателлитоциты. На периферии миосимпласта под плазмосомой находятся ядра. В цитоплазме различают гиалоплазму и структурные компоненты (рис. 3).
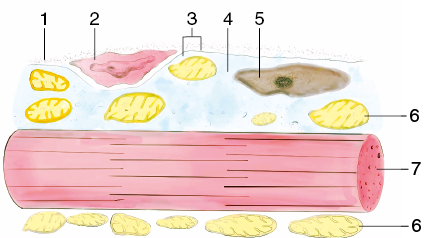
Рис. 3. Схема скелетной мышечной ткани: 1 — базальная мембрана; 2 — миосателлитоцит; 3 — плазмолемма; 4 — цитоплазма; 5 — ядро; 6 — митохондрии; 7 — миофибриллы
Фибриллы базальной мембраны тесно спаяны с эндомизием. Эндомизий представляет собой прослойки соединительной ткани, которая окружает каждое волокно. В них располагаются сосуды и нервы. Сосуды и нервы обеспечивают трофику, регуляцию обменных процессов и функционирование волокон (рис. 4).
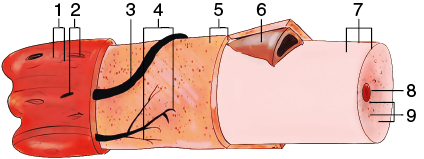
Рис. 4. Структурные компоненты скелетного мышечного волокна: 1 — эндомизий; 2 — ядра фиброцитов; 3 —капилляр; 4 — эфферентное нервно-мышечное окончание (моторное окончание); 5 — базальная мембрана; 6 — миосателлитоцит; 7 — миосимпласт; 8 — ядро; 9 — миофибриллы
Группы мышечных волокон образуют пучки. Снаружи пучки покрыты перимизием. Вся мышца заключена в фасцию (эпимизий) и имеет органный уровень структурной организации (рис. 5). Оболочки мышц выполняют функции защиты, трофики, опоры и формообразования. Они ограничивают деформацию мышц при сокращении, а также обеспечивают их фиксацию к сухожилию или хрящу.

Рис. 5. Строение мышечного пучка: 1 — миофибриллы; 2 — ядро; 3 — сарколемма; 4 — эндомизий; 5 — фасция; 6 — перимизий; 7 — эпимизий; 8 — кровеносные сосуды; 9 — кость; 10 — сухожилие
Генерация силы и движения являются признаками функции поперечнополосатых мышц. Саркомеры представляют собой структуру, которая состоит из двух основных чередующихся наборов белковых нитей: тонких нитей (актин и ассоциированные белки) и толстых нитей (миозин и ассоциированные белки), которые проходят параллельно оси мышечных волокон. Визуально саркомер окружен с каждого конца темной узкой линией, называемой Z-диском. Каждый Z-диск делит пополам более светлую I-полосу. В центре саркомера находится плотная А-полоса, состоящая из толстых нитей, с более светлой Н-зоной. Линия М делит зону Н пополам. Тонкие нити удерживаются вместе в боковом массиве на Z-диске, в то время как M-полоса соединяет толстые нити, как представлено на рис. 6.
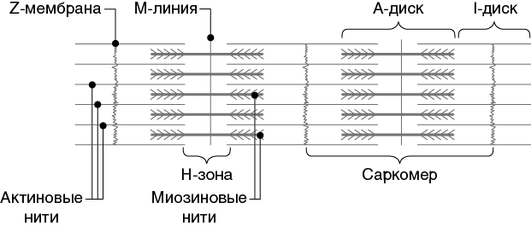
Рис. 6. Схема саркомера мышечного волокна
Одним концом тонкие миофиламенты крепятся к линии Z, другим концом — заходят в диск А примерно на 1/4 его длины. Тонкие миофиламенты образуют обе половины I-диска и участвуют в формировании диска А миофибриллы. Таким образом, однородный филаментозный состав по обе стороны линии Z обеспечивает диску I обычное лучепреломление (изотропность) (см. рис. 6).
Диск А состоит из толстых и тонких миофиламентов. В центральной части диска А находятся только толстые миофиламенты. По ее середине проходит тонкая поперечная линия М. На один толстый миофиламент приходится шесть тонких. Из-за неоднородности филаментозного состава периферических зон возникает эффект двойного лучепреломления (анизотропия) (см. рис. 6). Кроме миозина, в состав толстых миофиламентов входит белок титин. Белок титин доходит до линии Z. Линия Z является своеобразным якорем, который соединяет повторяющиеся саркомеры в линейный массив миофибрилла. В состав линии Z входят различные белки, среди которых находятся α-актинин и титин. α-Актинин является ключевым структурным компонентом и сшивающим белком линии Z. Он также соединяет молекулы титина из противоположных половин саркомера.
Часть миофибриллы, которая заключена между двумя линиями Z, получила название «саркомер». Саркомер включает 1/2 диска I + диск А + 1/2 диска I. Саркомер является сократимой единицей миофибрилл, так как может укорачиваться до половины своей длины. Это достигается благодаря взаимодействию тонких и толстых миофиламентов.
В состав тонких филаментов входят такие белки, как актин, тропомиозин и тропонин (рис. 7).

Рис. 7. Строение тонких филаментов: 1 — комплекс тропонинов; 2 — молекулы тропомиозинов; 3 — актин; TnI — тропонин I; TnC — тропонин С; TnT — тропонин Т
Актин. Тонкие нити состоят из глобулярного белка актина. Молекула актина имеет молекулярную массу около 42 кДа и две формы: мономерную — G-актин и полимеризованную — F-актин. Мономеры актина образуют двойную спиральную цепь. В центре спирали находятся белки тропомиозин и тропонин.
Тропомиозин — это двуспиральный полипептид, намотанный вокруг спирали актина и перекрывающий семь мономеров G-актина (см. рис. 7).
Тропонин (Tn) представляет комплекс из трех глобулярных белков TnI, TnС и TnТ, которые выполняют определенные функции. TnI ингибирует взаимодействие тонких и толстых филаментов за счет связывания актина. TnС связывает Са2+ и тем самым запускает процесс сокращения. TnТ прикрепляет комплекс к тропомиозину (см. рис. 7).
Данные белки обладают регуляторными свойствами. Они связывают активные участки молекул актина, препятствуя их взаимодействию с миозином.
Толстые филаменты представлены белком миозином (рис. 8).

Рис. 8. Строение молекулы миозина: 1 — тяжелая цепь; 2 — легкая цепь; 3 — актин-связывающий участок; 4 — АТФ-связывающий участок; 5 — головка
Миозин. Толстые нити состоят из фибриллярного белка миозина. Миозин составляет 40% всех белков мышечной ткани. Молекула миозина имеет молекулярную массу около 500 кДа. Строение миозина включает длинный продольно ориентированный хвостовой участок и две подвижные головки.
Хвостовой участок миозина состоит из двух полипептидных цепей с молекулярной массой 200–250 кДа (тяжелые цепи). В области каждой головки прикрепляются по две легкие цепи с молекулярной массой 18–28 кДа. Хвостовые участки миозина за счет тяжелых цепей скручены между собой. Это придает им повышенную жесткость. Головки молекул образуют шесть рядов поперечных мостиков. За счет своей подвижности головки миозина обладают способностью вступать в контакт с актином. В результате их взаимодействия происходит образование поперечных мостиков и обеспечивается скольжение нитей актина относительно миозина.
Нервно-мышечный синапс состоит из трех частей: пресинаптической мембраны (1), содержащей медиаторы, синаптическую щель (2) и постсинаптическую мембрану (5), которая содержит рецепторы для медиаторов (рис. 9).
В синапсе располагаются синаптические пузырьки (7), которые предназначены для хранения, высвобождения и поглощения медиатора ацетилхолина (6). При достижении нервного импульса концевой части аксона происходят деполяризация и повышение проницаемости мембраны с последующим выбросом ацетилхолина в синаптическую щель. На поверхности постсинаптической мембраны располагаются никотиновые ацетилхолиновые рецепторы, представленные ионными каналами с субъединицами α, β, γ, δ и ε (3, 4). Ацетилхолин, достигая постсинаптической мембраны, активирует данные рецепторы, создавая локальный потенциал деполяризации. В нормальных физиологических условиях никотиновые ацетилхолиновые рецепторы непроницаемы для ионов Cl—, но пропускают ионы Na+ и K+ и в меньшей степени ионы Са2+ и Mg2+. Величина и направление тока через Na+/K+-каналы зависят от мембранного потенциала. При длительной импульсации содержание ацетилхолина уменьшается, что приводит к нарушению передачи возбуждения в нервно-мышечном синапсе.

Рис. 9. Строение нервно-мышечного синапса: 1 — пресинаптическая мембрана; 2 — синаптическая щель; 3 — ионный канал; 4 — рецептор; 5 — постсинаптическая мембрана; 6 — молекула медиатора; 7 — синаптический пузырек; 8 — митохондрия
Сокращение мышц начинается с активации быстрых Na+ каналов, генерирующих потенциал действия, который передается мышечному волокну, инициируя сокращение. Этот процесс происходит на стыке между двумя мембранными структурами — поперечными канальцами (Т-канальцами) и саркоплазматическими ретикулами. Переданный потенциал нервного действия деполяризует дигидропиридиновый рецептор Т-канальцев, связанный с Са2+-каналом (L-типа). В результате происходит высвобождение большого количества ионов Са2+ из концевых цистерн саркоплазматического ретикулума через рианодиновые рецепторы. Повышение уровня цитозольного Са2+ запускает каскад мышечных сокращений.
На молекулярном уровне саркомерное сокращение представляет собой движение миозиновых головок по актиновым нитям, так называемый кросс-мостовой цикл. Данный процесс — последовательность ферментативных реакций, ответственных за движение головок миозина по актиновым нитям, он генерирует силу внутри каждого отдельного миофибрилла. Сокращение происходит в шесть этапов. Под воздействием ионов Са2+ молекула тропонина меняет свою форму и выталкивает тропомиозин в желобок между двумя нитями актина. Это приводит к освобождению участков для прикрепления миозиновых поперечных мостиков к актину. Головка миозина качается в сторону тонкой нити под углом 45° и находится в жестком состоянии. АТФ связывается с миозином, коротко диссоциируя миозин с актином. АТФазная активность миозина гидролизует АТФ в аденозиндифосфат и ион Р3+, который остается связанным с миозином, заставляя миозиновую нить слабо связывать актин под углом 90° («кросс-мост») относительно актиновой нити. Высвобождение ионов Р3+ инициирует силовой удар. Миозиновая головка вращается на шарнире, проталкивая актиновую нить мимо нее в сторону М-линии. В конце силового удара миозиновая головка высвобождает аденозиндифосфат и восстанавливает свое окоченение.
Возврат ионов Са2+ в цистерны саркоплазматического ретикулума осуществляется против диффузного градиента и является энергозатратным процессом. Источником энергии служит АТФ. Одна молекула АТФ расходуется на возврат двух ионов Са2+ из межфибриллярного пространства в цистерны.
Динамический баланс между скоростью синтеза и деградации сократительных белков обеспечивает здоровье мышечного волокна. Сдвиг этого баланса приводит к заметным изменениям в составе, внешнем виде и характеристике мышечных волокон. Дисбаланс может возникать из-за таких факторов, как воспаление, окислительный стресс, физические упражнения, стероиды и различные заболевания. Основным сигнальным путем, регулирующим мышечную массу и синтез белка, является IGF1-Akt/PKB-mTOR сигнальный путь. Запуск механизма увеличения мышечной массы начинается с процесса связывания инсулиноподобного фактора роста 1 (IGF1) со своим рецептором IGF1R. Центральным компонентом в этом каскаде выступает протеинкиназа B, которая контролирует синтез белка через киназы млекопитающих — мишени рапамицина (mTOR) и киназы гликогенсинтазы 3β. Связывание IGF1 с его рецептором приводит к активации его внутренней тирозинкиназы и аутофосфорилированию с образованием фосфоинозитид-3,4,5-трифосфата из фосфоинозитида-4,5-бифосфата. Клинически гипертрофия характеризуется как увеличением числа миоцитов (гиперплазией), так и увеличением их размеров (гипертрофией). Гипертрофия характерна для клинически сильной и здоровой «тренированной» мышцы (например, у спортсменов) и при такой патологии, как врожденная миотония.
Скелетная мышца является стабильной тканью в нормальных условиях, но обладает замечательной способностью восстанавливаться после травмы. Регенерация скелетных мышц — это высокоорганизованный процесс, включающий активацию различных клеточных и молекулярных реакций. Способность к регенерации в значительной степени определяется взаимодействием клеток-сателлитов с микроокружением («нишей»).
Регенерация мышц проходит в три основных этапа: воспалительная реакция, активация, дифференцировка, слияние сателлитных клеток и созревание, ремоделирование новообразованных миофибрилл.
Этап дегенерации мышц начинается с некроза поврежденных мышечных волокон. Этот процесс инициируется растворением сарколеммы миоволокон, что приводит к повышению их проницаемости. Нарушение целостности миоволокон отражается повышением уровня мышечных белков и микроРНК, таких как КФК и miR-133a в плазме крови. Некроз миоволокон сопровождается усилением притока ионов Са2+, что, в свою очередь, активирует кальцийзависимый протеолиз и приводит к дегенерации тканей с последующим расщеплением миофибриллярных и цитоскелетных белков. Кроме этого, происходит активация комплемента и запускается воспалительная реакция, приводящая к миграции лейкоцитов к месту повреждения.
Следующим этапом регенерации является комплекс процессов, которые начинаются с активации клеток-сателлитов под воздействием структурных и биологических сигналов, поступающих из микроокружения. По данным H. Yin и соавт. (2013), экспрессия MYOD1, MYOG и MYF5 регулирует и поддерживает пролиферацию клеток-сателлитов. После ограниченных циклов пролиферации большинство сателлитных клеток входит в программу миогенной дифференцировки и начинает сливаться с поврежденными миофибрами или друг с другом, образуя новые миофибриллы.
На третьем этапе регенерации мышц вновь образованные миоволокна увеличиваются в размерах. В нормальных условиях регенерированные мышцы морфологически и функционально неотличимы от неповрежденных.
Когда баланс синтеза и деградации все больше смещается в сторону деградации белка в ответ на различные стимулы, включая вирусную и бактериальную инфекции, воздействие провоспалительных цитокинов, окислительные и биомеханические стрессы, мышцы атрофируются. Атрофия мышц характеризуется истощением или потерей мышечной массы, которая сопровождается уменьшением площади поперечного сечения мышечного волокна, объема мышц и количества мышечного белка. Атрофия мышц может возникать по различным причинам, таким как болезнь, травма и длительные периоды неподвижности (иммобилизация конечностей, космический полет). По данным проведенных исследований было установлено, что процесс атрофии мышц запускается с помощью убиквитин-протеасомной системы. Главными регуляторами атрофии мышц являются атрогин-1 и MURF1. Они представляют собой две лигазы убиквитина E3 системы убиквитин–протеасома, с фактором инициации eIF3f и миозиновыми цепями в качестве основных субстратов.
Изменения мышечной ткани отчетливо проявляются в период постнатального роста, когда происходят их удлинение и утолщение. Это необходимо для сохранения соразмерности с растущим скелетом. Процессы удлинения и утолщения мышечной ткани протекают за счет гипертрофии. После 40 лет начинается процесс истончения мышечной ткани. К 60 годам появляются признаки старческого изменения — разрастание соединительной ткани, частичная дегенерация и атрофия мышечных волокон с утратой эластичности и упругости.
24.11.2022 | 13:35:23