Гипоталамо-гипофизарная система. Общие принципы функционирования.
Раздел:
Статьи
/ Базовые науки
/ Физиология и патологическая физиология.
/ Гипоталамо-гипофизарная система. Общие принципы функционирования.
Содержание
- Введение
- Некоторые аспекты анатомии и физиологии гипоталамо-гипофизарной системы
- Механизмы взаимного влияния и ко-регуляции звеньев гипоталамо-гипофизарной системы
- Функции и особенности регуляции гормонов гипофиза
- Нарушения функционирования гипоталамо-гипофизарной системы
- Особенности клинической картины гипопитуитаризма
- Заключение
Человеческий организм характеризуется удивительной сложностью организации и взаимодействия между различными звеньями составляющих его систем.
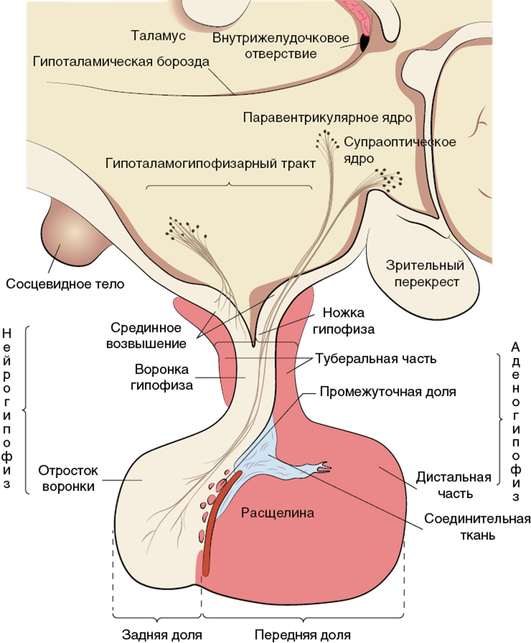
Важнейшую роль в поддержании гомеостаза и гармоничного функционирования организма играет адекватное взаимодействие звеньев эндокринной системы. Первостепенное значение в соблюдении иерархии органов внутренней секреции имеет гипофиз — орган, малый размер которого несопоставим с его огромной ролью. Гипофиз представляет собой мозговой придаток, размером от 5 до 13 мм и массой около 500 мг, расположенный на нижней поверхности головного мозга в углублении клиновидной кости, называемом турецким седлом. Гипофиз состоит из двух крупных долей, различных по происхождению и структуре: передней — аденогипофиза (составляет 70–80% массы органа) и задней — нейрогипофиза. Гипофиз находится в тесной иерархической связи с гипоталамусом — нейроэндокринным органом, который является связующим звеном между эндокринной и вегетативной нервной системой. Гипофиз и гипоталамус вместе формируют уникальную гипоталамо-гипофизарную систему, осуществляющую контроль слаженности эндокринной, поведенческой и автономной реакции организма, что достигается посредством модификации активности периферических желез в ответ на изменяющиеся условия внешней и внутренней среды. Анатомия гипоталамо-гипофизарной области представлена на рис. 1.
Координация работы эндокринных органов под началом гипоталамо-гипофизарной системы обеспечивается тесной анатомической и функциональной связью гипоталамуса и гипофиза. В начале ХХ в. сделаны открытия, продемонстрировавшие способность нейронов гипоталамической области мозга секретировать биологически активные вещества, сходные с гормонами по механизму выделения из клетки и действия на клетки-мишени. Этот феномен получил название нейросекреции.
Гипотезу о том, что нервные клетки наделены секреторной функцией, впервые сформулировали Ernst Scharrer и Berta Scharrer в 1928 г., основываясь на результатах исследований нейронов преоптического ядра гипоталамуса рыб. Позднее аналогичный феномен был описан в нейронах супраоптического и паравентрикулярного ядер гипоталамуса млекопитающих.
Среди тех, кто занимался вопросами гипоталамо-гипофизарной регуляции, особое место занимают A. Schally и R. Guillemin. В 1977 г. им присуждена Нобелевская премия в области медицины за открытие пептидных гормональных рилизинг-факторов.
Результатом проведенных исследований и экспериментальных работ стало формирование фундаментальной концепции о роли гипоталамо-гипофизарной регуляции как дирижера эндокринной системы организма.
Гипофиз — железа внутренней секреции, овальной или шаровидной формы, заключенная в капсулу, располагается в гипофизарной ямке турецкого седла клиновидной кости. Размеры и масса гипофиза индивидуальны, в среднем: переднезадний — 5–11 мм, вертикальный — 6–9 мм, поперечный — 12–14 мм; масса гипофиза составляет примерно 0,4–0,9 г, несколько больше у женщин, чем у мужчин, в период полового созревания и после менопаузы он несколько увеличивается, во время беременности размеры гипофиза могут увеличиваться в любом направлении, а масса может возрастать до 1 г.
К слову, вес синего кита — около 150 т, а его гипофиз весит всего 34 г — вне зависимости от габаритов живого организма размер гипофиза остается несоизмеримо меньшим. Удивительно: столь, казалось бы, незначительная структура играет роль дирижера оркестра эндокринных желез организма!
Турецкое седло, вмещающее гипофиз, расположено в основании черепа. Вход в турецкое седло прикрыт диафрагмой, которая натягивается между передними и задними наклоненными отростками клиновидной кости и спинкой седла и срастается с оболочкой гипофиза. Ножка гипофиза, проходящая через отверстие в диафрагме турецкого седла, обеспечивает анатомическую и функциональную связь гипоталамо-гипофизарной системы. К боковым стенкам турецкого седла, образованным костной тканью или твердой мозговой оболочкой, примыкают венозные пещеристые синусы, сквозь которые проходят внутренние сонные артерии и III, IV, VI пары черепных нервов, а также ветви V пары черепных нервов — I (лобная) и II (максиллярная). Непосредственно над турецким седлом и под гипоталамусом нервные волокна, идущие от назальной части сетчатки каждого глаза, образуют зрительный перекрест.
В строении гипофиза выделяют две основные доли: переднюю — аденогипофиз и заднюю — нейрогипофиз, а также промежуточную (вставочную) долю.
Аденогипофиз условно можно разделить на три отдельные части: дистальную (передняя доля), промежуточную (промежуточная доля) и бугорную. У взрослых людей различаются только рудиментарные остатки промежуточной доли в виде отдельных скоплений клеток, распределенных в передней и задней долях.
Передняя и промежуточная доли гипофиза развиваются из эпителия дорсальной стенки ротовой полости зародыша, которая имеет вид пальцевидного выроста (карман Ратке). Клетки-предшественники в составе кармана Ратке в процессе своего развития проходят этапы органной дифференциации, пролиферируют, мигрируют и приобретают гипофизарный фенотип. Карман Ратке закрывается растущими долями гипофиза и впоследствии превращается в щель Ратке. Это небольшое пространство может сохраняться у взрослого человека в виде кисты. Рост и пролиферация эпителия, которым выстланы эти кисты, могут приводить к формированию новообразований гипофиза — краниофарингиом.
Бугорная часть аденогипофиза представляет собой тонкий листок железистой ткани, расположенный вокруг воронки гипоталамуса и ножки гипофиза. Физиологическая роль бугорной доли окончательно не установлена, однако известно, что в этой структуре экспрессируются рецепторы мелатонина.
Аденогипофиз интенсивно кровоснабжается, его основным сосудом является верхняя гипофизарная артерии, представляющая собой ветвь внутренней сонной артерии. Эндотелий капилляров гипофиза имеет фенестры — отверстия диаметром до 0,1 мкм, которые свободно пропускают гипоталамические рилизинг-гормоны. Дальнейший транспорт веществ из капилляров в срединное возвышение осуществляется беспрепятственно, в связи с расположением срединного возвышения вне гематоэнцефалического барьера. Капилляры гипофиза, сливаясь, образуют 6–10 прямых вен, формирующих гипоталамо-гипофизарую портальную систему, играющую важную роль в реализации механизма обратной связи.
Нейрогипофиз состоит из нервной доли (известна как задняя или невральная доля), воронки гипоталамуса и срединного возвышения. Воронка гипоталамуса окружена бугорной частью, совместно они образуют ножку гипофиза. Кровоснабжение нейрогипофиза осуществляется из нижней гипофизарной артерии, которая является ветвью внутренней сонной артерии.
Остаточные участки гипофиза в редких случаях сохраняются внутри или ниже основной кости, отделяющей гипофиз от ротовой полости, и могут проявлять гормональную активность или трансформироваться в образования с различным потенциалом злокачественности.
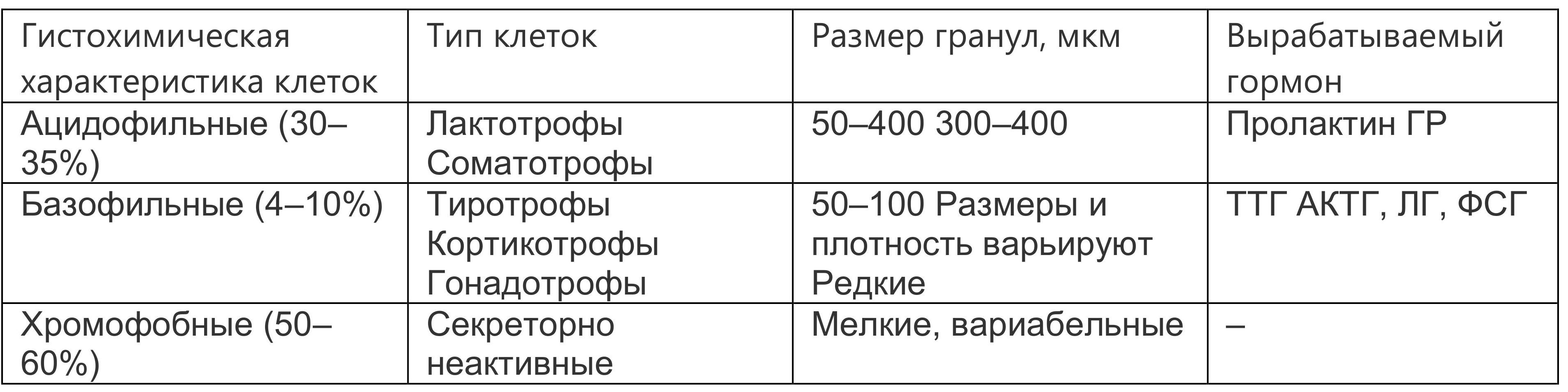
Гистохимическими, электронно-микроскопическими и иммунофлюоресцентными методами были выделены типы клеток аденогипофиза, обладающие секреторной активностью, а также гормонально неактивные клетки (табл. 1).
Таблица 1. Функциональная и морфологическая характеристика клеток аденогипофиза
Гипоталамо-гипофизарная система представляет собой уникальную функциональную единицу, контролирующую активность периферических эндокринных желез.
Физиологической основой контролирующей функции гипоталамуса является феномен нейросекреции. Механизм его действия опосредуется нейронами, секретирующими биологически активные вещества непосредственно в гипофизарный кровоток, где они выполняют функции гормонов. Эти нейроны, называемые нейросекреторными клетками, получают афферентные импульсы от других частей нервной системы, а их аксоны оканчиваются на кровеносных сосудах. Типичными примерами нейросекреторных клеток являются нейрогипофизарные и гипофизотропные клетки гипоталамуса. Большинство сигналов между нейронами переносят «классические» быстродействующие трансмиттеры, такие как глутаминовая кислота и ацетилхолин.
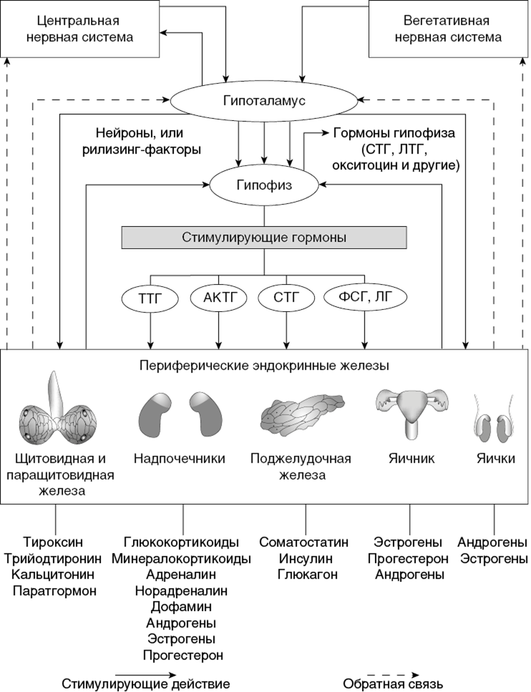
Гипоталамус воспринимает разнородные по происхождению сигналы — как внешние, так и внутренние, и обеспечивает адекватный нейрогормональный ответ посредством активации ключевых регуляторных систем. Этими системами являются кора головного мозга, моторные и премоторные нейроны спинного мозга, лимбические структуры и главным образом передняя и задняя доли гипофиза. Основой регуляторного воздействия на гипофиз считаются вырабатываемые гипоталамусом рилизинг-факторы: стимулирующие — либерины (кортиколиберин, соматолиберин, тиролиберин, гонадотропин-рилизинг-гормон) и ингибирующие — статины (соматостатин, дофамин). Указанные факторы обладают плюрипотентным действием: соматостатин ингибирует секрецию ГР, ТТГ и многих негипофизарных гормонов. Дофамин подавляет секрецию ТТГ, гонадотропинов и пролактина.
Регуляция гипоталамо-гипофизарной системы происходит в соответствии со строгим иерархическим принципом. Функционирование гипоталамуса опосредуется комплексом внешних и внутренних триггерных воздействий, приводящих к выработке рилизинг-факторов. Данные вещества оказывают соответствующее влияние на гипофиз, активируя или подавляя секрецию его тропных гормонов.
Кроме того, в гипоталамусе образуются вазопрессин и окситоцин, транспортируемые по аксонам нейрогипофизарного тракта в заднюю долю гипофиза, а оттуда — в кровеносное русло. Полноценный контроль работы гипофиза осуществляется тремя взаимосвязанными факторами: влиянием гипоталамуса, обратной связью циркулирующих в крови гормонов и собственной паракринной секрецией гипофиза.
Гипоталамус, гипофиз и периферические железы тесно взаимосвязаны между собой обратными регуляторными взаимосвязями (рис. 2). Результатом комплексного взаимодействия звеньев гипоталамо-гипофизарной системы является пульсаторная секреция шести тропных гормонов гипофиза: адренокортикортикотропного, соматотропного, тиреотропного, лютеинизирущего, фолликулостимулирующего гормонов и пролактина. Эти гормоны через пещеристый синус, каменистые вены и верхнюю полую вену проникают в большой круг кровообращения и транспортируются через системный кровоток по всему организму.
1. Основной функцией тиреотропного гормона является стимуляция синтеза и секреции гормонов щитовидной железы — тироксина и трийодтиронина.
Содержание ТТГ в плазме крови носит циркадный характер. Максимальная интенсивность секреции приходится на период между 9 ч вечера и 5 ч утра, минимальная — между 16 и 19 ч вечера. Интенсивность секреции ТТГ обратно пропорциональна содержанию тиреоидных гормонов, любые отклонения от контрольной точки — нормальной концентрации тиреоидных гормонов в плазме крови в покое — приводят к соответствующим изменениям секреции ТТГ.
Выработка ТТГ контролируется антагонистическими рилизинг-факторами гипоталамуса — тиролиберином и соматостатином. Обратная отрицательная связь осуществляется тиреоидными гормонами Т3 и Т4, действующими на уровне гипофиза: даже острое кратковременное повышение концентраций Т3 приводит к снижению или полному подавлению ответа гипофизарного ТТГ на гипоталамический тиролиберин (ТРГ). ТТГ также оказывает трофический эффект на щитовидную железу, вызывая ее рост.
2. Адренокортикотропный гормон (АКТГ, кортикотропин) регулирует образование глюкокортикоидов (кортизолa), надпочечниковых андрогенoв и кортикостерона (и отчасти альдостерона) в коре надпочечников. Регуляция работы гипоталамо-гипофизарно-надпочечниковой системы также осуществляется по принципу отрицательной обратной связи: увеличение содержания в крови кортизола приводит к снижению уровня АКТГ, при этом кортизол действует на уровне гипофиза: повышение концентраций кортизолa приводит к снижению или полному подавлению ответа гипофизарного АКТГ на гипоталамический кортиколиберин (КРГ). АКТГ также вызывает трофический эффект на кору надпочечников, стимулируя ее рост.
Циркадные ритмы АКТГ и кортизола крайне важны для нормальной жизнедеятельности организма. Содержание кортизола и АКТГ достигает пика рано утром, постепенно снижаясь в течение дня до минимального уровня к полуночи, затем снова происходит подъем между 1 и 4 ч утра. На протяжении всего циркадианного цикла отмечается приблизительно 15–18 выбросов АКТГ, различных по степени в зависимости от времени суток.
Синтез АКТГ находится под регуляторным влиянием гипоталамуса: кортиколиберин усиливает продукцию АКТГ, в то время как соматостатин приводит к снижению его выработки.
3. Соматотропный гормон (СТГ, он же гормон роста, ГР) представляет собой полипептидный гормон, действие которого на органы и ткани опосредуется инсулиноподобным фактором роста-1 (ИФР-1), который вырабатывается в различных органах и тканях, таких как печень (вырабатывается 80% циркулирующего ИФР-1) и почки, хрящи (оказывает аутокринный и паракринный эффекты). ИФР-1 стимулирует синтез белка, продольный рост костей (преимущественно длинных трубчатых, в меньшей степени губчатых) у детей и подростков, оказывает липолитическое и антинатрийуретическое действие.
Секреция СТГ регулируется гипоталамическим рилизинг-гормоном гормона роста (ГРРГ, соматолиберином) и соматостатином (в основном через свои рецепторы к соматостатиновому рецептору (ССТР) 2-го типа (SSR2). Регуляция СТГ необычайно сложна и происходит на разных уровнях: в гипоталамусе и гипофизе по принципу отрицательной обратной связи. Таким образом, секреция СТГ удерживается организмом в контролируемых пределах, физиологическая роль этого до сих пор полностью не изучена, хотя в последние годы были сделаны заметные шаги в этом направлении.
Скорость секреции СТГ изменяется в широких пределах — от максимума, составляющего 2 мг/день в позднем пубертатном периоде, до минимума — 20 мкг/день у лиц старшего возраста и лиц с избыточной массой тела. Содержание соматотропного гормона и ИФР-1 интенсивно возрастает в период полового созревания, что обусловлено увеличением содержания в крови половых гормонов. Пик секреции соматотропного гормона отмечается в ранние ночные часы, одновременно с наступлением медленно-волновой фазы сна. Увеличение концентрации свободных жирных кислот и глюкозы в плазме крови подавляет секрецию соматотропина.
Для ответа на вопрос о взаимодействии гипоталамических регуляторов секреции СТГ соматолиберина и соматостатина Plotsky и Vale создали блестящую модель, разработав методику частого получения крови из ножки гипофиза у крыс. Оказалось, что эти два гормона секретируются гипоталамусом зеркальным образом: выброс СТГ происходит после начала секреции соматолиберина и падения уровня соматостатина в крови. После выброса СТГ уровень соматолиберина снижается, а соматостатина — растет. Если крысам ввести антисыворотку к соматолиберину, то выбросы СТГ исчезают, но межпульсовые концентрации гормона не меняются. Если же ввести антисыворотку к соматостатину, то выбросы СТГ остаются неизмененными, но межпульсовые концентрации гормона вырастают. Таким образом, соматолиберин является главным стимулятором выработки ГР, в то время как соматостатин отвечает за поддержание его низких межпульсовых концентраций.
Jaffe и др. показали, что блокада соматолибериновых рецепторов синтетическим антагонистом у людей полностью блокирует как вызванные соматолиберином, так и спонтанные выбросы ГР. Соматостатин подавляет амплитуду секреции СТГ (при этом частота секреции остается неизменной), контролирует циркадный ритм СТГ (максимальная секреция около полуночи). Isgaard и др. изучали эту проблему на модели гипофизэктомированных, т.е. полностью лишенных ГР самцов крыс. После полного замещения дефицита тироксина и глюкокортикоидов животным назначали одинаковые дневные дозы СТГ либо в виде постоянной инфузии, либо отдельными внутривенными пульсирующими введениями. Оказалось, что только пульсатильный периодический способ введения СТГ поднимает концентрацию мРНК ИФР-1 в хряще длинных костей и мышечной ткани, ускоряя соматический рост. Эта находка была первой, говорящей об очень важном физиологическом принципе — важно не только как много СТГ выделяет гипофиз, но и полноценность его действия. Другими словами, организм может по-разному отвечать не только на количество ГР, вырабатываемого в течение дня, но и на чувствительность к нему в периферических тканях.
Соматотропный гормон обладает двойным действием: через генерацию ИФР-1 он контролирует скорость и интенсивность соматического роста и стимулирует скорость липолиза. Последнее его действие делает продукцию СТГ незаменимым условием сохранения жизни во время голодания. При этом секреция инсулина прекращается, запасы гликогена в печени исчезают в первые 24–48 ч, наступает гипогликемия, и казалось бы, организм должен умереть от недостатка энергии. В этом случае СТГ берет на себя важную роль, повышая скорость липолиза, и источник энергии изменяется с глюкозы на свободные жирные кислоты. S. Surya и др. показали, что пульсатильное введение ГР, повышая скорость липолиза, предотвращает потери белка, а постоянная инфузия тех же дневных количеств повышает печеночную продукцию ИФР-1 и содержание мРНК ИФР-1 в мышцах. Голодание у людей, при котором возрастает необходимость в ускорении скорости липолиза, сопровождается увеличением пульсатильной секреции СТГ, а при акромегалии постоянное повышение СТГ стимулирует продукцию ИФР-1, что вызывает патологический рост тканей. Таким образом, двойная функция СТГ, метаболическая и ростовая, осуществляется специфическими компонентами его секреторного профиля — пульсатильной и базальной.
Ими же определяется половой диморфизм секреции СТГ, но возрастное снижение этого гормона зависит исключительно от подавления секреции гипоталамического соматолиберина. Уточнение взаимодействия гипоталамических факторов и половых гормонов требует дальнейших исследований. Отрицательная обратная связь секреции СТГ также регулируется продуктами этих процессов: циркулирующим ИФР-1, свободными жирными кислотами и глюкозой.
4. Пролактин представляет собой гормон полипептидной природы, секреция которого находится под регулирующим влиянием гипоталамуса. При кажущемся разнообразии функций пролактина у разных видов (было даже предложение назвать гормон «версатилином», от versatile — универсальный, из-за многообразных влияний на различные органы и биохимические процессы), по существу, функция этого гормона ограничена его антирепродуктивным действием, но проявления этого эффекта варьируют между видами: у людей это проявляется гипогонадизмом, выработкой молока (галактореей) и инфертильностью во время лактационного периода; у птиц — поведенческими изменениями (упрямое высиживание яиц, несмотря на сопутствующие опасности голодания и гибели от хищников) и активацией выделения жидкости специальной пищеварительной железой, которая напоминает молоко. У мигрирующих рыб он регулирует водно-солевой обмен, позволяющий им переходить из соленой морской воды в речную пресную и возвращаться обратно в океан (нерест) без опасности обезвоживания или водной интоксикации. Основным ингибитором синтеза пролактина является дофамин. Отростки дофаминергических клеток, находящихся в гипоталамусе, оканчиваются на сосудах воротной системы, таким образом, выделение пролактина гипофизом постоянно находится в состоянии угнетения. Кроме того, секреция пролактина лактотрофами гипофиза стимулируется тиролиберином (ТРГ). Ограниченная роль ТРГ и доминирующее влияние дофамина в регуляции секреции пролактина доказывается разрушением гипоталамуса с полным исчезновением ТРГ и дофамина, которое ведет к снижению ТТГ и повышению пролактина. При прекращении синтеза или секреции дофамина гипоталамическими нейронами, прерывании транспорта его по ножке гипофиза к лактотрофам или блокаде дофаминовых рецепторов на этих клетках концентрация пролактина в крови возрастает. Стимулирующее влияние на синтез пролактина оказывают эстрогены и комплекс гормонов, сопровождающих беременность.
5. Синтез гонадотропинов осуществляется под непосредственным влиянием гипоталамо-гипофизарной системы. Так, в гипоталамусе, осуществляющем над-иерархическое руководство работой эндокринной системы, синтезируется гонадолиберин (гонадотропин рилизинг гормон), основным эффектом которого является стимуляция синтеза и секреции из аденогипофиза лютеинизирующего (ЛГ) и фолликулостимулирующего гормона (ФСГ). Гонадотропины играют ключевую роль в работе репродуктивной системы мужского и женского организма. У женщин ЛГ и ФСГ стимулируют овуляцию, делая возможной возникновение беременности, а также вызывают секрецию эстрадиола и прогестерона в яичниках. У мужчин эффекты ФСГ и ЛГ опосредуются влиянием на клетки Сертоли и на клетки Лейдига в яичках соответственно. Клетки Лейдига отвечают на действие ЛГ выработкой тестостерона, обусловливающего развитие мужских половых признаков, увеличение мышечной массы и плотности костной ткани. ФСГ в мужском организме способствует развитию и адекватному функционированию семенников и семенных канальцев, а также создает условия для нормального сперматогенеза.
Эксперименты на овцах и обезьянах с одновременными частыми заборами крови из ножки гипофиза, несущей кровь из гипоталамуса в гипофиз, и из периферической крови, установили абсолютную зависимость секреторных пульсов ЛГ/ФСГ от выбросов гипоталамического гонадолиберина. Конкордантность пульсов гонадолиберина и ФСГ сложнее определить из-за очень длинной полужизни ФСГ при крайне короткой полужизни гонадолиберина и достаточно короткой полужизни ЛГ.
Серия работ группы J. Marshall и др. объяснила физиологический механизм индукции пульсатильной секреции ФСГ и ЛГ в ответ на гонадолиберин, что важно для понимания процессов полового созревания и синдрома поликистозных яичников. Оказывается, действие гонадолиберина на гонадотрофы зависит от частоты его пульсов. Давно известно, что только периодические инъекции гонадолиберина стимулируют половое созревание, восстанавливают регулярные менструальные периоды у женщин с дефицитом гонадолиберина и индуцируют нормальный сперматогенез и тестостерон крови у мужчин с синдромом Каллмана. Однако постоянная инфузия гонадолиберина или применение длительно действующих агонистов гонадолиберина вызывает гипогонадизм у обоих полов и полную блокаду действия пульсов гонадолиберина. Это широко применяется в лечении преждевременного полового созревания у детей, а также эндометриоза, рака молочной железы и простаты (химическая кастрация).
Сразу после менструации ФСГ продолжает выделяться на низконормальном уровне, а частота ЛГ пульсов начинает ускоряться, это способствует отбору фолликула, его созреванию и в итоге — к овуляции, с массивным выбросом ЛГ и ФСГ. После этого желтое тело начинает выделять прогестерон, который замедляет частоту пульсов гонадолиберина и способствует повышению ФСГ, подготавливающий яичники к действию ЛГ. Падение уровня прогестерона в случае ненаступления беременности десенситизирует клетки гипоталамуса, частота пульсов секреции гонадолиберина ускоряется, и цикл начинается сначала. Оставшееся повышение ФСГ во время менструации рекрутирует следующий фолликул и участвует в его созревании. У женщин с синдромом поликистозных яичников гипоталамус менее чувствителен к прогестерону, частота пульсов не снижается, ЛГ продолжает свою пульсаторную секрецию, но синтез ФСГ уменьшен, в связи с чем регулярность менструального цикла нарушается. Причиной отсутствия подавления пульсов гонадолиберина на данном этапе считается снижение чувствительности гипоталамического центра генерации гонадолиберина к прогестерону, что ассоциируется с гиперандрогенией. Вероятно, поэтому антагонист андрогенных рецепторов, флютамид, может восстановить нормальную цикличность у женщин с синдромом поликистозных яичников.
6. Нейрогипофиз является структурной и функциональной единицей, состоящей из трех частей: супраоптического (nucleus supraopticus) и паравентрикулярного (nucleus paraventricularis) ядер гипоталамуса, которые содержат тела крупноклеточных нейросекреторных нейронов, синтезирующих АДГ и родственный ему гормон окситоцин; супраоптического-гипофизарного тракта, составляющего ножку гипофиза и несущего в себе аксоны этих нейронов; задней доли гипофиза, где аксоны крупноклеточных нейронов заканчиваются на капиллярах нижней гипофизарной артерии.
Гипоталамо-гипофизарная система участвует в регуляции водного баланса. Головной мозг способен воспринимать минимальные изменения концентрации натрия крови благодаря наличию специальных пор в гематоэнцефалическом барьере, которые позволяют плазме крови проникать к осморецепторным клеткам субфорникального органа и сосудистому телу терминальной пластины переднего гипоталамуса (рис. 3, 4).
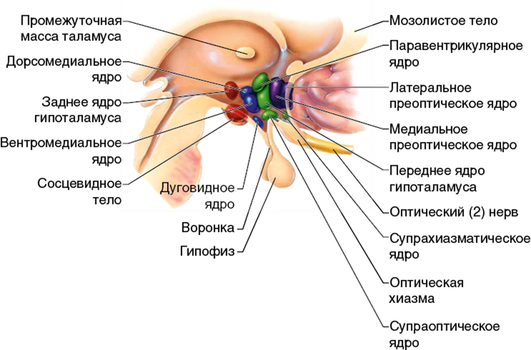
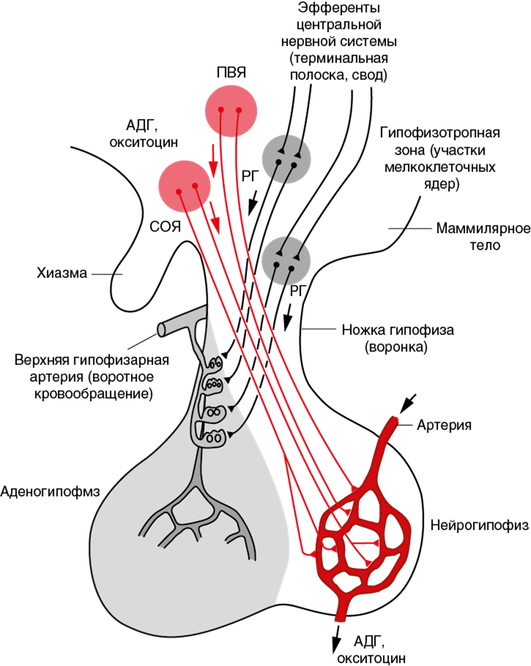
При повышении осмоляльности плазмы крови эти гипоталамические ядра деполяризируют, посылая нервные импульсы через срединное ядро в супраоптические и паравентрикулярные ядра, которые и являются местами синтеза АДГ в виде предшественника, препровазопрессина, представляющего собой последовательно соединенные N-концевой сигнальный пептид (копептин), АДГ, нейрофизин II и C-концевой пептид. По мере продвижения по аксонам препровазопрессин расщепляется на элементы, которые затем секретируются в кровь в эквимолярных количествах, что позволило разработать более точные методы определения секреции АДГ с помощью определения более стабильной части прогормона — копептина.
После секреции АДГ переносится с током крови от задней доли гипофиза к клеткам дистального нефрона, где связывается с вазопрессиновыми рецепторами 2-го типа (V2), рецепторами на базолатеральной мембране основных клеток собирательного тракта почек. Связывание АДГ с рецептором приводит к формированию внутриклеточного каскада с вовлечением цАМФ, который приводит к движению везикул с аквапорином-2 (AQP-2, транспортный белок клеточной мембраны для воды) и их встраиванию в апикальную мембрану клеток, обращенную в сторону первичной мочи. AQP-2 представляет собой АДГ-зависимый канал для молекул воды, контролирующий проницаемость для воды клеточной мембраны собирательного тракта. Его встраивание позволяет воде из первичной мочи, находящейся в собирательных трубочках нефрона, проходить через апикальную мембрану в клетку к базолатеральной мембране, где вода реабсорбируется посредством встроенных в мембрану AQP-3 и AQP-4 в кровоток. Реабсорбция воды из собирательных трубочек осуществляется в направлении градиента концентрации, формирующегося в интерстиции почек за счет накопления в нем мочевины и ионов натрия, что концентрирует мочу и снижает объем диуреза. Реабсорбированная вода восстанавливает осмоляльность крови до нормальных значений.
7. Окситоцин также производится в магноклеточных нейронах гипоталамуса, располагающихся в супраоптическом и паравентрикулярном ядрах гипоталамуса. Гормон отличается по строению от вазопрессина всего двумя аминокислотными остатками. Секреция окситоцина крупноклеточными нейронами гипоталамуса играет важную роль в процессе родов, способствуя сокращению миометрия и мускулатуры матки (по мере увеличения сроков беременности чувствительность миометрия возрастает). Кроме этого, окситоцин воздействует на рецепторы миоэпителиальных клеток молочных желез, приводя к выделению молока в период лактации.
Гипоталамус обеспечивает гомеостаз, координирует работу нервной, эндокринной и иммунной систем, регулирует не только сложные мотивационные процессы, но и функционирование всех органов и систем организма. Изменение какого-либо звена гипоталамо-гипофизарной оси приводит к нарушению баланса всей эндокринной системы организма.
Возникновение большинства патологических состояний обусловлено недостатком или избытком гормонов, генетическими дефектами их синтеза или изменениями в клетках-мишенях.
При недостатке гормонов гипофиза клиническая картина обусловлена выпадением функций нескольких (гипопитуитаризм) или всех (пангипопитуитаризм) гормонов гипофиза. Выделяют первичную, вторичную и третичную гормональную недостаточность. При развитии клинических симптомов гипофункции, обусловленной разрушением периферической эндокринной железы, говорят о первичной недостаточности железы. В случаях, когда клиническая симптоматика связана с дефицитом тропного гормона гипофиза, принято говорить о вторичной недостаточности, а при гипофункции, вызванной недостатком гипоталамических стимуляторов соответствующих гипофизотропных гормонов, — о третичной недостаточности.
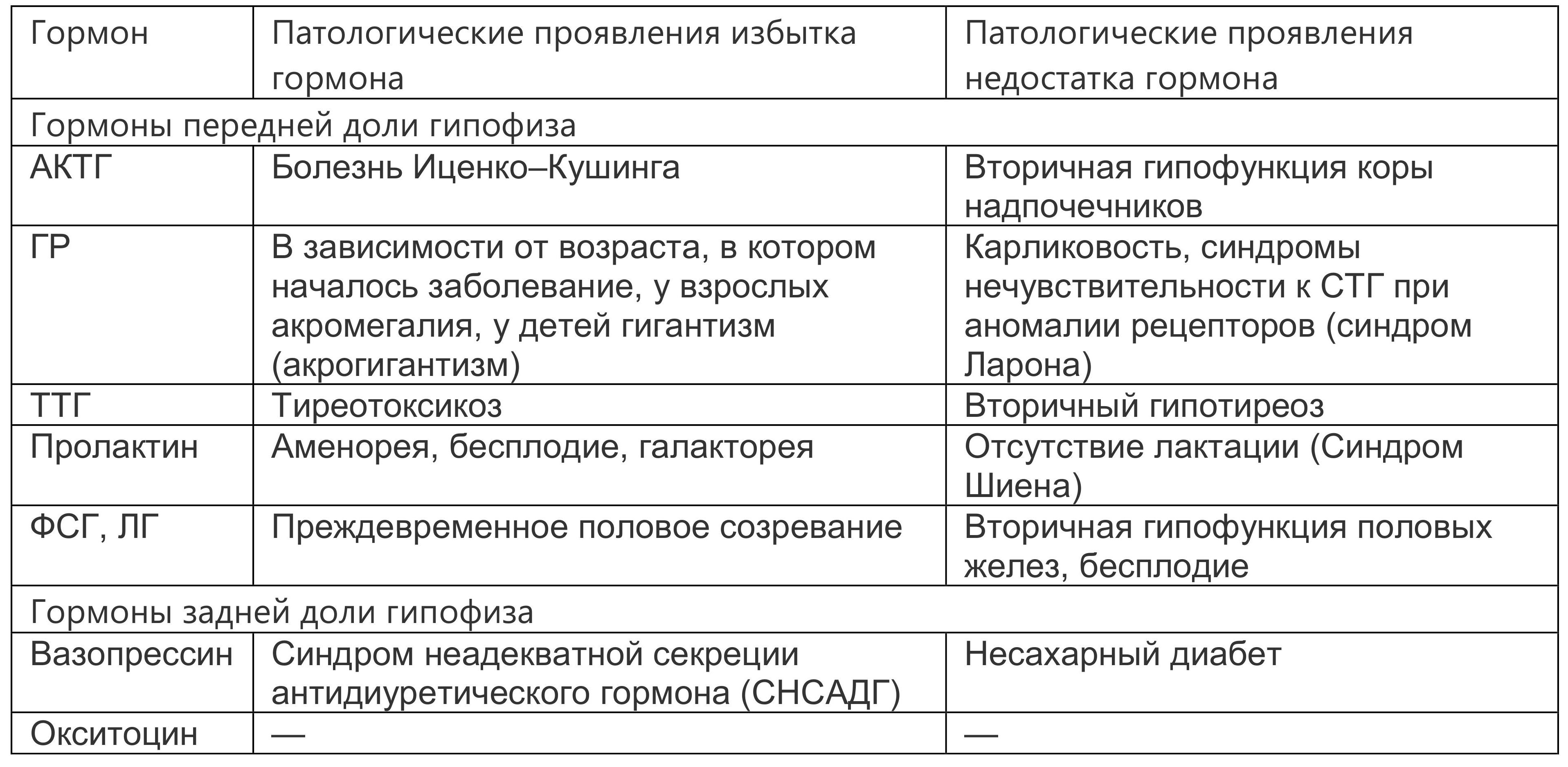
Основные клинические синдромы, развивающиеся вследствие нарушения функционирования гипоталамо-гипофизарной системы, представлены в табл. 2.
Таблица 2. Клинические синдромы, развивающиеся вследствие нарушения функционирования гипоталамо-гипофизарной системы
Гипопитуитаризм — заболевание, обусловленное снижением секреции тропных гормонов аденогипофиза, проявляющееся функциональной недостаточностью соответствующих периферических эндокринных желез. Развитие гипопитуитаризма обусловлено непосредственным повреждением гипофиза или ослаблением стимулирующего воздействия гипоталамуса. Заболевание наблюдается при разрушении 70–75% клеток аденогипофиза, пангипопитуитаризм — в случае поражения 90% клеток.
В зависимости от клинических проявлений выделяют изолированный гипопитуитаризм (при выпадении одной тропной функции), частичный или парциальный (в случае нарушения нескольких, но не всех тропных функций), а также пангипопитуитаризм (выпадение регулирующего воздействия всех гормонов гипофиза).
Нейрохирургическое вмешательство или кровоизлияние в гипофиз обусловливают быструю манифестацию болезни, нередко в течение нескольких часов, и тяжесть состояния связана главным образом с надпочечниковой недостаточностью, требующей незамедлительной заместительной терапии.
Многообразие клинических проявлений гипопитуитаризма определяется различными эффектами тропных гормонов и степенью их дефицита.
Снижение продукции СТГ подавляет интенсивность обменных процессов. В результате количество висцерального жира и уровня холестерина в крови увеличивается, а мышечная масса и минеральная плотность кости уменьшаются, кожа становится сухой и истонченной. Характерна склонность к апатии, депрессии, снижение самооценки и способности к социальной адаптации.
Гонадотропная недостаточность, или гипогонадотропный гипогонадизм (ГГ), у женщин проявляется нарушением менструального цикла (олиго-, опсо-, аменорея), бесплодием, атрофическими изменениями слизистой оболочки влагалища и урогенитальными расстройствами вплоть до недержания мочи, уменьшением полового оволосения, гипоплазией молочных желез, снижением либидо. Дефицит гонадотропинов у мужчин также вызывает снижение половой функции, атрофию гонад, уменьшение оволосения на лице и теле, возможна гинекомастия. Независимо от половой принадлежности, гипогонадизм способствует развитию остеопороза и раннего атеросклероза, сопровождается потерей интереса к окружающему миру и к себе.
Характерными симптомами недостаточности тиреотропного гормона, обусловливающей вторичный гипотиреоз, являются сонливость, вялость, заторможенность, зябкость, снижение интеллектуальной и физической активности, сухость и бледность кожи, пастозность, выпадение волос на голове и наружных частях бровей, склонность к брадикардии, запоры.
К признакам снижения продукции АКТГ с развитием вторичной надпочечниковой недостаточности относятся общая слабость, утомляемость, уменьшение аппетита вплоть до тошноты и рвоты, похудение, снижение артериального давления, склонность к гипогликемии. Самочувствие пациентов ухудшается при эмоциональных и физических нагрузках.
Центральный несахарный диабет сопровождается увеличенной продукцией разбавленной мочи с повышенной осмоляльностью и натрием крови, что особенно драматично в отсутствие доступа к питью.
Гипоталамус и гипофиз составляют единую морфофункциональную гипоталамо-гипофизарную систему, регулирующую различные физиологические процессы организма. В работе данной системы выделяются четыре важнейшие оси: гипоталамо-гипофизарно-тиреоидная, гипоталамо-гипофизарно-надпочечниковая, гипоталамо-гипофизарно-яичниковая/яичковая и гипоталамо-гипофизарно (ГР) — периферическая (ИФР-1). При нарушении любого уровня в нейрогипофизарной системе развиваются сложные многокомпонентные синдромы, обусловленные недостатком либо избытком гормонов периферических желез, приводящие к дезорганизации систем организма, коррекция которых требует тщательного подхода.
16.08.2022 | 23:36:09