Эндометриоз. Наружный генитальный эндометриоз. Причины, патогенез, клиника, диагностика и лечение эндометриоза.
Раздел: Статьи
/
Акушерство и гинекология
/
Гинекология
/
Эндометриоз. Наружный генитальный эндометриоз. Причины, патогенез, клиника, диагностика и лечение эндометриоза.
Содержание
- Введение
- Патогенез наружного генитального эндометриоза
- Вопросы, которые в настоящее время продолжают обсуждаться ведущими исследователями
- Клиническая симптоматика
- Причины бесплодия при наружном генитальном эндометриозе
- Диагностика наружного генитального эндометриоза
- Лечение наружного генитального эндометриоза
Эндометриоз — дисгормональное, иммунозависимое, генетически обусловленное заболевание, характеризующееся доброкачественным разрастанием ткани, сходной по морфологическому строению и функции с эндометрием, но находящейся за пределами полости матки.
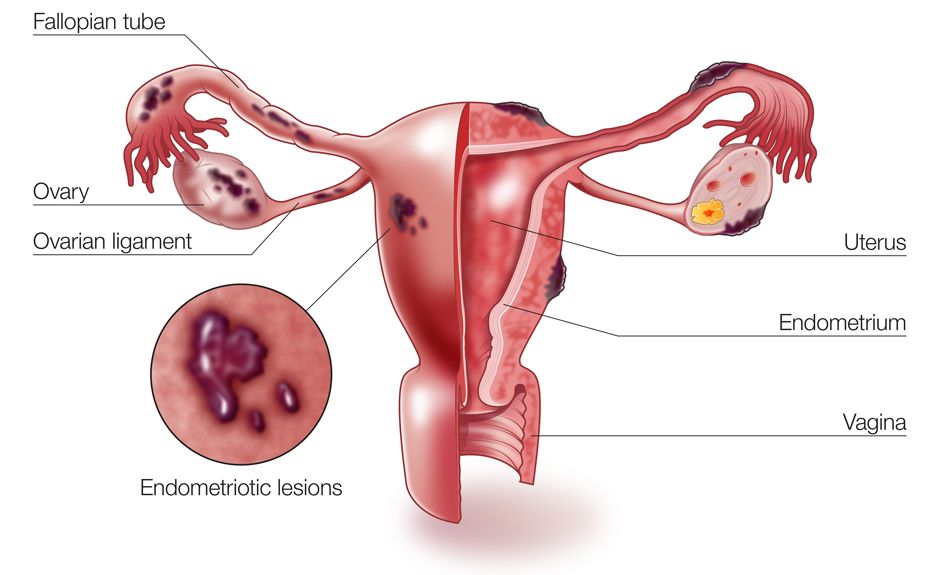
Частота НГЭ вариабельная, поскольку верификация диагноза некоторых форм (перитонеальных без формирования кист) возможна только при лапароскопии и составляет примерно 10% в популяции, 46–49% при эндометриоз-ассоциированном бесплодии и до 70–75% при синдроме тазовых болей (Адамян Л.В. и соавт., 2011).
По данным Adamson et al. (2010), до 176 млн женщин в возрасте от 15 до 49 лет болеют эндометриозом, 117 млн — до 30 лет и 35 млн — до 19 лет. 20% случаев этого заболевания приходятся на возраст от 11 до 18 лет, 64% женщин были в возрасте моложе 30 лет [Global Study of Women’s Health — поперечное исследование с проспективным набором участниц (16 клинических центров в 10 странах, 1418 женщин с подтвержденным лапароскопически эндометриозом в возрасте 18–45 лет)]. Становится очевидным, что проблема эндометриоза не только медицинская, но и социальная, отрицательно влияющая на здоровье, качество жизни и трудоспособность.
Более 100 лет многочисленные исследования посвящены вопросам патогенеза эндометриоза. Наиболее значимыми являются работы Karl Rokitansky (1860), T.S. Cullen (1896), J.A. Sampson (1921), Gruenwald P. (1942), Batt R. Yen J. (2013): метапластическая, дизонтогенетическая, транслокационная (имплантационная) теории. В дальнейшем были выдвинуты другие гипотезы: гематогенная — объясняет развитие экстрагенитальных форм эндометриоза, иммунологическая — на фоне снижения функции NK-клеток, экспрессии провоспалительных цитокинов — IL 6, 8, 1β, TNFα.
Но ни одна из этих теорий не объясняет механизмов имплантации и превращения эндометриальной клетки в эндометриоидную гетеротопию.
Одна из последних гипотез предполагает наличие белка αΒ-cristallin теплового шока, который предотвращает необратимое скопление денатурированных белков, относится к онкогенным белкам, подавляет апоптоз, стимулирует ангиогенез в опухолевой ткани.
Содержание αΒ-cristallin в крови было в 10 раз выше у пациенток с НГЭ. Полагают, что определение экспрессии αΒ-cristallin является прогностически значимым для наступления беременности.
В 2018 г. Kachn K. предложил новую гипотезу возникновения эндометриоза — бактериальная контаминация. По этой теории важная роль отводится врожденной иммунной системе.
Исследования врожденной иммунной системы показали, что микробные патогены распознаются Toll-подобными рецепторами (TLR). Они экспрессируются на макрофагах, дендритных клетках, нейтрофилах, натуральных киллерах и эпителиальных клетках органов репродуктивного тракта. Лигандами к TLR4 являются эндотоксины и липополисахариды грамотрицательных бактерий. Активация TLR4 способствует экспрессии ряда цитокинов, хемокинов, факторов роста (Kachn K., 2008). Развитие и прогрессирование эндометриоза запускается и поддерживается путем повышения концентрации липополисахаридов, что сопровождается ежемесячной активацией врожденного иммунитета.
Под влиянием генетических и эпигенетических факторов клетки эндометрия, попадая в брюшную полость, развиваются как очаги эндометриоза (Koninckx P., 2018). Современная теория (Koninckx P. и соавт., 2019): эндометриоз запускается совокупностью генетически-эпигенетических инцидентов, кофактором которых является инфекция, усиливающая окислительный стресс и изменяющая иммунные реакции как в эутопическом, так и эктопическом эндометрии.
Одним из механизмов развития эндометриоза может быть рефлюкс менструальной крови с клетками эндометрия, содержащими популяцию взрослых стволовых клеток. Очаги эндометриоза могут иметь клональное происхождение из популяции взрослых стволовых клеток.
Показано, что эндометриоз — эстроген-зависимое заболевание (Bulun et al., 2002). Эстрогены являются мощными стимуляторами ангиогенеза, который осуществляется путем прямого повышения экспрессии сосудистого эндотелиального фактора роста (Hyder et al., 2000; Mueller et al., 2000). Существует несколько путей накопления эстрогенов в эндометриоидной ткани, большинство которых повышают ангиогенез. Важная роль отводится экспрессии ароматазы, которая обусловлена стимуляцией PGE2.
В нормальной эутопической ткани эндометрия два фермента определяют конверсию эстрогенов:
• 17-гидроксидегидрогеназа 1-го типа превращает эстрон в эстрадиол;
• 17-гидроксидегидрогеназа 2-го типа превращает эстрадиол в эстрон.
В эндометриоидной ткани экспрессия фермента, который превращает эстрадиол в эстрон, снижена или отсутствует, поэтому уровень эстрадиола выше, чем в эутопическом эндометрии. Локальная гиперэстрогения — дополнительная стимуляция пролиферации эндометриоидных очагов (Balan S.E., 2007).
Сохранение овариального резерва у больных эндометриозом — очень важный аспект проблемы.
Потенциал функции яичников, отражающий количество и качество фолликулов, называют овариальным резервом. Наиболее информативным является определение в сыворотке крови антимюллеровского гормона (АМГ). АМГ продуцируется максимально в клетках гранулезы и малых антральных фолликулах и минимально в конечных стадиях фолликулогенеза. АМГ теснее связан с количеством антральных фолликулов [по ультразвуковому исследованию (УЗИ)] чем с уровнем ингибина Β и фолликостимулирующего гормона (ФСГ). Определение уровня АМГ прогнозирует успех ВРТ, а также является предиктором преждевременной недостаточности яичников.
Хирургические вмешательства повреждают не только кору яичников, но и нарушают кровоток, что приводит к преждевременной недостаточности яичников (Somigliana E. et al., 2006). Даже при 1–2-й стадии эндометриоза у бесплодных женщин отмечено достоверное снижение уровня АМГ по сравнению с женщинами с трубным бесплодием.
В крупном исследовании (313 женщин с диагностированным эндометриозом и контроль — 413) достоверное снижение уровня АМГ отмечено в группе женщин, оперированных по поводу эндометриом яичников (Streuli I. et al., 2012).
Большинство исследователей рекомендуют комбинированное лечение: хирургическое и супрессивную терапию агонистами гонадотропного рилизинг-гормона (аГнРГ) или диеногестом в послеоперационном периоде. Механизмы сохранения овариальных резервов на фоне аГнРГ: прекращение секреции ФСГ, снижение маточно-яичниковой перфузии, подавление антиапоптических молекул (сфингозин-1 фосфат) и протекция недифференцированных стволовых клеток.
Применение аГнРГ в течение 6 мес после удаления эндометриом увеличивало частоту наступления беременности до 57,1% по сравнению с пациентками, не получавшими аГнРГ после хирургического удаления эндометриом яичников, — 36,8% (Yang X.H. et al., 2014).
Одной из теорий возникновения является нарушение рецептивности эндометрия.
Рецептивность эндометрия является необходимым фактором для функциональной полноценности эндометрия в период «имплантанционного окна», что обеспечивает успешную имплантацию бластоцисты удовлетворительного качества (Kliman H.J. et al., 2019).
Полноценность морфологических изменений в эндометрии зависит от количества прогестероновых (ПР) и эстрогеновых рецепторов в строме и железах. Известно, что абсолютное содержание половых стероидов в плазме крови не гарантирует полноценной реализации их биологического действия на эндометрий (Аганезов С.С. и соавт., 2017).
Показано, что при эндометриозе имеет место абсолютная и относительная гиперэстрогения и «прогестерон-резистентность» в результате снижения общего числа ПР. Экспрессия ПР происходит в виде двух функционально различных изоформ: ПР-Α и ПР-Β.
ПР-Α являются основными в фертильности и могут ингибировать активность эстрогеновых рецепторов (Marquardt R.M. et al., 2019).
ПР-Β имеют решающее значение для развития молочных желез, морфогенеза во время беременности и могут активировать эстрогеновые рецепторы (Mousazadeh S. et al., 2019).
Таким образом, дисбаланс изоформ ПР также играет важную роль в патофизиологии резистентности к прогестерону.
Известно, что при эндометриозе повышена экспрессия эстрогеновых рецепторов в эпителии и строме эндометрия (Парамонова Н.Б. и соавт., 2018).
Нарушение рецептивности преимущественно вызывает хронический эндометрит (ХЭ), эндометриоз способствует в большей степени функциональным нарушениям.
Механизмы негативного влияния на рецептивность эндометрия обусловлены изменением функций имунных, эпителиальных и стромальных клеток. В основе эндометриальной дисфункции при ХЭ лежит аномальная экспрессия стероидных рецепторов, цитокинов, хемокинов и других факторов. Отмечается также нарушение межклеточных взаимодействий, повреждение экстрацеллюлярного матрикса, изменение ангиоархитектоники тканей, наличие микроорганизмов, что создает невозможные условия для имплантации (Сухих Г.Т., 2013). Успешная имплантация происходит при взаимодействии стероидогенеза, ангиогенеза и иммуногенеза. При ХЭ и сочетании ХЭ с эндометриозом снижается экспрессия рецепторов (Толибова Г.Х., 2019). В эутопическом эндометрии при эндометриозе была выявлена аберрантная экспрессия рецепторов (Rayan M. et al., 2019).
ХЭ при эндометриозе является эстрогениндуцированным воспалением. Высокие уровни эстрогенов способствуют повышенной экспрессии ароматазы и циклооксигеназы-2, поддерживающих синтез эстрадиола и простагландина Е2, который стимулирует экспрессию стероидогенных генов (Оразова М.Р., 2020, Bulun S. et al., 2019). В эутопическом эндометрии формируется резистентность к прогестерону на фоне локальной гиперэстрогении.
ХЭ при эндометриоз-ассоциированном бесплодии может быть как причиной (теория бактериальной контаминации), так и следствием эндометриоза, при котором эстрогениндуцированное воспаление еще больше дисрегулирует местный иммунитет эндометрия. Это приводит к активации условно-патогенной флоры.
Таким образом, изменение микробиоты эндометрия при эндометриозе — важная причина нарушений рецептивности эндометрия и, соответственно, нормальной имплантации и развития эмбриона.
В патогенезе хронического эндометрита (ХЭ) является взаимодействие между микробиотой эндометрия и его иммунитета, а не просто присутствие микроорганизмов в эндометрии.
При эндометриозе имеются особенности бактериальной контаминации эндометрия и брюшной полости, которая становится триггером генетически-эпигенетических модификаций клеток, запуская каскады реакций, нарушающих репродуктивную функцию.
Всемирное общество по эндометриозу (World Endometriosis Society) подготовило первый Консенсус по современному ведению пациенток с эндометриозом после окончания 11-го Всемирного конгресса по эндометриозу (2011). Документ был опубликован в 2013 г. и включал 69 заявлений, отражающих результаты воздействия лечения на пациенток, эффективность и потенциальный вред отдельных методов терапии, их стоимость и доступность.
Совещание по выработке второго Консенсуса World Endometriosis Society по вопросам классификации эндометриоза состоялось в 2014 г. в рамках 12-го Всемирного конгресса по эндометриозу. Работа проведена с участием 55 представителей 29 национальных и международных медицинских и общественных организаций (Johnson N.P., Adamson G.D. et al., 2016).
Длительное время применялась пересмотренная классификация Американского общества по репродуктивной медицине (American Society for Reproductive Medicine. Revised American Society for Reproductive Medicine classification of endometriosis: 1996).
Одним из ее недостатков являлась невозможность оценки степени поражения при глубоком инфильтративном эндометриозе.
Эндометриоз остается загадочной болезнью вследствие невозможности представить поэтапное развитие клинических симптомов по мере прогрессирования заболевания, чтобы повысить эффективность лечения. Разработка легко применимой на практике классификации предпринимается в течение более чем 100 лет и во многом затруднена из-за существования нескольких клинических форм заболевания.
Для описания тяжелых инвазивных форм заболевания в дополнение к r-ASRM хирургами-эндоскопистами была разработана классификация ENZIAN (Keckstein J. et al. 2005).
Показатель ENZIAN (ENZIAN score) позволяет описать локализацию и оценить тяжесть глубокого инвазивного эндометриоза в баллах. Позволяет составить план будущей операции, предположить, потребуется ли частичная или полная резекция участка кишки, а также предсказать ее продолжительность.
Поддержку клиницистов получил также индекс фертильности при эндометриозе, позволяющий прогнозировать вероятность наступления беременности в естественном цикле у больных с хирургически подтвержденным эндометриозом (Chapron et al., 2003).
Американская ассоциация гинекологов-лапароскопистов (American Association of Gynecological Laparoscopists) закончила разработку новой классификации, которая сфокусирована на характеристике боли.
Эта классификация сможет в будущем заменить классификацию r-ASRM, поскольку при ее использовании выше корреляция с бесплодием, степенью выраженности боли и трудностями хирургического лечения (Johnson N.P., Adamson G.D. et al., 2016).
В последние годы активно проводятся исследования в области визуализации с использованием биомаркеров, гистологических и генетических методов.
Наши исследования выработали простую классификацию НГЭ по степени тяжести (данные лапароскопии):
• Малые формы эндометриоза или I ст.
- Единичные очаги на брюшине.
- Единичные очаги на яичниках.
- Без спаек и рубцов.
• Эндометриоз средней тяжести (II–III ст.)
- Очаги на поверхности одного или обоих яичников с образованием мелких кист.
- Спаечный процесс без нарушения проходимости труб.
- Очаги на брюшине дугласова пространства с образованием рубцов и смещением матки.
• Тяжелая форма эндометриоза (III–IV ст.)
- Эндометриоз яичников с образованием кист более 5 см.
- Ректовагинальный (глубокий тазовый) эндометриоз.
- Выраженный спаечный процесс с нарушением проходимости труб.
- Вовлечение в процесс мочевыводящих путей и/или кишечника.
Факторы, способствующие развитию заболевания, всем хорошо известны:
• Экологические (диоксин, PCB, продукты сгорания топлива).
• Снижение иммунитета.
• Стресс.
• Злоупотребление алкоголем.
• Ранние, обильные, длительные, частые менструации.
• Дисменорея.
• Обструктивные пороки развития.
• Спонтанные и артифициальные аборты.
• ВМС (медьсодержащие).
• Генетические — частота НГЭ в 7 раз выше у родственников 1-й линии родства.
Факторы, препятствующие развитию заболевания:
• Дефицит эстрогенов при гипогонадотропных формах аменореи.
• Физические упражнения, здоровый образ жизни.
• Гормональная контрацепция (в России непопулярна).
• Олигоаменорея при синдроме поликистоза яичников (СПКЯ), метаболическом синдроме (МС). Хотя у нас были единичные случаи сочетания НГЭ с СПКЯ, при этом после ЛСК беременность наступила и НГЭ не явился причиной бесплодия.
• Уменьшение стрессов.
• Курение.
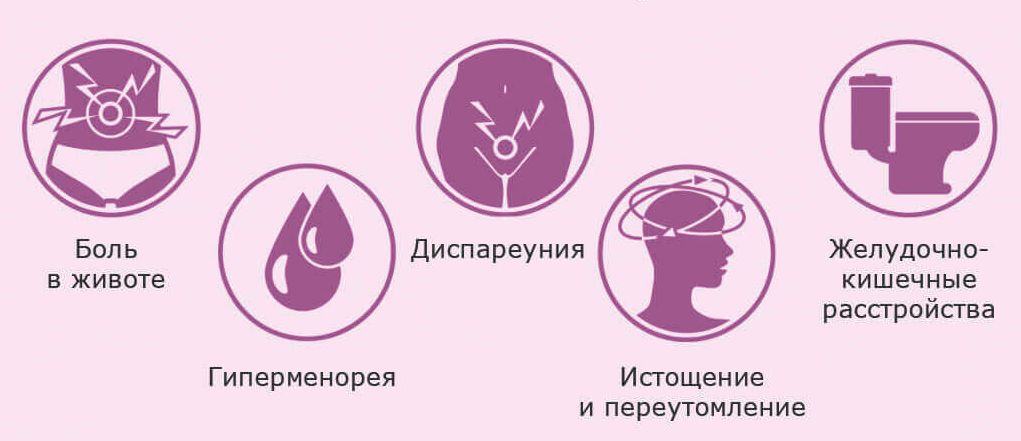
Для НГЭ характерно:
• Прогрессирующее, рецидивирующее течение.
• Хроническая тазовая боль (основной симптом).
• Нарушения менструальной функции — аномальные маточные кровотечения (АМК), меноррагии, метроррагии, дисменорея.
• Бесплодие.
• Диспареуния, дисхезия.
• Психоэмоциональные нарушения — депрессия.
Причины боли при эндометриозе
При эндометриозе брюшины:
• выделение биологически активных субстанций, раздражающих брюшину;
• провоспалительные изменения перитонеальной среды;
• поражение нервных волокон.
При эндометриоидных кистах:
• микроперфорации;
• значительные размеры, нарушающие тазовую анатомию;
• спаечный процесс.
При глубоком тазовом эндометриозе:
• спаечный процесс;
• иммобилизация тазовых органов и позадиматочного пространства;
• поражение нервных сплетений.
Гамма психоэмоциональных симптомов связана с постоянными изнуряющими болями, которые приводят к социальной дезадаптации, конфликтам в семье. Бесплодие также способствует ощущению неполноценности, несостоятельности стать матерью и т.д. Все это приводит к нарушениям функций в центральной нервной системе (ЦНС). В условиях патологического функционирования ЦНС механоволокна замыкаются на телах сенсорных нейронов дорсальных рогов спинного мозга, что приводит к «ошибочному» восприятию таких раздражителей как боль.
Анатомические нарушения
При 3–4-й стадии — обширный спаечный процесс. При 1-й и 2-й стадии — патология фимбриального отдела (Abuzeid M.I., 2007). Может быть формирование гидро-гематосальпинкса. Важная роль принадлежит составу перитонеальной жидкости в патологии труб (Lyons R.A., 2002). Воспалительная перитонеальная жидкость характеризуется экспрессией макрофагов, интерлейкина 6, 8, фактора некроза опухоли α (ФНО-α) (Piva M., 2001). Секреция эстрадиола и прогестерона в гетеротопии активируется экспрессией сосудистого эндотелиального фактора роста. Повышенные концентрации макрофагов способствуют иммобилизации и фагоцитозу сперматозоидов. Оксидантный стресс и апоптоз, посредством которых ФНО-α разрушает ДНК сперматозоидов, и они погибают в проксимальном отделе труб (Reeve L. et al., 2005).
Овариальная микросреда
Фолликулярная жидкость содержит множество провоспалительных цитокинов, экспрессия апоптоза. Поражается ткань яичника, снижается качество ооцита, подавляется овуляция. Отмечены более низкие значения АМГ при эндометриомах и после цистэктомии (Hwu Y.M. et al., 2011).
Рецептивность эндометрия
Одним из факторов функциональной неполноценности эндометрия при эндометриозе является дисбаланс гормональных рецепторов, проявляющийся нарушением соотношения ПР и эстрогеновых рецепторов в середине секреторной фазы, в норме составляющего от 2 до 4.
При эндометриозе снижена рецептивность эндометрия, что нарушает процесс имплантации. Концентрации эстрадиола и прогестерона в норме, но за счет воспаления локально повышается секреция эстрадиола и снижена чувствительность к прогестерону как в эндометрии, так и в миометрии. В норме специфические интегрины стимулируют синтез гомеобокса А 10, который экспрессируется в нормальном эндометрии. У женщин с эндометриозом синтез этого интегрина отсутствует.
К сожалению, несмотря на современные технологии, наблюдается задержка постановки диагноза. Средний возраст при установлении диагноза: 27,2 + 7,5 года, средний возраст начала заболевания: 20,1 + 6,8 года.
Задержка постановки диагноза эндометриоза (David G.D. et al., 2013):
10,4 года — в Германии и Австрии, 8 лет — в Великобритании и Испании, 6,7 года — в Норвегии, 7–10 лет — в Италии, 4–5 лет — в Ирландии и Бельгии, в России?
Возможные причины задержки постановки диагноза эндометриоза:
• периодическое применение КОК, которые маскируют симптомы эндометриоза;
• неправильный диагноз, наиболее часто ставится диагноз воспаления ОМТ;
• неиспользование специфических методов диагностики;
• обращение к непрофильным специалистам, семейным врачам, а также консультации с подругами и родственниками — попытки «нормализовать менструации и уменьшить боль».
Девушки-подростки с эндометриозом предъявляют жалобы на: боль внизу живота во время менструации — 100%, циклическую боль — 67%, нециклическую боль — 39%, запоры/диарею — 67%, иррадиирующую боль — 31%.
Существующие на данный момент возможности лечения подходят не всем пациенткам.
Европейские рекомендации клиницистам [European Society of Human Reproduction and Embryology (ESHRE) Guideline management of women with Endometriosis 2013]. Следует думать о диагнозе эндометриоза в следующих случаях:
• наличия таких симптомов, как дисменорея, нециклическая тазовая боль, диспареуния, бесплодие;
• у женщин репродуктивного возраста при наличии таких негинекологических циклических симптомов, как дисхезия, дизурия, гематурия и ректальные кровотечения.
Клиницисты должны провести обследование у женщин с подозрением на эндометриоз, хотя влагалищное исследование может быть невозможно у подростков или женщин, не живших половой жизнью. В таких случаях для диагностики эндометриоза следует проводить ректальное исследование.
В диагностике эндометриоза используются следующие методы:
• общеклинические;
• гинекологический осмотр;
• кольпоскопия информативна в диагностике эндометриоза шейки матки;
• визуализация при УЗИ (аденомиоз, эндометриоидные кисты). Применение гистероскопии в диагностике нецелесо¬образно, трансвагинальная эхоскопия неинвазивна и информативна в диагностике аденомиоза;
• лапароскопическая визуализация перитонеальных форм эндометриоза:
- эндометриоз яичников;
- более 22 видов перитонеальных очагов;
- глубокие инфильтративные формы;
- сочетанные формы.
• МРТ информативна в диагностике глубокого тазового (ректовагинального) эндометриоза.
Диагностика эндометриом по трансвагинальному УЗИ — 94%, чувствительность метода — 77%, специфичность — 98% (Sokalska A. еt al., 2009).
Иногда эндометриомы могут трактовать как тератомы, муцинозные цистаденомы, тубоовариальный абсцесс или геморрагические кисты — кисты желтого тела.
Информативность МРТ в диагностике эндометриоидных кист — 90%, чувствительность метода — 98%, специфичность — 96% (Togashi K. et al., 1991).
При ведении пациентки с наружным генитальным эндометриозом нужно учитывать:
• возраст;
• симптомы;
• предыдущие оперативные вмешательства;
• форму эндометриоза.
На сегодня есть мнение, что только хирургический подход не решает все проблемы. Существует необходимость адъювантной терапии. Вылечить эндометриоз невозможно, изолированно хирургия не является решением проблемы.
У 20–40% женщин хирургия не приводит к значимому улучшению состояния (Leyland N. et al., 2010).
Считают, что невозможно удалить все очаги эндометриоза. Есть риск снижения овариального резерва при удалении эндометриом (Guo S-W., 2009). По нашим данным, все очаги перитонеального эндометриоза можно удалить, что приводит к улучшению здоровья у более 80% женщин. При соблюдении всех правил репродуктивной медицины эффективность лечения бесплодия составляет до 86,8% (наши данные).
Всеобщее убеждение, что лапароскопия необходима для постановки точного диагноза, должно быть подвергнуто сомнению, поскольку нехирургические методы диагностики эндометриоза показали себя высоконадежными (Vercellini P. et al., 2008).
Несмотря на то что для постановки точного диагноза требуется лапароскопия, эмпирическая медикаментозная терапия позволила не только минимизировать/устранить симптомы эндометриоза, но и подтвердить предварительный (клинический) диагноз (Luciano D.E., 2011).
Диагностическая лапароскопия рассматривалась как «золотой стандарт» диагностики хронической тазовой боли. Теперь ее следует рассматривать как вторую линию не только диагностики, но и лечения, если другие методы не дают ответа на поставленный вопрос. Нет гарантии того, что после лапароскопической эксцизии симптомы уменьшатся (Kennedy S., 2006). Это во многом обусловлено тем, что зачастую данные объективного исследования не соответствуют симптоматике. Известно, что у пациенток с НГЭ имеются определенные психоэмоциональные нарушения. Так, при постановке диагноза аденомиоза по УЗИ у пациентки начинается болевой синдром.
По мнению профессора Мюллер и профессора Ремер, диагноз эндометриоза не означает, что следует незамедлительно проводить оперативное вмешательство, — возможна эмпирическая медикаментозная терапия. Для пациенток с бесплодием операция нужна лишь когда беременность будет запланирована (Streuli I. et al.).
По данным Кохрановского исследования, эффективность хирургического лечения противоречива (Jacobson T.Z., 2010).
При 3–4-й стадии, тяжелых формах эндометриоза и бесплодии получены хорошие результаты после хирургического лечения. Частота беременностей варьирует от 30 до 70%. При глубоком тазовом эндометриозе частота беременностей — 35–48% (Darai E., 2011, Ferrero S. et al., 2009). По обобщенным данным литературы, авторы больше склонны к резекции яичников при эндометриомах, в частности хорошие исходы в программе ВРТ (Opoien H.K., 2011).
В 22 исследованиях показано снижение частоты беременностей в программе ВРТ по сравнению с пациентками с трубным фактором бесплодия (Barnhart K. et al., 2002). Показано снижение количества и качества ооцитов, а также числа оплодотворенных яйцеклеток. По данным Opoien H.K., 2002, не было разницы по частоте беременностей и рожденных детей. Полагаем, что причина — в воспалительной перитонеальной жидкости, которая нарушает процесс оплодотворения на всех этапах, приводит к хроническому эндометриту, оказывает эмбриотоксическое действие при переносе эмбриона в полость матки.
Контролируемая овариальная стимуляция с инсеминацией оказалась более эффективной по сравнению со спонтанным зачатием. По нашим данным, увеличение процента рожденных детей до 18,6%. Во многих исследованиях считают процент беременностей, а не рожденных детей.
В 13 исследованиях показано, что 50% женщин с бесплодием страдают эндометриозом (D' Hooghe T.M., 2003). При этом эндометриомы обнаруживаются у 17–44% женщин с эндометриозом (Busacca M., 2003).
Тазовая боль может уменьшать частоту коитусов, особенно в преовуляторный период. Применение нестероидных противовоспалительных препаратов (НСПВП) может привести к синдрому ЛНФ. При эндометриомах более 4 см по УЗИ определяется маленькое количество антральных фолликулов. Это также приводит к неэффективности стимуляции овуляции в программе ВРТ. Пункция яйцеклеток затруднена при больших кистах и спаечном процессе. Частота беременностей снижена из-за этих причин (Fujishita et al., 2002), в частности эмбриотоксического действия перитонеальной воспалительной жидкости.
Дискутируется вопрос об объеме хирургического вмешательства. Хирургическое лечение — в объеме цистэктомии или опорожнения кисты с абляцией ложа (Chapron C. et al., 2002). При больших кистах рекомендуют аГнРГ в течение 3 мес перед ЛСК, далее — опорожнение, промывание и коагуляция ложа кисты (Tsolakidis D. et al., 2010) с целью сохранения овариальных резервов (Кохрановское исследование).
По нашим данным, такая тактика нецелесообразна, поскольку приводит к рецидиву заболевания. Цистэктомия снижает частоту повторного хирургического вмешательства, способствует уменьшению тазовой боли и высокой частоте спонтанных беременностей.
По Европейским рекомендациям, цистэктомия показана при размерах кист более 4 см, что снижает частоту инфекции и улучшает качество яйцеклеток при пункции (Kennedy S.P. et al., 2005).
Применение аГнРГ в течение 6 мес после удаления эндометриом увеличивало частоту наступления беременности до 57,1% по сравнению с пациентками, не получавшими аГнРГ после хирургического удаления эндометриом яичников, — 36,8% (Yang X.H. et al., 2014). В другом исследовании (1062 пациентки, получавшие аГнРГ после хирургического лечения) также отмечена более высокая частота беременностей (Shen Y.W. et al., 2015).
Применение у пациенток с эндометриоидными кистами после хирургического лечения аГнРГ в течение 4 мес или диеногеста в течение 6 мес повышает частоту наступления беременности.
Послеоперационное лечение аГнРГ вызывает уменьшение интенсивности болей, а также отсрочку рецидива болевого синдрома более чем на 12 мес, если агонисты применялись в течение 6 мес (ЕSHRE, 2008).
У пациенток, не заинтересованных в беременности, после хирургического удаления эндометриом и супрессивной гормонотерапии применение КГК в течение по крайней мере 24 мес эффективно снижает тяжесть болевого синдрома и частоту рецидивов. 1-а (2010).
Продолжительность лечения зависит от вида лекарственного средства, ответа на лечение и наличия побочных эффектов (RCOG, 2006). Медикаментозное лечение болевого синдрома должно быть эффективным и безопасным, может использоваться до возраста менопаузы или до наступления беременности, если она желательна (SOGS, 2010).
После реализации генеративной функции рекомендуем длительный прием гормональных контрацептивов, иначе закономерен рецидив НГЭ. К сожалению, доминанта забеременеть, несмотря на беседу с пациентками после хирургического лечения о большом риске рецидива, неубедительна.
На основании многочисленных исследований нами разработана эффективная терапия бесплодия у пациенток с наружным генитальным эндометриозом.
После хирургического лечения II этап у пациенток со II–IV НГЭ аГнРГ [бусерелин (Бусерелин-депо*)] 4–6 инъекций или диеногест (Визанна*) 6 мес, далее — дидрогестерон (Дюфастон*) на II фазу цикла. Частота и интенсивность кровотечений на фоне диеногеста (Визанны*) уменьшается при длительном лечении, о чем нужно предупредить пациентку.
Дискутируется вопрос о целесообразности назначения супрессивной терапии после хирургического удаления эндометриоидных кист.
По нашим данным, частота наступления беременности после комбинированной терапии (хирургия и супрессивная терапия) достоверно выше, составляя 76,8% по сравнению с монотерапией (только хирургическое лечение) 47,3%.
У пациенток с I ст. НГЭ сразу после операции планирование беременности на фоне дидрогестерона (Дюфастона*) приходится на II фазу цикла.
При отсутствии беременности в течение 8–12 мес после лапароскопии у пациенток с НГЭ I ст. контролируемая индукция овуляции (внутриматочная инсеминация) повышает восстановление фертильности на 17,6%.
У пациенток с эндометриомами больших размеров при отсутствии беременности в течение 8–10 мес после комбинированной терапии целесообразно проведение Second look лапароскопии или экстракорпоральное оплодотворение (ЭКО) с учетом возраста и резервов фертильности (уровень ФСГ на 2–3-й день цикла, АМГ).
При рецидиве эндометриоидных кист яичников (ЭКЯ) в течение 12–18 мес планирования беременности рекомендуем ЭКО или повторную лапароскопию, далее аГнРГ или диеногест (Визанна*).
Применение аГнРГ повышает частоту беременностей и профилактирует спайкообразование после операции.
Гипоэстрогенные побочные эффекты аГнРГ: приливы, деминерализация трабекулярной костной ткани, атрофический вагинит купируются назначением add-back терапии после второй инъекции — дроспинерон + эстрадиол (Анжелик микро*), дидрогестерон + эстрадиол (Фемостон мини*), эстрадиол (Дивигель*) 0,5, эстрадиол (Эстрожель*), эстрадиол (Климара*). Эта небольшая доза эстрогенов не оказывает влияние на эндометрий и не снижает эффективность основного лечения.
Рецидив эндометриоза после лапароскопии наблюдается даже у опытных врачей: кумулятивный уровень рецидивов через 5 лет составляет почти 20% (Fedele L. et al., 2004).
Рецидив дисменореи в течение 1 года после лапароскопического вмешательства отмечен почти у каждой третьей пациентки, не получавшей медикаментозного лечения (Redwine D.B., 2001).
Повторная операция в связи с рецидивом симптомов в течение последующих двух лет потребовалась в 20% наблюдений, причем этот показатель находился в прямой зависимости от стадии заболевания: 10%, 20%, 26% и 32% соответственно при 1-й, 2-й, 3-й и 4-й стадиях заболевания (Roman J., 2010).
Частота рецидивов эндометриоидных кист (ЭК) при выжидательной тактике в течение 2–5 лет составляет до 40% (Lee J.H. et al., 2018).
Частота рецидива НГЭ может быть и больше, поскольку некоторые исследователи считают рецидив по клинической симптоматике, не учитывая бессимптомные ЭК.
Рецидив после хирургического лечения ЭК без последующей супрессивной терапии к концу 3-го года возникает у каждой 4-й пациентки и у каждой 2-й — к концу 5-го года. Частоту рецидива снижает длительное постоперационное назначение диеногеста (Гусев Д.В., Прилуцкая В.Ю., Чернуха Г.Е., 2020).
Для профилактики рецидива НГЭ (по нашим данным) после хирургического лечения и супрессивной терапии (аГнРГ 4–6 инъекций или диеногест 12–24 мес) далее рекомендуется длительный прием КОК до возраста естественной менопаузы — 50–52 года. После 45 лет рекомендуем прием комбинированных оральных контрацептивов (КОК) последнего поколения, содержащих аналоги натурального эстрогена — диеногест + эстрадиола валерат (Клайра*), номегэстрол + эстрадиол (Зоэли*).
14.08.2022 | 22:30:39