Пневмония у новорожденного. Определение, причины, симптомы пневмонии у новорожденных. Лечение и профилактика пневмонии новорожденных.
Раздел: Статьи
/
Педиатрия
/
Пульмонология.
/
Пневмония у новорожденного. Определение, причины, симптомы пневмонии у новорожденных. Лечение и профилактика пневмонии новорожденных.
Содержание
Определения
Эпидемиология пневмонии у новорожденных
Этиология, патогенез и патоморфология
Клиническая картина пневмонии у новорожденных
Диагностика, дифференциальная диагностика и диагностические критерии
Лечение пневмонии новорожденных
Профилактика пневмонии новорожденных
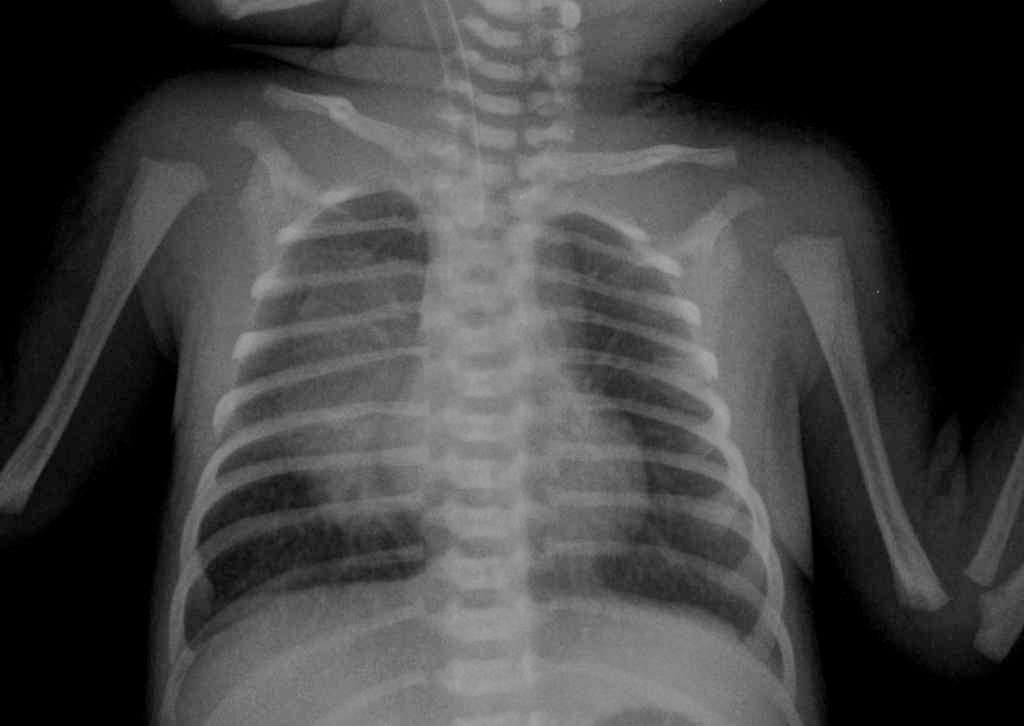

Неонатальная пневмония – термин, который объединяет возможные варианты пневмоний у детей первых 28 дней жизни. Пневмония в этом возрасте может быть внутриутробной, врожденной, ранней и поздней, аспирационной, госпитальной, вентилятор-ассоциированной и внебольничной, характеризуясь разными путями, условиями и временем инфицирования.
Врожденная пневмония – инфекция, возникшая во внутриутробном периоде развития ребенка в результате восходящей инфекции через хориоамниотические оболочки или гематогенным (трансплацентарным) путем, проявляется обычно в первые 72 часа после рождения. Врожденная пневмония является следствием инфицирования плода во время беременности и обычно представляет собой один из компонентов тяжелого системного заболевания.
Ранняя неонатальная пневмония развивается в течение первой недели после рождения и связана с внутриутробной или постнатальной экспозицией патогена либо инфицированием во время прохождения через родовые пути матери (интранатальное инфицирование).
Поздняя неонатальная пневмония характеризуется нозокомиальным или домашним инфицированием пневмопатогенной флорой и манифестирует после 1-й недели жизни. Поскольку госпитальная пневмония – это заболевание, которое развивается через 48 часов и позднее после госпитализации, при выявлении пневмонии у новорожденных, находящихся в условиях стационара, в возрасте старше 2 суток достаточно трудно провести дифференциальную диагностику между врожденной и нозокомиальной пневмонией.
Некоторые авторы предлагают расценивать раннюю неонатальную пневмонию как возникшую в течение первых 3 или 7 дней жизни, в основном в течение 48 часов, позднюю – в возрасте от 4 до 28 дней жизни. Врожденную или внутриутробную пневмонию рассматривают как вариант ранней пневмонии. Вместе с тем внутриутробные пневмонии цитомегаловирусной, хламидийной или микоплазменной этиологии манифестируют в возрасте старше 7–10 дней жизни.
Аспирационная пневмония диагностируется у новорожденных при выявлении инфильтративных изменений в легких в течение первых 72 часов после рождения при рентгенологическом исследовании в случаях подтвержденной путем ларингоскопии аспирации мекония, крови или молока.
Вентилятор-ассоциированная пневмония (ВАП) относится к поздним пневмониям и развивается у детей, находящихся на ИВЛ не менее 48 часов.
Заболеваемость пневмонией составляет около 1 % среди доношенных новорожденных и 10 % среди недоношенных. Пневмония – частая инфекция среди госпитализированных новорожденных. У новорожденных, находящихся на ИВЛ, частота нозокомиальной пневмонии может достигать 40 %. Согласно статистическим данным, опубликованным в 2014 г. в докладе «Основные показатели здоровья матери и ребенка, деятельность службы охраны детства и родовспоможения в Российской Федерации» пневмония в первую неделю жизни была диагностирована у 0,58 % доношенных и 7,49 % недоношенных новорожденных. Заболеваемость пневмонией в периоде новорожденности в нашей стране в несколько раз выше, чем в странах Европы и в Северной Америки, то есть имеет место гипердиагностика заболевания.
Пневмония считается одной из основных причин смерти новорожденных детей. В 2013 г. в мире от респираторных инфекций нижних дыхательных путей умерло 196 500 новорожденных, что во много раз выше, чем смертность от диареи, менингита, малярии и столбняка. В развивающихся странах внутриутробная пневмония была обнаружена в 10–38 % случаев аутопсийных исследований тел мертворожденных и в 20–63 % у умерших новорожденных.
В неонатальном периоде незрелость и процесс послеродовой адаптации респираторной, сердечно-сосудистой и иммунной систем у доношенных и, особенно у недоношенных, младенцев, разнообразные пути инфицирования определяют различия в эпидемиологии, факторах риска, клиническом течении, и, как следствие, возможностях диагностики и исходах пневмонии по сравнению с другими детскими возрастными группами. Новорожденные более чувствительны к широкому кругу патогенов, которые редко вызывают поражение легких, в другом возрасте, например, таких как Listeria monocytogenes, грибы рода Candida, цитомегаловирус. В отличие от пневмонии у детей старшего возраста неонатальная пневмония часто сопровождается тяжелыми патологическими изменениями со стороны других органов, в первую очередь сердечно-сосудистой системы, что усугубляет тяжесть течения и прогноз. Риск развития неонатальной пневмонии связывают с высокой восприимчивостью новорожденных к инфекции, инфицированием матери во время беременности и родов, несоблюдением санитарно-эпидемического режима в родильном доме, отделениях реанимации, отделениях для новорожденных и недоношенных.
Незрелость врожденного и адаптивного иммунитета в этом периоде жизни является предрасполагающим фактором развития инфекционных процессов. Новорожденные дети, особенно недоношенные, имеют сравнительно небольшую популяцию Т-лимфоцитов, активность которых снижена, и адаптивные реакции в этом возрасте формируются преимущественно с участием Т-хелперов 2-го типа, обладающих слабым противоинфекционным потенциалом. У новорожденных инфекции протекают на фоне низкого содержания факторов адаптивного клеточного иммунного ответа. Малый объем материнских IgG-антител и слабая способность собственных В-лимфоцитов синтезировать иммуноглобулины ограничивают возможности организма к эффективной эрадикации возбудителей инфекций. Особенно низкая концентрация материнских IgG-антител имеется у недоношенных, так как активная передача их через плаценту происходит лишь после 32-й недели гестации. Кроме того, у новорожденных обнаружено относительное снижение числа макрофагов, что в условиях нарушения мукоцилиарного клиренса, например при использовании респираторной поддержки, способствует колонизации патогенной микробиотой дыхательных путей. Для неонатального периода характерно нарушение рекрутмента нейтрофилов из костного мозга и хемотаксиса нейтрофилов в очаг воспаления, низкий уровень ряда компонентов комплемента, что ограничивает возможности иммунной системы эффективно реагировать на инфекцию.
Существенную роль в защите легких играет сурфактант, оказывая свое протективное действие еще до образования антител. Как молекулы переключения между врожденным и приобретенным иммунитетом, сурфактант модулирует функции альвеолярных макрофагов и Т-лимфоцитов и вовлечен в процесс нейтрализации вирусов, грибов, клеток, подвергшихся апоптозу и некрозу. Белки сурфактанта участвуют в уничтожении патогенов путем агглютинации и агрегации, влияют на освобождение цитокинов, обладающих противовоспалительной активностью, и включены в регуляцию аллергических и воспалительных процессов. Первичный дефицит сурфактанта вследствие недоношенности и вторичный в результате различных патологических состояний в перинатальном периоде значительно ухудшают течение инфекционных процессов в легких у новорожденных. В то же время легочная инфекция инактивирует сурфактант, повреждает альвеолоциты и нарушает пополнение пула сурфактанта.
Существуют специфические факторы риска развития различных вариантов пневмонии у новорожденных. Учет и выявление данных факторов риска чрезвычайно важны для диагностики и определения лечебных и профилактических стратегий при пневмонии у новорожденных детей (табл. 1.1).
Табл. 1.1. Этиология и факторы риска различных вариантов неонатальных пневмоний
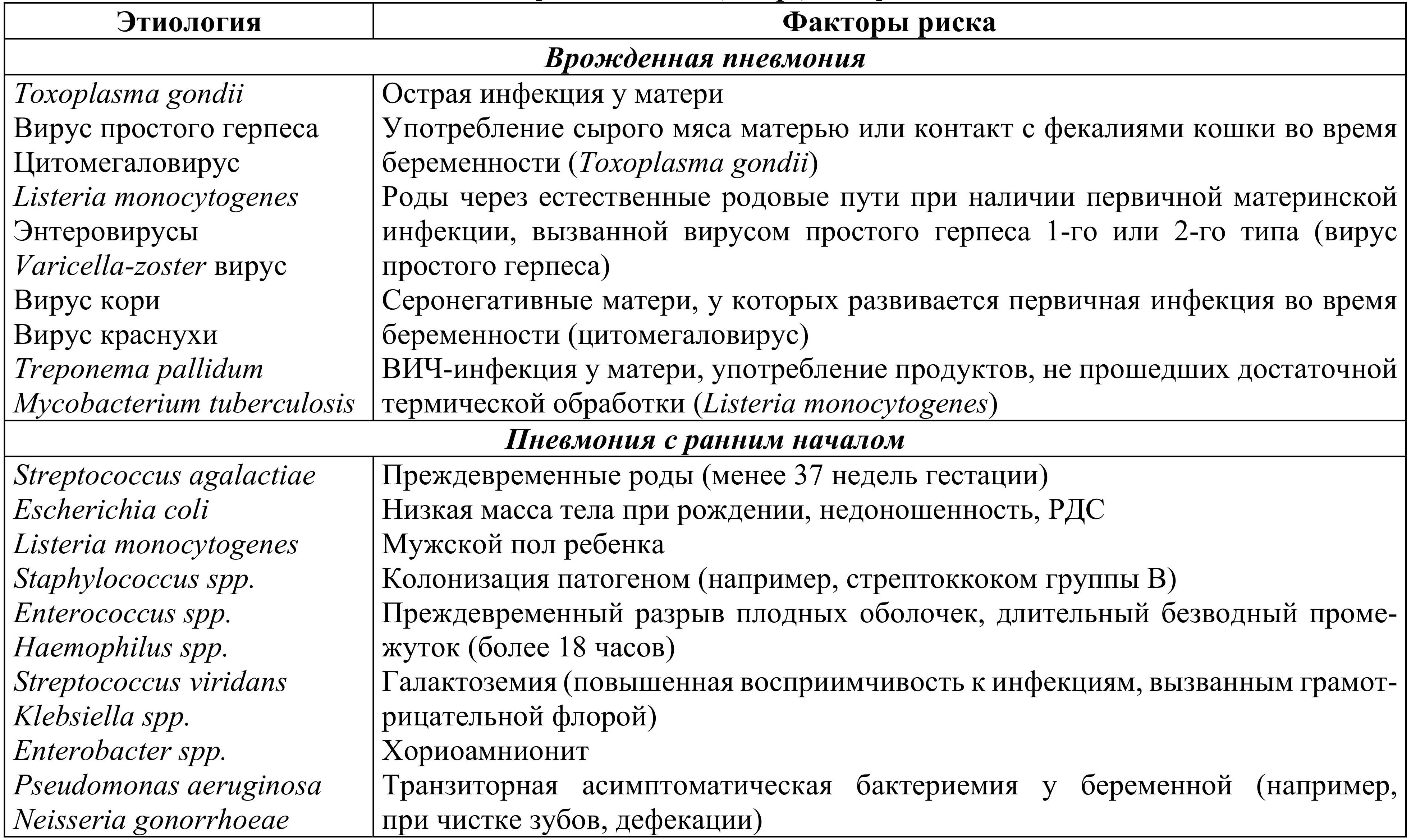
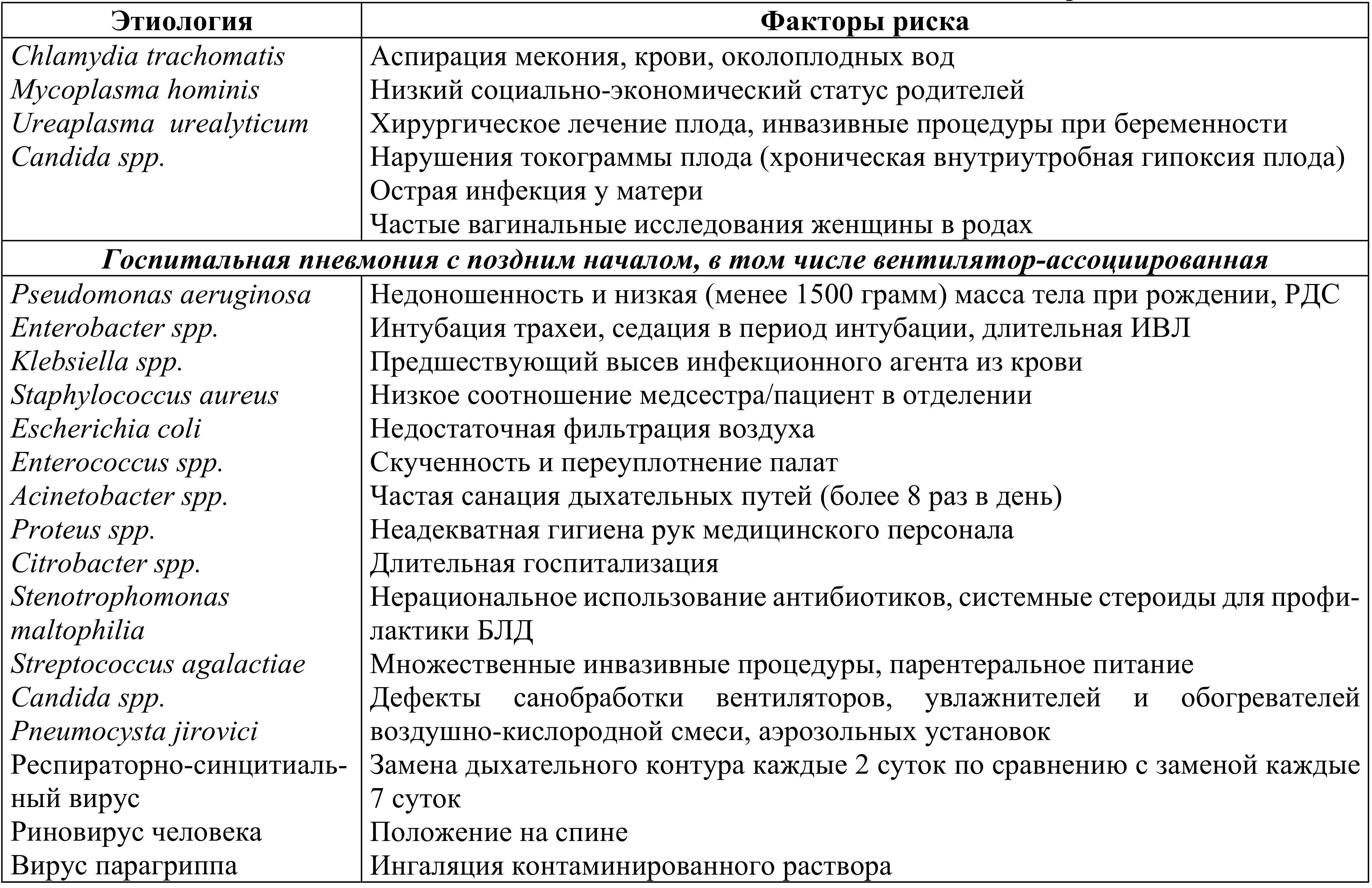
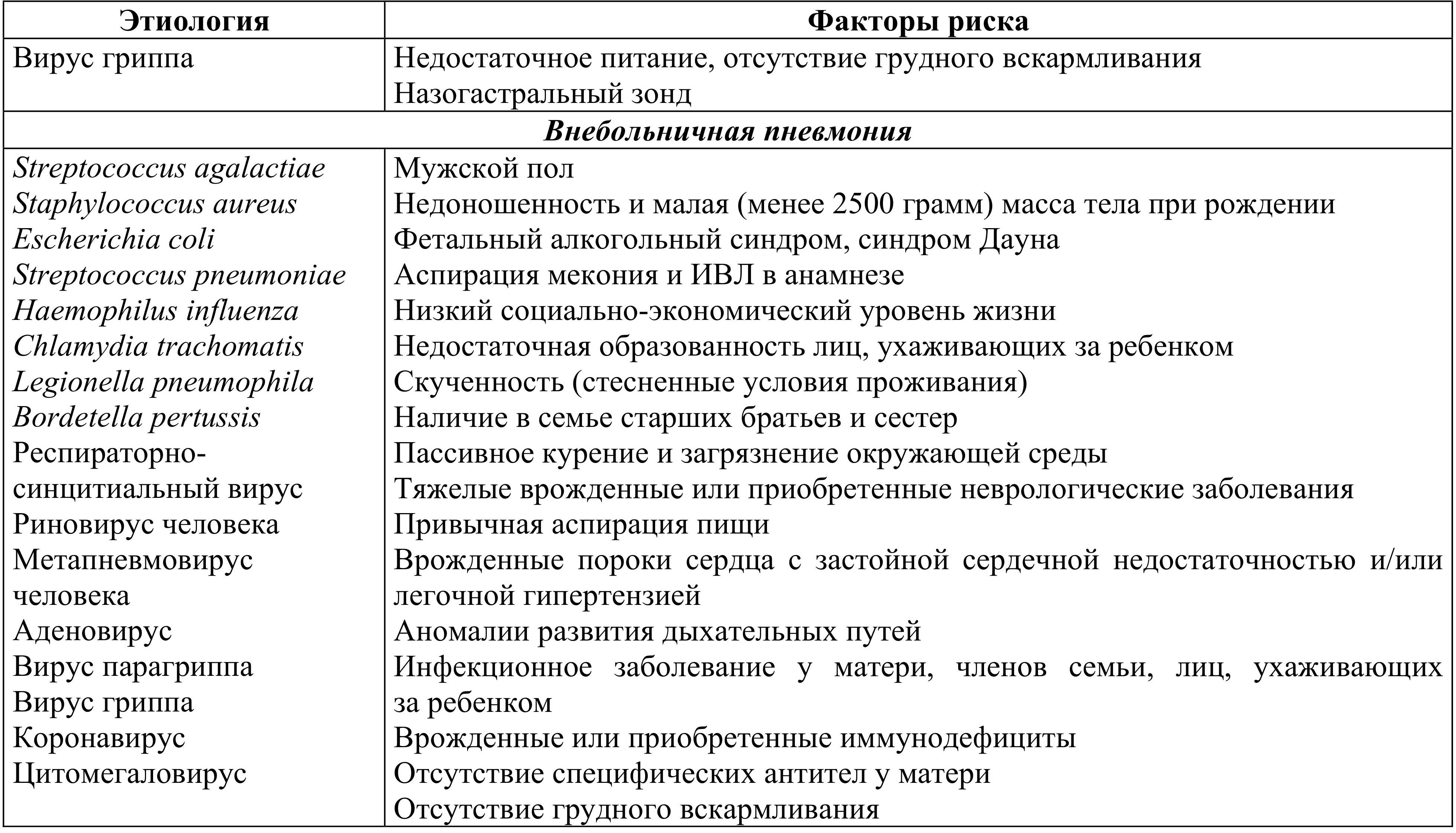
Вместе с тем, отсутствие факторов риска не исключает диагноз пневмонии.
Как можно видеть из данных табл. 1.1, этиология пневмонии у новорожденных различается в зависимости от возраста дебюта заболевания, условий возникновения и путей передачи инфекции. Врожденная или ранняя пневмония может возникнуть из-за попадания микроорганизмов в легкие из инфицированной околоплодной жидкости или трансплацентарно.
Колонизация влагалища матери Streptococcus agalactiae (группы В) является ключевым фактором риска раннего развития сепсиса, который часто сопровождается пневмонией. Данный возбудитель вызывает до 60–70 % врожденных интранатальных пневмоний; заболевание клинически обычно проявляется в первые сутки жизни как септицемия у 1/3 детей, пневмония в сочетании с менингитом – у 1/3 и нарастающая по тяжести пневмония – также у 1/3 детей. При отсутствии своевременного этиотропного лечения инфекция сопровождается высокой летальностью. Такая же прогрессия от колонизации слизистой оболочки дыхательных путей во время родов вследствие нахождения патогена в родовых путях до развития ранней пневмонии характерна для Escherichia coli, Chlamydia trachomatis.
Напротив, поздняя внебольничная пневмония у новорожденных обычно связана с инфицированием респираторными вирусами, циркулирующими в популяции в этот период времени. С вирусами связывают до 80 % случаев внебольничных пневмоний у детей первых двух лет жизни, однако в этих случаях правильнее говорить об остром бронхиолите, трудно отличимым от пневмонии. Однако возможно и нозокомиальное инфицирование респираторными вирусами, например, респираторно-синцитиальным вирусом (РСВ).
Основным эндогенным источником микроорганизмов, приводящих к пневмонии с поздним началом, является слизистая оболочка полости носа и ротоглотки. Высокий риск проникновения инфицированных секретов в нижние дыхательные пути имеют интубированные новорожденные и находящиеся в состоянии седации. Гастроэзофагеальный рефлюкс (ГЭР) и аспирация контаминированных секретов желудка представляет собой еще один путь развития легочной инфекции. Таким образом, пневмония у новорожденных является гетерогенным заболеванием, претерпевшим патоморфоз в связи с изменением контингента больных по мере совершенствования перинатальной медицины. Учет времени и условий возникновения заболевания, его факторов риска позволяет сделать обоснованные предположения об этиологии, терапевтических и профилактических стратегиях.
Морфология пневмонии определяется возбудителем, иммунным статусом организма, морфологическими особенностями воспалительной реакции и объемом поражения легочной ткани. Характер структурных изменений, выявляемых у новорожденного или плода при разных инфекциях, принципиально не отличается от тех, которые возникают в более старшем возрасте. При макроскопическом исследовании патологические изменения в виде увеличения плотности и снижения воздушности легочной ткани локализуются в области отдельных долей или сегментов или распространяются на целое легкое. Наблюдается полнокровие капилляров, повреждение эндотелия, что приводит к повышению проницаемости сосудистой стенки, быстрому накоплению эритроцитов, нейтрофилов, фибрина в альвеолах. Гиалиновые мембраны, подобные тем, которые наблюдаются при первичном дефиците сурфактанта у недоношенных при РДС новорожденных, характерны для стрептококковой, пневмококковой и гемофильной пневмонии. На ранних сроках инфекции гиалиновые мембраны содержат бактерии. Абсцессы, эмпиема плевры, пневматоцеле редко обнаруживаются при ранней пневмонии новорожденных и связаны с инфекцией, вызванной Streptococcus pneumoniae, Escherichia coli и Haemophilus ifluenzae. Частицы мекония или первородной смазки могут обнаруживаться в периферических дыхательных путях. Признаки синдрома утечки воздуха, эмфизематозного вздутия, отслойка эпителия дыхательных путей, вероятно, связаны с волю- и баротравмой и токсическим действием кислорода в результате ИВЛ.
Для гистологической картины стрептококковой пневмонии характерно наличие некрозов ткани со стрептококками по периферии, формирование гиалиновых мембран, некрозы в бронхах и бронхиолах. При хламидийной инфекции поражение носит чаще очаговый характер, в альвеолах обнаруживается серозный и фибринозный экссудат с примесью моноцитов, макрофагов, десквамированных альвеолоцитов, инфильтрация междолевых перегородок моноцитами и нейтрофилами. Аденовирусная пневмония характеризуется экссудатом в альвеолах в виде комочков и хлопьев, содержащих макрофаги и лимфоциты. Пневмония, вызванная РСВ, характеризуется образованием гигантских многоядерных клеток и синцития и начинается с поражения бронхиол и бронхов, в межальвеолярных перегородках обнаруживаются лимфоидные инфильтраты с деструкцией стенок альвеол. При цитомегаловирусной пневмонии, которая обычно является проявлением генерализованной инфекции, вирус размножается в эпителиальных клетках, при этом в бронхиолах и альвеолах появляются гигантские клетки, ядра которых напоминают совиный глаз, они появляются через 2 месяца после возникновения инфекции. Поражается интерстиций по типу альвеолита с лимфогистоцитарной инфильтрацией и умеренным фиброзом. Поражение легких при герпетической инфекции отличается очаговыми изменениями в виде выпота серозной жидкости в просвете альвеол, скопления мононуклеаров и слущенных альвеолоцитов с гигантоклеточным метаморфозом, участков спадения альвеол, некроза легочной ткани. Для врожденного листериоза характерно развитие в легочной ткани очаговых гранулем; поражение легких, как и при других врожденных инфекциях, обычно сочетается с поражением кожи, печени и других внутренних органов.
Клинические симптомы пневмонии у новорожденных неспецифичны. По сравнению с детьми более старшего возраста у новорожденных меньше признаков легочной инфекции, заболевание часто манифестирует как системное ухудшение состояния. Респираторные симптомы включают апноэ (у 8–10 % недоношенных и 30–40 % доношенных детей), тахипноэ (более 60 дыханий в минуту в покое), выявляемое у 60–89 % младенцев, втяжения (ретракции) уступчивых мест грудной клетки – у 36–91 % пациентов, кашель, который отмечается с частотой 30–84 %, цианоз имеет место у 12–40 % больных.
При ВАП у новорожденных частота выявления тахипноэ и цианоза может быть выше (95–100 %). Для хламидийной пневмонии характерен пароксизмальный коклюшеподобный (без реприз) кашель типа стаккато (от музыкального термина staccato, итал. – отрывисто). При тяжелой дыхательной недостаточности можно заметить раздувание крыльев носа, а также ритмичные движения головы в такт дыханию (симптом В.Ф. Знаменского), что связано с утомлением дыхательной мускулатуры и включением в акт дыхания грудиноключично-сосцевидной мышцы. Отек легких с повышением проницаемости легочных сосудов приводит к появлению в отечной жидкости дыхательных путей новорожденных белка, что клинически проявляется пенистым отделяемым из носа и рта. Частота данного симптома, описанного впервые Э.М. Кравец и получившего соответствующее эпонимное название, при пневмонии у доношенных детей может достигать 10–12 %, у недоношенных – 30–50 %.
Бронхиальный секрет может носить слизистый, слизистогнойный или гнойный характер, увеличение количества секрета или изменение его на гнойный – важный диагностический признак развития пневмонии у новорожденных, что легко заметить у интубированных детей. Аускультативные симптомы разнообразны и включают ослабленное или жесткое дыхание, локализованные или диффузные влажные хрипы или крепитацию. Частота выявления хрипов колеблется 15 до 85 %. Могут выслушиваться признаки бронхиальной обструкции – удлинение выдоха и сухие свистящие хрипы, причиной этого является обструкция дыхательных путей бактериальными и воспалительными продуктами, бронхоспазм под действием воспалительных медиаторов. При перкуссии определяется укорочение перкуторного звука над проекцией инфильтрации в легких. При этом притупление перкуторного звука обнаруживали 40 % доношенных новорожденных детей с пневмонией. Перкуссию не рекомендуется проводить у детей в тяжелом состоянии и у недоношенных младенцев, так как эта процедура может значительно ухудшить состояние ребенка, приводя к интракраниальным кровооизлияниям.
Общие симптомы неонатальной пневмонии включают в себя повышенную (свыше 12 %) первоначальную убыль массы тела, уплощение кривой массы тела, лихорадку (30–56 %) или гипотермию (15 %), слабое сосание и отказ от груди (30–50 %), диарею (10–15 %). Персистирующая лихорадка нехарактерный признак, однако сообщалось, что при вирусной пневмонии она имеет место. Также отмечаются вялость, мышечная гипотония, нарушения гемодинамики, серый цвет кожи, желтуха, геморрагические проявления. Врожденная пневмония без лечения обычно прогрессирует и часто осложняется персистирующей легочной гипертензией с соответствующими клинико-инструментальными проявлениями, включая кардиомегалию. При врожденной пневмонии вследствие внутриутробной инфекции с последующей аспирацией околоплодных вод помимо перечисленных выше клинических признаков часто наблюдаются симптомы поражения ЦНС вследствие перенесенной асфиксии.
Диагноз неонатальной пневмонии – клинико-рентгенологический. Изменения на обзорных рентгенограммах у данных пациентов варьируют и включают ретикулогранулярные и/или очаговые инфильтраты, двусторонние линейные затенения или диффузное снижение пневматизации легких, может выявляться компенсаторная повышенная воздушность в зонах, свободных от пневмонической инфильтрации. Рентгенологическая картина при неонатальной пневмонии практически неотличима от рентгенологических изменений, которые наблюдаются при других респираторных заболеваниях новорожденных, прежде всего РДС. Вместе с тем определенные рентгенологические признаки могут помочь в диагностике различных вариантов неонатальной пневмонии, а также при проведении дифференциального диагноза.
Врожденная пневмония должна исключаться при появлении новых инфильтративных затенений или при сохранении рентгенологических изменений в течение 48 часов после рождения. Гомогенное затенение легочной ткани или изменения по типу «матового стекла» обычно выявляются при пневмонии вследствие гематогенного заражения. При этом на фоне уплотнения легочной ткани могут быть видимы просветы бронхов (симптом «воздушной бронхограммы»), что типично для РДС недоношенных новорожденных.
Возможными рентгенологическими признаками в пользу врожденной пневмонии у недоношенных детей, по сравнению с РДС, могут быть появление крупно- и мелкоочаговых теней на фоне грубой сетчатости легочного рисунка, сгущение легочного рисунка в прикорневых зонах, умеренное повышение воздушности бронхограммы, значение кардиоторакального индекса менее 0,5 в возрасте 72 часов жизни. При РДС новорожденных легкие выглядят уменьшенными в размерах, в то время как при пневмонии может определяться повышение воздушности зон легочной ткани, участвующих в газообмене.
Неоднородные инфильтративные затенения по периферии, чаще наблюдающиеся в правом легком, преимущественно в верхних отделах, – результат аспирации. Сочетание генерализованной гиперинфляции (вздутия легочной ткани) с очаговыми инфильтративными изменениями предполагает пневмонию с обструкцией дыхательных путей воспалительным детритом, однако в случае использования ИВЛ такая рентгенологическая картина может быть связана со вздутием, причиной которого является высокое давление в дыхательных путях. Наличие пневматоцеле или абсцесса, а также присутствие плеврального выпота предполагают пневмонический процесс в легком бактериальной этиологии.
Лобарные или сегментарные рентгенологические затенения редко наблюдаются при пневмонии у новорожденных и при отсутствии характерной динамики изменений могут быть обусловлены альтернативными причинами, например, легочной секвестрацией. Важно оценить динамику рентгенологической картины, например, при ТТН рентгенологические симптомы быстро разрешаются в отличие от пневмонии. На фоне адекватной антибиотикотерапии пневмония разрешается клинически, что будет выражаться в смягчении параметров и прекращении респираторной терапии, и рентгенологически.
Необходимо помнить, что рентгенологическое выздоровление всегда отстает от клинического. Несмотря на попытки использовать отдельные рентгенологические признаки пневмонии для определения этиологии заболевания, в целом диагностическая информативность этих признаков низка. Исключением может быть пневмоцистная пневмония, для которой типичны распространенные очаговые тени разной величины и плотности, чередующиеся с буллезными вздутиями (картина, напоминающая хлопья падающего снега или ваты, как при остром РДС), резкое снижение пневматизации, имитирующее низкое качество снимка, пневмомедиатинум или пневмоторакс в результате разрыва булл.
Ультразвуковое исследование у новорожденных, как и при пневмонии у детей старшего возраста и взрослых, применяется для оценки состояния плевры и плевральной полости. Возможными показаниями для компьютерной томографии или магнитно-резонансной томографии грудной клетки, позволяющими отказаться от проведения инвазивных методов исследования, у новорожденных являются подозрения на наличие пороков развития и опухолей, дифференциальная диагностика при несоответствии клинико-рентгенологических данных, максимально ранняя диагностика осложнений воспалительного процесса для выбора тактики лечения.
Новорожденным с пневмонией рекомендуются бактериологические посевы содержимого зева, аспирата из трахеи, кала. Взятие крови на посев не является обязательной процедурой, и положительный высев не считается необходимым и достаточным для диагностики пневмонии у новорожденных. Окраска мокроты по Граму может быть информативной при преобладании одного бактериального морфотипа, что указывает на этиологическое значение этого микроба. Информативный образец мокроты должен содержать менее 10 клеток плоского эпителия и более 25 сегментоядерных нейтрофилов (при низком разрешении – ×100).
Рекомендуется проведение ПЦР крови (при необходимости биоматериала из других локусов) в режиме реального времени на TORCH-инфекции, вирусы, атипичные возбудители (буккальный соскоб, моча, аспират трахеи) в случае длительного нахождения матери на стационарном лечении во время данной беременности, проведения неоднократных курсов антибактериальной, гормональной и/или цитотоксической терапии, наличие у нее имплантированных органов или устройств (например, искусственные клапаны), а также в случае наличия факторов риска развития инфекции.
Наиболее информативными и надежными маркерами бактериальной инфекции считают гематологические (общее число нейтрофилов, незрелых клеток) и такие биохимические показатели, как прокальцитонин (ПКТ) и С-реактивный белок (СРБ), которые необходимо оценивать комплексно, их количественные пороговые значения зависят от возраста. ПКТ не рекомендуется использовать для диагностики врожденной пневмонии. В то же время он был признан чувствительным для диагностики нозакомиальной инфекции. Исследование плаценты может помочь в диагностике пневмонии и определении ее этиологии. Изменения в плаценте (децидуит, фунизит, инфильтрации тканей плаценты) могут косвенно указывать на реализацию инфекционного процесса у новорожденного и расцениваются в качестве дополнительного фактора при постановке диагноза пневмонии.
Таким образом, диагностика неонатальной пневмонии основана на определении антенатальных и постнатальных факторов риска (табл. 1.1), респираторных и общих симптомов, рентгенологических признаков, маркеров бактериальной инфекции и результатов этиологической диагностики. С учетом многообразия форм пневмоний у новорожденных были предложены различные варианты диагностических критериев пневмонии в этом возрасте, отдельно для различных вариантов. В 2016 г. международная рабочая группа разработала диагностические критерии неонатальных инфекций, включая респираторные инфекции, расцениваемые авторами как высокочувствительные и высокоспецифичные. Эти диагностические подходы содержат рекомендации по диагностике пневмонии у новорожденных в зависимости от условий (уровня) оказания медицинской помощи от наибольших до наименьших (в условиях ограниченных ресурсов здравоохранения) (табл. 1.2).

Таблица 1.2 Определение случая респираторной бактериальной, грибковой, вирусной инфекции у новорожденных в зависимости от уровня клиники
Диагностика пневмонии у новорожденных затрудняется неспецифичностью ранних клинических проявлений, низкой диагностической ценностью физикальных симптомов, большой частотой возможных сопутствующих неинфекционных поражений легких, включающих РДС новорожденных, синдром аспирации мекония, формирующуюся бронхолегочную дисплазию у детей в периоде новорожденности.
Этиотропная терапия неонатальной пневмонии основана на использовании антибактериальных средств. Лечение назначается при подозрении на реализацию врожденной пневмонии и при наличии показаний по результатам первичного клинико-лабораторного исследования. В первом случае показаниями для лечения являются респираторные нарушения у детей, родившихся с экстремально низкой массой тела (ЭНМТ) и очень низкой массой тела (ОНМТ), терапия назначается не позднее 2 часов после рождения, а новорожденным с ЭНМТ уже в родильном зале. Терапия по подозрению, назначенная в первые сутки, должна отменяться при отсутствии диагностических критериев, подтверждающих наличие пневмонии в первые 72 часа жизни.
Показаниями для терапии по результатам клинико-лабораторного исследования являются дыхательные нарушения у пациентов, родившихся с массой тела более 1500 грамм, не потребовавших ИВЛ и находящихся на неинвазивной респираторной терапии или без нее.
При установлении диагноза пневмонии антибактериальная терапия продолжается не менее 7 дней. Антибактериальные препараты отменяются при нормализации маркеров бактериальной инфекции. Для стартовой терапии используется комбинация ампициллина с гентамицином. Не рекомендуется назначать вместо полусинтетических пенициллинов цефалоспорины, так как они не чувствительны в отношении листерии. После получения результатов исследования чувствительности к антибактериальным препаратам необходимо провести коррекцию терапии.
При пневмонии с поздним началом, возникшей в стационаре, первичная терапия должна включать как минимум два антибиотика, действующих на большинство лекарственноустойчивых грамположительных и грамотрицательных микроорганизмов, при этом один должен обладать активностью против метициллин-резистентного стафилококка (ванкомицин или линезолид). Лечение тяжелобольных детей с пневмонией с поздним началом с учетом ее возбудителей (мультирезистентные штаммы Pseudomonas aeruginosa, Klebsiella spp., Acinetobacter spp., метициллин-резистентный Staphylococcus aureus) должно начинаться с 3-компонентной терапии, включающей:
(1) антипсевдомонадный цефалоспорин (цефепим, цефтазидим) ИЛИ антипсевдомонадный карбапенем (имипенем или меропенем) ИЛИ β-лактам/ингибитор β-лактамазы (пиперациллин + тазобактам) +
(2) антипсевдомонадный фторхинолон (ципрофлоксацин или левофлоксацин) ИЛИ аминогликозид (амикацин, гентамицин или тобрамицин) +
(3) линезолид или ванкомицин.
При пневмонии, вызванной хламидиями, микоплазмами, уреаплазмой, назначаются макролиды; при пневмоцистной пневмонии – триметоприм/сульфаметоксазол (бисептол).
Продолжительность антибактериальной терапии контролируется состоянием пациента, динамикой лабораторных данных. Сохранение остаточных рентгенологических изменений в виде усиления легочного рисунка и участков гиповентиляции при нормализации состояния и лабораторных данных не является показанием для продолжения терапии.
Профилактика врожденной пневмонии заключается в своевременном выявлении и лечении инфекционных заболеваний у матери во время беременности. Для профилактики поздней нозокомиальной пневмонии и ВАП необходимо ограничение возможностей перекрестного заражения между лицами, ухаживающими за больными, и пациентами, уменьшение повреждения тканей от продолжительной или повторной интубации, а также следует избегать лекарств, которые могут способствовать развитию инфекции и/или устойчивости к антибиотикам, гигиена полости рта и санация легких. У детей групп риска тяжелой РСВ-инфекции проводится пассивная иммунопрофилактика с помощью паливизумаба.
01.12.2022 | 22:03:55