Делирий. Синдром острой церебральной недостаточности. Делирий у пожилого пациента.
Раздел: Статьи
/
Общая врачебная практика.
/
Неврология.
/
Делирий. Синдром острой церебральной недостаточности. Делирий у пожилого пациента.

Психомоторные нарушения, наблюдаемые при делирии, подразделяются на три фенотипических подтипа.
• Гиперактивный подтип характеризуется психомоторным возбуждением, беспокойством, эмоциональной лабильностью, слезливостью, раздражительностью. Иногда психиатры ошибочно принимают его за первичный эпизод психоза, манию или деменцию. Имеют место чрезмерная реакция на свет, поисковое поведение (пациент может звать кого-то близкого), ажитация, самоповреждающее поведение (расчесывание, выдергивание катетеров), импульсивность.
• Гипоактивный подтип характеризуется психомоторной заторможенностью, вялостью, снижением уровня реактивности, часто упускается или ошибочно диагностируется как гериатрическая депрессия.
• Смешанный подтип проявляется чередованием признаков обоих подтипов. Часто данный тип мы наблюдаем в послеоперационный период у онкологических пациентов.
Делирий является наиболее распространенным нейрокогнитивным синдромом, наблюдаемым у гериатрических пациентов. Заболеваемость, по общемедицинским данным, колеблется от 11 до 42%, а среди тяжелобольных — до 87%. Наличие нейрокогнитивных нарушений [например, болезнь Альцгеймера - БА, болезнь Паркинсона - БП, лобно-височной деменции (ЛВД)] увеличивает риск развития делирия в 5 раз (Wilson, 2020). Другие факторы риска включают тяжелое соматическое заболевание, сенсорные нарушения и мужской пол (Thom, 2019).
Таблица 1.1. Факторы, влияющие на появление делирия
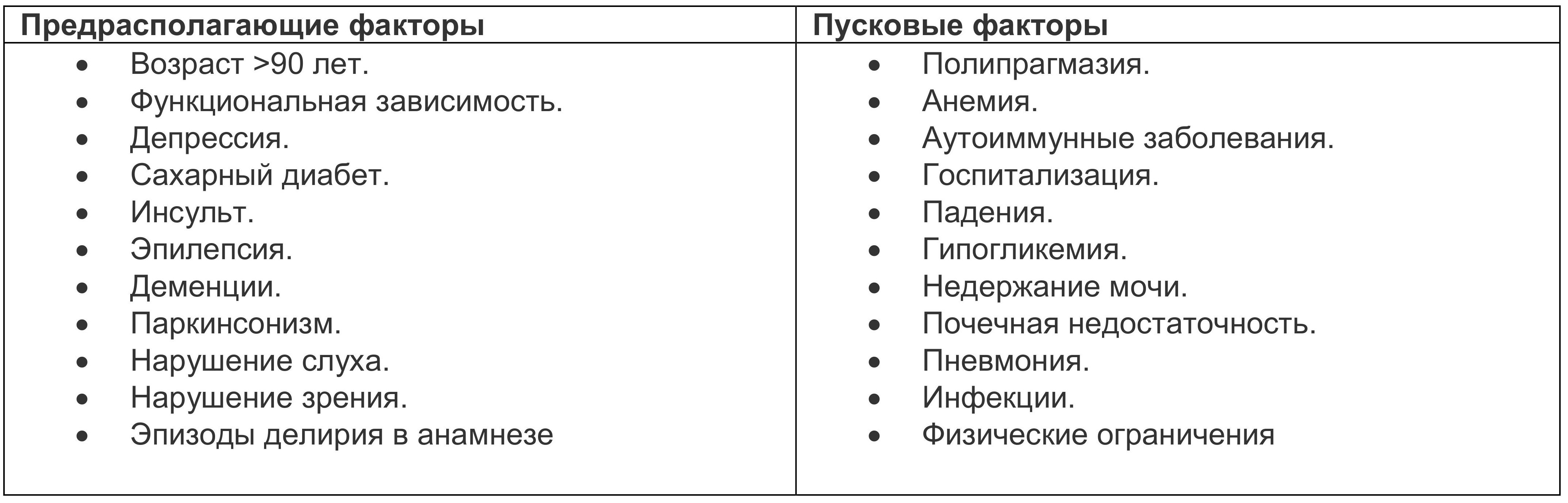
Общие классы так называемых делириогенных лекарств включают ряд обезболивающих препаратов, снотворные (такие как бензодиазепины) и антихолинергические средства. Частота делирия особенно высока у послеоперационных гериатрических пациентов, а также у тех, кто получал искусственную вентиляцию легких в отделении интенсивной терапии (особенно актуально было в период пандемии коронавируса, 70%).
Если раньше делирий исторически рассматривался как расстройство, ограниченное по времени, то теперь все чаще признаются сопутствующая патология (как краткосрочная, так и долгосрочная), смертность и финансовые издержки. Показано, что даже если есть контроль за предрасполагающими факторами, включая нейрокогнитивные нарушения, сопутствующие заболевания и тяжесть заболевания, делирий независимо связан с двукратным увеличением риска смерти в 2 раза, госпитализации — в 2,4 раза и деменции — в 12,5 раза (Witlox, Eurelings, 2010). Делирий также был тесно связан с устойчивым снижением физической функции, появлением спектра избегающего поведения, ограничений. Было показано, что у пациентов с нейрокогнитивными расстройствами и без них множественные симптомы делирия сохраняются в течение 12 мес, носят флуктуирующий характер. Часто сами гериатрические пациенты не могут описать эти изменения специалисту, отмечая, что наблюдают в себе существенные изменения. Хотя делирий встречается часто, диагноз основан на высоком показателе подозрительности (красных флажках), так как он часто остается незамеченным или неправильно диагностируется.
Делирий в гериатрической практике часто трудно выявить, он диагностируется в 31% случаев. Показано, что до 40% госпитализированных гериатрических пациентов, направленных на психиатрическую консультацию по поводу депрессии, демонстрировали проявления делирия. Существует множество проблем, связанных со своевременным установлением диагноза «делирий», включая неустойчивое течение симптомов, трудности проведения нейрокогнитивного обследования во время экстремальных психомоторных нарушений, игнорирование гипоактивного фенотипа и необходимость установления исходного уровня когнитивного функционирования.
Тщательная клиническая оценка считается золотым стандартом диагностики делирия, так как не существует клинического исследования или биомаркера с высокой чувствительностью и специфичностью. Хотя исследования электроэнцефалограммы (ЭЭГ) обычно показывают на генерализованное замедление, ложноотрицательные и ложноположительные показатели приближаются к 20%, ограничивая полезность этого инструмента (Trzepacz, Brenner, 2011).
Были разработаны многочисленные инструменты скрининга делирия с высокой чувствительностью и специфичностью, включая Confusion Assessment Method и быстрый клинический тест 4AT, которые улучшают статистику обнаружения делирия различными медицинскими работниками (Bellelli, Morandi, 2014).
В гериатрической практике применяют следующие диагностические шкалы: Memorial Delirium Assessment Scale (MDAS), реже — Delirium Rating Scale Revised 98 (DRS-R-98), Delirium Triage Screen (DTS), 3-Minute Diagnostic Confusion Assessment Method (3D-CAM). Можно применять тест рисования часов (The Clock Drawing Test) с уточнением, что сама по себе данная шкала не является приемлемым инструментом для оценки делирия у пожилых людей, хотя она показывает когнитивные нарушения после перенесенного делирия.
Если говорить о дифференциальной диагностике, то делирий у гериатрических пациентов с соматическими заболеваниями часто является многофакторным, и хотя большое внимание уделяется широкому наблюдению и мониторингу сопутствующих факторов, клинический психолог и психиатр часто должны уделить особое внимание потенциальным нейропсихиатрическим процессам. Отказ от психоактивных веществ может потребовать тщательного изучения истории болезни для выявления и уточнения характера употребления даже назначенных бензодиазепинов и опиоидов. Это также может помочь в оценке риска припадков. Многие широко используемые препараты, включая некоторые опиоиды, антинаркотические препараты, антимигриновые препараты, стабилизаторы настроения, линезолид и ритонавир, обладают серотонинергической активностью. Тщательный анамнез лечения может прояснить риск развития серотонинового синдрома, особенно у пациентов, которые постоянно принимают серотонинергические препараты и которым затем требуются дополнительные серотонинергические препараты для решения острых соматических проблем. Более широкий дифференциальный диагноз может быть рассмотрен в контексте рассказа пациента во время консультации. Иммуносупрессия повышает риск развития оппортунистических инфекций ЦНС, включая вирусный энцефалит, простой герпес, а также различные виды рака, который может метастазировать в мозг. Тяжелые метаболические нарушения могут привести к развитию аранеопластических синдромов, центрального понтинного миелинолиза (после быстрой коррекции гипонатриемии), гипераммонемии и судорог; коагулопатии, фибрилляция предсердий и эндокардит предрасполагают к инсульту; а крайняя гипертензия может дать основания для рассмотрения синдрома задней обратимой энцефалопатии и инсульта. В дополнение к этиологии делирия, упомянутой выше, другие распространенные этиологии включают инфекцию, снижение сенсорного ввода (оглушенность), задержку мочи или фекальное инденсивное воздействие, метаболические нарушения и миокардиальные или легочные расстройства. Дальнейшее исследование этих этиологий будет зависеть от клинической картины гериатрического пациента и результатов скрининговых лабораторных исследований. Имея практический опыт, было бы разумно рекомендовать неврологическую консультацию при наличии очаговых неврологических находок, включая любую новую асимметрию при физикальном обследовании, двигательные аномалии, устойчивое плохое психическое состояние (относительно эпилептического статуса) и резкое ухудшение психического состояния после периода делирия, ранее проявившегося в основном невнимательностью и дезориентацией.
Данные показывают, что делирий может быть связан с психологической болезненностью, включая симптомы ПТСР, тревоги и депрессии, и что острые психологические реакции в отделении интенсивной терапии являются сильным фактором риска психологической заболеваемости в течение 3 мес. В клинической практике мы наблюдаем, что пожилые люди, перенесшие делирий, демонстрируют раздражительность, слезливость, обидчивость, тревогу о здоровье, настороженность, нарушения сна. Однако стойкие воспоминания о делирии на протяжении 3-го месяца связаны с развитием ПТСР независимо от тяжести болезни. Предполагается, что наличие делирия само по себе может быть независимой причиной дистресса, состояние получило название дистресса после делирия (distress in delirium, DID) (Williams, 2020). Точно так же ухудшение функционального состояния связано с повышением дистресса после делирия. У онкологических пациентов, которые вспоминали свой опыт делирия, снижение производительности в деятельности положительно коррелировало с тяжестью дистресса. Хотя когнитивные нарушения, деменция и пожилой возраст являются факторами риска развития делирия, нет достаточных доказательств того, влияют ли они на припоминание делирия и, следовательно, на риск развития специфического дистресса после делирия.
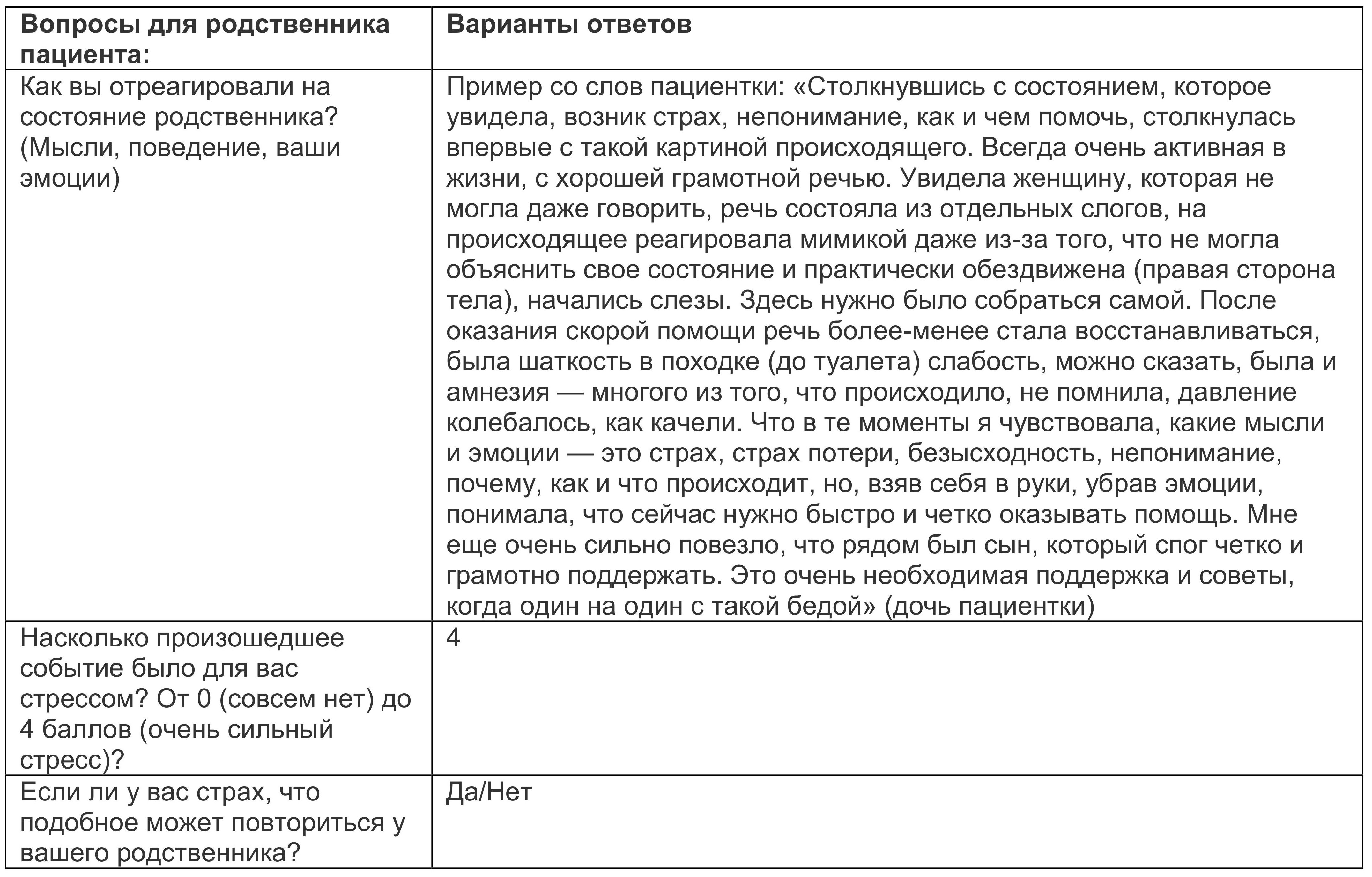
Наличие изменений в мышлении и психомоторное возбуждение были независимыми факторами, определяющими степень тяжести дистресса. В послеоперационный период делирий, аномальные мыслительные процессы, лабильный аффект, языковые нарушения, возбуждение и дезориентация, оцениваемые с помощью специальной диагностической шкалы, были связаны с повышением дистресса. Интуитивно можно было бы предположить, что дистресс после делирия будет отличаться в зависимости от подтипов делирия. Однако имеющиеся данные свидетельствуют о том, что подтип делирия (гиперактивный, гипоактивный или смешанный) не имеет никакого значения для степени дистресса. Это имеет важные клинические последствия: гипоактивный делирий более распространен и в то же время недостаточно диагностирован. Пациенты с гипоактивным делирием могут не проявлять явного возбуждения, но вполне вероятно, что они испытывают тот же уровень дистресса и психологической болезненности, что и пациенты с гиперактивным делирием. Тяжесть дистресса связана со степенью припоминания эпизода делирия. Точно так же дистресс после делирия могут испытывпть не только сами пациенты; родственники или опекуны, наблюдающие за состоянием пациента, также могут испытывать значительные страдания, иногда даже более выраженные.
Рекомендуется оценивать дистресс после перенесенного делирия у гериатрического пациента с помощью:
• Опросника по состоянию здоровья (PHQ-9) (обращайте внимание на апатию, проблемы со сном, усталость/упадок сил);
• Generalised Anxiety Disorder 7-item Scale (GAD-7) (обращайте внимание на тревожность, раздражительность, взвинченность, неспособность усидеть на месте);
• PHQ-9 (обращайте внимание на болевые проявления, усталость / упадок сил, нарушения сна, головную боль, желудочно-кишечные проявления, тахикардиальные знаки).
Дополнительно проводится обследование с помощью шкалы Delirium Experience Questionnaire (DEQ).
Таблица 1.2.
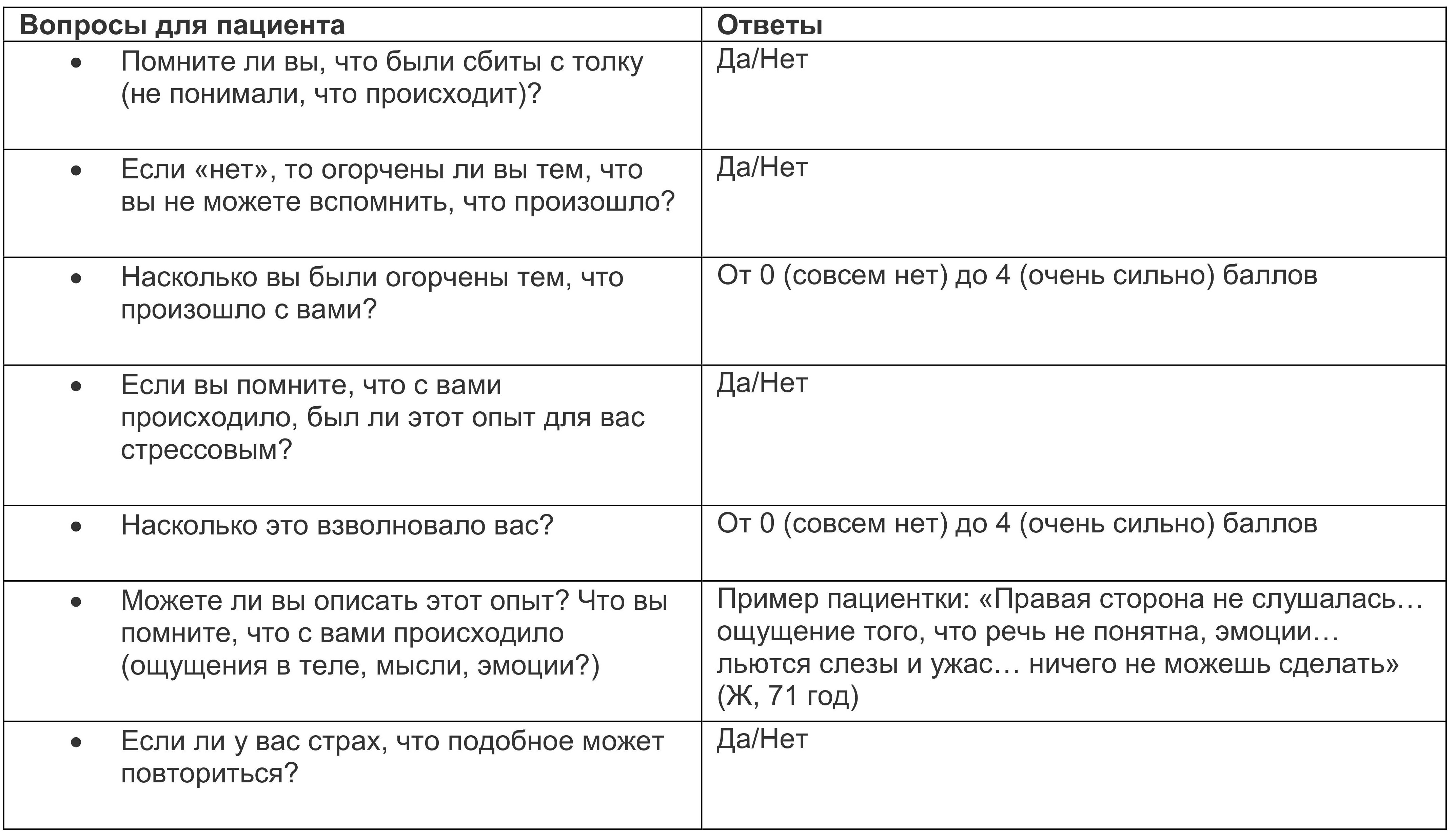
Таблица 1.3.
По сей день патофизиологическая основа делирия еще не полностью выяснена, делирий может быть концептуализирован как конечный общий итог, возникающий в результате множества факторов, приводящих к нарушению функции нервной системы. Воспаление, гипоксия и окислительный стресс способствуют повышенному воздействию токсинов на мозг и гипохолинергическому-гипердопаминергическому состоянию. Воспаление создает уязвимое физиологическое состояние, при котором нарушается работа мозга, функция и повышенная проницаемость гематоэнцефалического барьера.
Восприимчивость к циркулирующим делириогенным препаратам, эндогенным токсинам и провоспалительным цитокинам может вызывать или поддерживать делирий у гериатрических пациентов (Hughes, Pandharipande, 2016). Микроагрегаты фибрина и нейтрофилов в сосудистой системе головного мозга могут вызывать субклинические эпизоды снижения церебральной перфузии, особенно у пациентов с сосудистыми заболеваниями тяжелой степени. Субклинические транзиторные гипоксические состояния приводят к снижению синтеза ацетилхолина, основного нейромедиатора ретикулярной активирующей системы. Ретикулярная активирующая система в первую очередь участвует в регуляции бдительности и внимания, нарушение которых является признаком делирия (Stern, Fricchione, 2010). Поскольку неповрежденная бдительность и внимание являются фундаментальным субстратом для всех областей познания, когнитивный дефицит, наблюдаемый при делирии, диффузен и неспецифичен. Таким образом, любые специфические когнитивные нарушения, выявленные при обследовании у гериатрического пациента в состоянии делирия, следует интерпретировать с осторожностью. Окислительный стресс приводит к высвобождению эндогенного дофамина, который, как полагают, является основной причиной нарушений восприятия, наблюдаемых при делирии (Maldonado, 2013). Другие нейромедиаторные расстройства, связанные с делирием, включают дефицит мелатонина, приводящий к нарушению цикла «сон — бодрствование», и избыток норадреналина и глутамата.
Делирий связан с аберрантными нейронными взаимодействиями между супрахиазматическим ядром (биологическими главными внутренними часами) и корковыми областями, находящимися в состоянии покоя. По сравнению с пациентами, не страдающими делирием, у пациентов с делирием функциональная соединительная способность от супрахиазматического нуклеоза увеличивалась до передней поясной коры и снижалась до задней поясной коры, парагиппокампальной извилины, мозжечка и таламуса (Kyeong, Choi, 2017). Функции областей, демонстрирующих снижение связности, соответствуют клиническим симптомам делирия, включая роль задней поясной коры в поддержании осознания внешней среды, парагиппокампальной извилины, участвующей в обеспечении памяти, а также мозжечка и таламуса в процессе координации движений.
Делирий также связан с повышением функциональной связности между дорсолатеральной префронтальной корой и задней поясной корой, а также со снижением связности подкорковых областей (Choi, Lee, 2012). Связь между кортикальной атрофией и делирием остается спорной (Nitchingham, 2018). Одно исследование показало, что, хотя соотнесенная с БА атрофия коры головного мозга не предсказывала частоту делирия, она была связана с большей тяжестью делирия (Racine, Fong, 2017), Нейроваскулярные изменения, включая гиперинтенсивность белого вещества и церебральные инфаркты, неизменно ассоциировались с повышенным риском развития делирия (Kant, de Bresser, 2017). Эти нейроваскулярные изменения, вероятно, повышают уязвимость к гемодинамическим сдвигам во время физического заболевания.
У лиц с высокой вероятностью проявления делирия в клинических условиях, таких как отделения интенсивной терапии и послеоперационные отделения, полезно прогнозировать риск делирия для обоснования прогноза и анализа соотношения риска и пользы плановой операции.
Полезность включения предоперационных нейропсихологических показателей, таких как симптомы депрессии, когнитивное функционирование и результаты нейровизуализации, интраоперационные параметры, при прогнозировании риска послеоперационного делирия постоянно является областью исследований (El-Gabalawy, Patel, 2017).
Нефармакологические стратегии профилактики делирия являются наиболее эффективными стратегиями снижения заболеваемости, смертности и расходов на здравоохранение, связанных с делирием. Протокол профилактики делирия нацелен на шесть факторов риска:
• ориентировку, контакт (голосовой, тактильный) с значимым человеком;
• мобилизацию, двигательную активность;
• сбалансированность медикоментозного лечения;
• цикл «сон — бодрствование». качество сна, минимизацию дневной сонливости;
• сенсорные нарушения;
• обезвоживание.
Было показано, что этот протокол может быть адаптирован и эффективен в других условиях, включая хирургические отделения и дома престарелых (Chen, Li, 2017). Экологические стратегии, способствующие укреплению сна, например, минимизация ночного шума и светового воздействия, также способствуют профилактике делирия (Patel, Baldwin, 2014). Наконец, минимизация физических ограничений, которая позволяет гериатрическим пациентам участвовать в ранней мобилизации, имеет решающее значение, так как использование физических ограничений увеличивает шансы стойкого делирия в 3 раза (Inouye, Zhang, 2007). Кроме того, к лечению должна быть привлечена семья, поскольку в первую очередь ухаживают за пожилым человеком те, кто знает пожилого человека и знает, как лучше позаботиться, чтобы уменьшить страх, боль или придать уверенность, показать, что тот в безопасности. Переориентацию и поведенческие вмешательства следует предпринимать, поддерживая постоянный визуальный, тактильный контакт с пожилым человеком. Следует избегать физических ограничений и отдавать предпочтение тихой обстановке с тусклым светом, без шума, посещений или техник, которые могут еще больше повлиять на пожилого человека.
Стратегии профилактики не менее важны в условиях интенсивной терапии. Многие лекарства, используемые для достижения степени седации и обезболивания, необходимой для искусственной вентиляции легких, включая бензодиазепины, пропофол и опиоиды, являются делириогенными. Было продемонстрировано, что ежедневное прерывание седации безопасно, уменьшает продолжительность как искусственной вентиляции легких, так и пребывания в отделении интенсивной терапии (Kress, Pohlman, 2000).
Резюме. У гериатрического пациента есть множество факторов риска развития делирия, включая когнитивные нарушения, многочисленные медицинские проблемы и др. У него есть физические признаки ограниченной подвижности и истощения, и он также подвержен риску полипрагмазии. Консультация клинического психолога и психиатра будет включать оценку нейрокогнитивного, эмоционального фона и выявление основных медицинских этиологий, которые могут способствовать изменениям психического статуса (включая инфекцию, уремию и гипергликемию). Рекомендации будут включать нефармакологические вмешательства, выявление возможных факторов, связанных с медикаментозным лечением делирия, и назначение вспомогательных лекарств для борьбы с возбуждением. Важными целями лечения являются безопасность и облегчение симптомов, включая управление сопутствующим риском возбуждения с минимальным использованием ограничений.
08.03.2023 | 18:32:00