Микрофлора кишечника. История изучения, состав, функции, методы оценки микробиоты. Лечение нарушений микробиоты. Фекальная трансплантация.
Раздел: Статьи
/
Общая врачебная практика.
/
Гастроэнтерология
/
Микрофлора кишечника. История изучения, состав, функции, методы оценки микробиоты. Лечение нарушений микробиоты. Фекальная трансплантация.
Содержание
Введение
Историческая справка
Состав кишечной микробиоты
Микрофлора кишечника. Все люди разные
Стабилизирующие факторы
Микробиота толстой кишки
Функции микробиоты
Питание микробиоты
Методы оценки микробиоты
Микробиота и болезни человека
- микробиота и атеросклероз
- микробиота и артериальная гипертензия
- микробиота и ожирение
- микробиота и сахарный диабет
- кишечник и мозг
- микробиота и аутоиммунные заболевания
- аллергические заболевания
- старение и микробиота
Стратегия лечения нарушений микробиоты
Сейчас появилось феноменальное количество новых данных, и наши представления о «дисбактериозе» и «кишечной микрофлоре» кардинально поменялись. Доминирующими видами оказались те, о существовании которых мы даже не подозревали, а многие «старые друзья» попали в минорные группы. Открытие новых, прежде всего генетических, методов исследований произвело революцию в нашем отношении к обитателям кишечника и предоставило невиданные до того перспективы в терапии.


Для начала внесем ясность в терминологию: привычную «микрофлору» вытеснила более логичная «микробиота», определяющая всю совокупность населяющих нас микроорганизмов. Новый термин «микробиом» характеризует совокупность всех генов микроорганизмов.
XVII век. Вспомним человека, который знаком нам со школьных учебников, Антони Левенгука. Он был лавочником, прожил огромную по тем временам жизнь (90 лет!), из которых 70 занимался торговлей. Но еще в юности он был потрясен тем, как маленькие отшлифованные фрагменты стекла увеличивают объект. Так он создает микроскоп. Ему же принадлежит приоритет в описании целого ряда различных микроскопических объектов, в том числе микроорганизмов.
ХХ век. Великий русский ученый, Илья Ильич Мечников, более 100 лет назад впервые сделал предположение о влиянии кишечных микроорганизмов на здоровье человека. Немецкий ученый Альфред Ниссе считает, что фекальные микроорганизмы обладают некими антагонистическими свойствами. Его труды легли в основу учения о дисбактериозе гениального физиолога Александра Михайловича Уголева, которое несколько десятилетий определяло наши отношения с кишечной микробиотой.
Кстати, именно он открывает пристеночное пищеварение, именно он предполагает, что в термически необработанных продуктах существуют свои собственные ферменты, обусловливающие их переваривание.
И наконец, революционный прорыв произошел после того, как появились методы генетического исследования.
В 2007 году запущен крупнейший международный проект Human Microbiome Project (HMP), в котором участвует и Россия. Полученные благодаря этому исследованию данные в корне изменили наше представление о микробиоте.
Стремительно нарастающий интерес к метагеному подтверждается ежегодным ростом финансирования генетических проектов. Даже на изучение генома человека не закладывалось столько средств, сколько сейчас идет на расшифровку генома бактерий. Этим подчеркивается огромная значимость микробиоты для здоровья человека вообще.
Согласно данным проекта HMP, тело человека населяет около 100 триллионов живых бактерий, то есть оказалось, микробных клеток в 10 раз больше, чем наших собственных! А суммарный вес только кишечных бактерий составляет 2–3 кг, что позволяет считать микробиоту одним из самых крупных «органов» человека. Кстати, именно Уголев первый предложил рассматривать микробиоту кишечника как отдельно взятый орган со своей анатомией и физиологией.
Данные о количестве микробных генов потрясли еще больше: оказалось, оно превышают количество генов человека в сотни раз! Получается, что микробиота – метаболически активный орган, который вкладывает в общий метаболизм гораздо больше процентов, нежели наши собственные гены. Существует такое понятие, как «суперорганизм», – совокупность всех генов и человека, и населяющих его микроорганизмов.
Генетические исследования показали, что микроорганизмы, о которых мы имели хоть какое-то представление, составляют всего лишь 7%, а 93% оказались вообще не известны науке. Было выявлено огромное количество новых видов микроорганизмов, общее число которых превышает 10 000! Культуральные же методы исследования за предыдущие 150 лет выявили всего лишь около 700–800 видов. Получается, что более 90% видов населяющих кишечник бактерий некультивируемые.
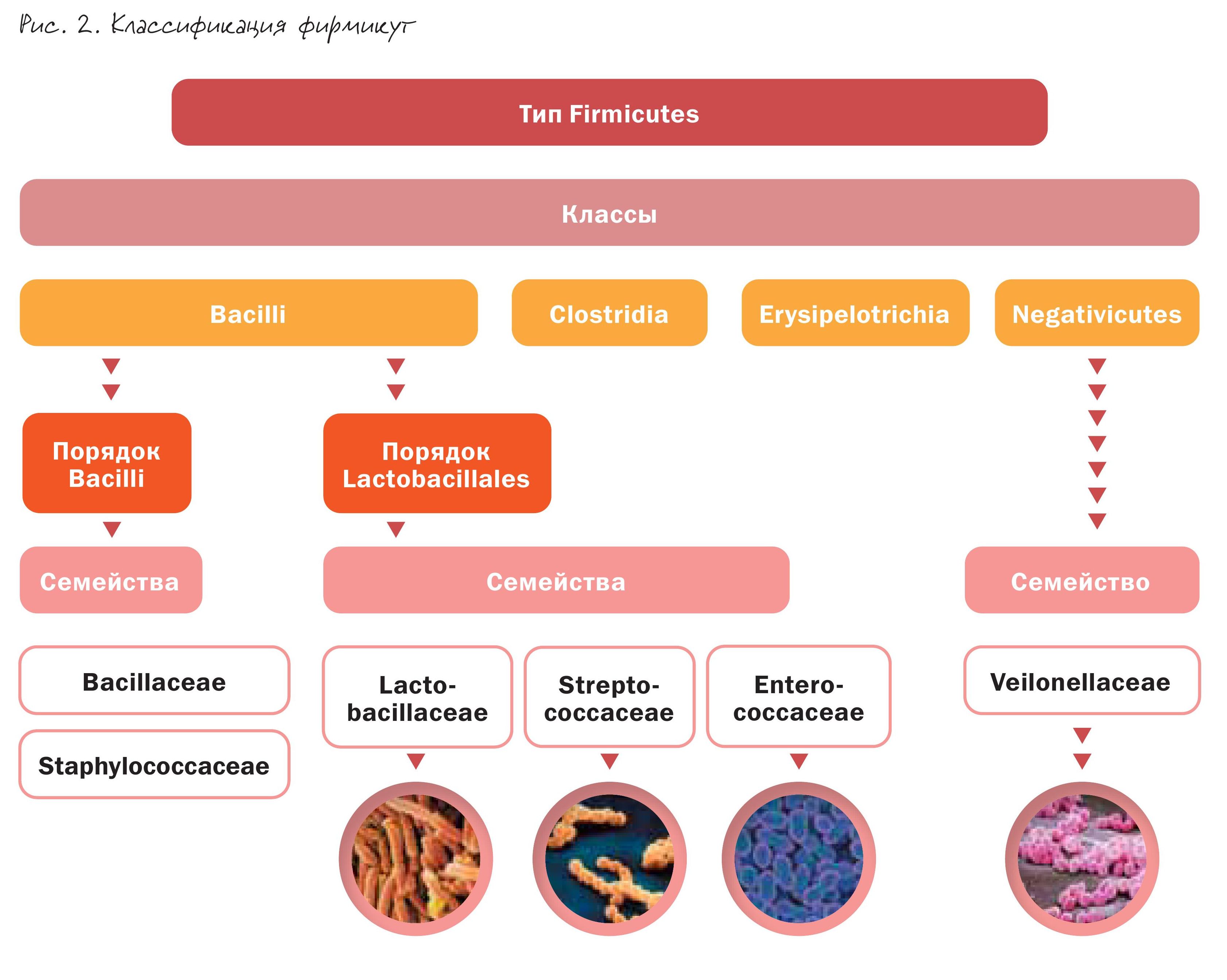
Всего выделили около 27 типов или «филлов» бактерий. Для человека основное значение имеют 6 (рис. 1).

Лидирующая группа – это фермикуты, составляющие, по различным данным, от 40 до 60% всего кишечного микробиома. Удивительно, но раньше мы ничего не знали об основных обитателях кишечника.
Вторая по численности группа – бактероиды – 40–60%, о них, безусловно, мы какое-то представление имели, хотя далеко не полное.
Менее значимые филы – актинобактерии, протеобактерии, верукомикробы и фузобактерии – составляют суммарно до 10%.
Фирмикуты (рис. 2) – крайне трудно культивируемые бактерии. К ним относят семейства Ruminococcaceae и Lachnospiraceae, играющие огромную роль в переработке пектинов и крахмала, а также известные нам лактобациллы, которые не являются доминирующими по численности, но вносят существенный вклад в метаболизм суперорганизма.
Бактероиды (рис. 3): помимо собственно семейства бактероидов выделены такие микроорганизмы, как рекинеляции, порфиромонодации и превотеллы, о которых получено много интересных данных, в том числе об их влиянии на развитие онкологических заболеваний.

Актинобактерии (рис. 4) – к ним относят известные нам бифидобактерии, а также коринобактерии и гарднереллы – в совокупности они составляют всего лишь 3%. Любопытный факт: бифидобактерии важны только для детей младшего возраста, у взрослых они относятся к минорным группам.

Однако микробиота желудочно- кишечного тракта представлена не только бактериями, но и вирусами, археями, грибами. Огромное значение имеют бактериофаги. На 1 микробную клетку приходится около 9 фагов. Есть предположение, что они являются ведущим механизмом, контролирующим состав и численность бактерий. Однако фагом (геном фагов) очень сложно поддается расшифровке, поэтому пока о них известно совсем немного. Следующая группа, выделенная из большого домена бактерий, – археи. Мы знали о них как о древних микроорганизмах, обитающих в вулканах и горячих источниках, но оказалось, что археи также обитают в кишечнике человека и вносят немалый вклад в наш метаболизм.
Известно, что наш геном на 99,99% совпадает с геномом любого другого человека. Но это не касается кишечной микробиоты: здесь совпадает всего 10% генов. То есть люди различаются в большей степени за счет генома микроорганизмов, нежели за счет собственного.
От чего же зависит состав микробиоты? (рис. 5)

1. Первое и самое главное – как рожден человек. При кесаревом сечении происходит заселение в основном больничными и кожными биотами, при естественных родах – нормальной вагинальной микробиотой.
2. Грудное вскармливание.
3. Особенности питания – сравнивали вегетарианцев и мясоедов, а также различные возрастные категории (выяснилось, что микробиом у детей и у стариков абсолютно разный).
4. Различные заболевания.
Основной вопрос, который родился в ходе исследований: что же в первую очередь определяет состав микробиоты – генетика человека или среда? И вот данные, опубликованные в 2018 году в журнале Nature. Изначально целью исследования было проверить влияние на состав микробиоты кишечника индивидуально- персонализированной диеты, подобранной по генетическому профилю.
Но в итоге авторы получили совсем другую информацию: оказалось, что на состав микробиоты генетика человека влияет весьма незначительно – всего лишь на 2%. А основную роль играют внешние факторы, и прежде всего питание («Мы – то, что мы едим»).
Кроме того, у пациентов измеряли биохимические показатели, уровень артериального давления, индекс массы тела. Так вот: связь всех этих клинических показателей с геномом микробиоты оказалась даже прочнее, чем связь с собственными генами. Эти уникальные данные, безусловно, должны изменить наш подход ко многим заболеваниям.
Итак, начало жизни человека. Считается, что плод стерилен, хотя, возможно, есть некая степень транслокации кишечных бактерий из организма матери в организм плода. Таким образом, основа микробиоты закладывается еще до родов. Становится очевидной необходимость «содержать в порядке» микробиоту беременной женщины.
Научно доказано, что, если ребенок рождается с помощью Кесарева сечения, это повышает риск ожирения на 46%! Всего лишь Кесарево сечение, вне зависимости от дальнейшего образа жизни! В дальнейшем очень важно, чтобы ребенок находился на грудном вскармливании, поскольку с молоком матери поступают и продукты для питания «хороших» микроорганизмов, и собственно сами микроорганизмы. Очень интересны результаты шведского исследования, изучающего влияние на микробиоту детей способа родоразрешения и типа кормления (рис. 6).

Было показано, что через 4 месяца у детей, рожденных естественным путем, микробиота практически соответствовала микробиоте матери. Если при этом они находились на искусственном вскармливании, уже появлялись значимые отличия от материнской микробиоты и максимума они достигали у младенцев на искусственном вскармливании, рожденных с помощью Кесарева сечения.
Не менее важным является период раннего детства, когда идет закладка многих функций, тесно связанных с микробиотой, имеющих приоритетное значение в формировании дальнейшего здоровья. Важно помнить, что любое назначение антибактериальных препаратов, особенно в раннем детстве, должно проводиться только по абсолютным показаниям, так как это повлияет на всю дальнейшую жизнь человека.
С возрастом микробиота становится более устойчива, в среднем она формируется к 5 годам и дальше ее состав уже определяет образ жизни и питание человека. В пожилом возрасте разнообразие микроорганизмов снижается – это тоже очень важный факт (рис. 7).

Уменьшение количества видов микроорганизмов так-же наблюдается при различных заболеваниях, в том числе ожирении, сахарном диабете, ревматоидном артрите.
Во многом состав микробиоты зависит от личных пристрастий человека в еде. Считается, что каждый вид бактерий предпочитает какую-то определенную пищу. Когда мы едим салатные листья, растут бактерии, любящие салатные листья, когда мясо – бактерии-«мясоеды». И вот еще любопытный факт: микроорганизмы влияют не только на обменные процессы в организме, но и на центральную нервную систему, возможно, даже определяя наши вкусовые предпочтения (рис. 8).

То есть если мы вырастили микроорганизмы, предпочитающие брокколи, то они, в свою очередь, посылают в наш мозг сигнал, вызывающий желание есть брокколи. Создается некая критическая масса, способная подать эндогенный сигнал к потреблению определенного продукта. Если человек любит фаст-фуд, значит, у него много микроорганизмов, предпочитающих фаст-фуд.
Причем у этой гипотезы, выдвинутой французскими учеными, уже есть довольно весомая доказательная база.
Если посмотреть на эволюционный путь развития, наши «сожители» старше нас на многие триллионы лет. Бактерии прошли огромный эволюционный путь. Сейчас мы уже знаем, что у них есть способы коммуникации, в основном нейроэндокринные вещества, которые микроорганизмы выделяют для общения друг с другом. При достижении некоей критической массы начинают синтезироваться факторы, включающие определенные гены для адаптации к данным условиям существования.
Есть любопытные факты, подтверждающие возможность горизонтального переноса генов от одних бактерий другим, а, возможно, и в человеческий геном. Так, бактерия Bacteroides plebeius, помогающая переваривать гликаны морских водорослей, обнаруживается пока только у жителей Японии. Возможно, что ген гликозидной гидролазы попал в микробиоту японцев путем горизонтального переноса (бактериофагами или плазмидами) с бактерий, живущих на водорослях.
У жителей Азии распространен Lactococcus garvieae, переваривающий сою. Он выделяет соединение эквиол, предотвращающее развитие климактерических симптомов и некоторых типов опухолей благодаря взаимодействию с рецепторами эстрогенов. Этим, возможно, объясняется канцеропротективное действие сои. Считается, что у жителей Азии соевые продукты обладают большей эффективностью в плане коррекции некоторых метаболических и климактерических расстройств, нежели у жителей других регионов. То есть соя полезна, но не всем, потому что некоторые ее метаболизируют (посредством бактерий), а некоторые – нет.
На этих же данных основана гипотеза, что растительная пища лучше всего усваивается в тех регионах, где живут вегетарианцы, то есть у них есть микроорганизмы, метаболизирующие вегетарианскую пищу. Раньше считалось, что незаменимые аминокислоты мы получаем только с пищей, но оказалось, что бактерии могут перерабатывать углеводы и другие соединения с выработкой незаменимых аминокислот.
Таким образом, биологическое равновесие между человеком и его микробиотой, сложившееся в результате эволюции, может служить важным индикатором состояния макроорганизма, реагируя на различные патологические процессы в нем самом и на любые изменения в окружающей среде.
Что способствует постоянству состава кишечной микрофлоры:
• Нормальная перистальтика
Обеспечивается благодаря сокращениям толстой кишки каждые 90–120 минут в межпищеварительный период и продвижением содержимого из тонкой кишки в толстую.
Не только микробиоте, но и нам тоже нужна клетчатка, чтобы нормализовать транзит по кишке различных веществ, которые питают микробиоту. А как нормализовать перистальтику – тема отдельной большой статьи.
• Герметичность эпителиального слоя
Эпителиоциты в кишечнике стоят, как строй солдат, плечом к плечу. Плотные контакты соединяют отдельные эпителиоциты так, что муха не пролетит, предотвращая проникновение мельчайших молекул из просвета кишки во внутреннюю среду организма.
• Иммунитет слизистой оболочки
Базируется на выработке во всех секретах и тканях ЖКТ плазматическими клетками иммуноглобулинов разных классов в соотношении IgA, IgM, IgG как 20:3:1. Если помните, когда-то в институтах мы проходили один из элементов кишки – Пейеровы бляшки. Так вот, это – «цветочки» по сравнению с тем, какой глобальный иммунный аппарат имеется у кишечника! По сути сам кишечник оказывается важнейшим иммунным органом. Во многом эта иммунная сила кишки влияет на состав микробиоты, а состав микробиоты, в свою очередь, на иммунную силу.
• Секреция соляной кислоты в желудке
Основополагающий защитный фактор против колонизации патогенными микробами верхних отделов ЖКТ, поскольку низкое значение рН неприемлемо для большинства микроорганизмов. Если кислоты в желудке нет – это уже патологическая физиология, и от этого во многом будет зависеть рост микробиоты.
«Этажи» или уровни обитания микробиоты: Первый этаж, базисный, – это мукозная флора. В момент человеческого рождения происходит массивный вход микроорганизмов внутрь: они заселяются под слизистой оболочкой, внутри слизистой оболочки и под слоем слизи. Мукозная микрофлора потом формирует 2-й «этаж».
Пристеночная микрофлора – находится тоже на слизистой оболочке, но уже над слизью или в толще кишечной слизи. Этих бактерий куда больше, чем мукозных, но все-таки самый населенный «этаж» – 3-й – просветная флора.
Просветная флора очень мобильна и в буквальном смысле зависит от того, что мы сегодня съели. Изучение просветной флоры, которым мы занимаемся, сдавая анализы на «дисбактериоз», во многом искажает представление о том, какие микроорганизмы реально «правят балом» и руководят работой всей кишки.
Какие же микроорганизмы на протяжении десятилетий находили в анализах? Мы знаем немало рыб и живых существ, обитающих в океане. Написаны толстые книги, изданы атласы о всевозможных видах даже мелких рыбешек и т. д. И только сейчас, с развитием новой техники, новых возможностей, становится понятно, что в глубине, там, куда раньше невозможно было погрузиться, живут совершенно другие существа, другие рыбы, другие бактерии и т. д. То же в отношении микробиоты. Сегодня стало известно, что в кишечнике живут микроорганизмы, о которых раньше никто и не догадывался, а они между тем имеют доминирующее значение в работе и функционировании микробиоты.
Это связано с тем, что одни микроорганизмы хорошо растут на доступных нам средах, другие практически не растут и для их выявления нужны совершенно иные методы.
По количественному признаку принято делить микроорганизмы на облигатные, составляющие до 90% всех бактерий, факультативные – менее 10% и транзиторные – менее 1%.
Несколько слов о наших «старых знакомых» (рис. 9).

Бифидобактерии действительно много лет считались основной микрофлорой кишечника.
Именно этим микроорганизмам обычно «присваивали» функции огромного количества неизвестных ранее бактерий.
Лактобациллы. Лакто они не потому, что ждут йогурта в кишечнике, а потому, что вырабатывают молочную кислоту, которая, закисляя среду кишки, подавляет рост целого ряда патогенов.
Бактероиды во многом обеспечивают толерантность к пищевым антигенам, регулируют липидный обмен.
Энтерококк имеет огромное значение в формировании гуморального иммунитета кишечника. И еще один интереснейший из облигатных микробов – пептострептококк. Он участвует в распаде и метаболизме тех немногих белковых продуктов, которые попадают в толстую кишку.
• Трофические и энергетические – терморегуляция
• Регулирование перистальтики кишечника
• Детоксикация и выведение экзо- и эндогенных метаболитов
• Образование сигнальных молекул, в частности, нейротрансмиттеров
• Стимуляция местного иммунитета, образование Ig
• Обеспечение цитопротекции и колонизационной резистентности
• Повышение резистентности эпителия к мутагенам
• Ингибирование роста патогенов
• Ингибирование адгезии патогенов и канцерогенов к эпителию
• «Перехват» вирусов
• Физико- химический гомеостаз преэпителиальной зоны
• Поставка субстратов глюкогенеза и липогенеза
• Синтез и поставка организму витаминов группы В, пантотеновой кислоты, витамина К и т. д.
Что для кишечных бактерий будет настоящим «эклером»? Сахар до толстой кишки не доходит, он всасывается выше. А вот клетчатка доходит, именно ее микроорганизмы и «стригут» до элементарных углеводных субъединиц, мономеров. И «стригут» по-разному. Бифидобактерии, например, используют гетероферментативное молочное брожение, лактобациллы – гомоферментативное и спиртовое, эшерихии и пептококки – пропионовое и маслянокислое. В конечном итоге синтезируется целый ряд очень важных веществ: уксусная кислота, лактат, этанол, пропионовая кислота и, наконец, масляная кислота. И вот что интересно: микроорганизмы фактически являются хозяевами толстой кишки, а конечные продукты их жизнедеятельности оказываются незаменимыми для нашего метаболизма. В частности, уксусная кислота является мощнейшим энергетическим субстратом для почек, мышц, в том числе сердечной. Пропионовая кислота – так называемый эндогенный статин. В частности, она уменьшает синтез холестерина и липидных фракций в печени. Этанол – универсальное «топливо». Невероятная роль у масляной кислоты (рис. 10).

Она – важнейший энергетический субстрат для самих колоноцитов. Энергоснабжение колоноцитов почти на 70% удовлетворяется короткоцепочечными жирными кислотами (главным образом бутиратом) и лишь на 30% – циркулирующей в крови глюкозой.
Однако на этом ее функции не исчерпываются – она участвует в регуляции многих других метаболических и сигнальных процессов в кишечнике. Это и антиоксидант, и противоопухолевый субстрат, и даже регулятор центра насыщения в продолговатом мозге.
И вновь мы убеждаемся в том, какая важная роль отведена микробиоте в нашей жизни. Хочу привести примеры еще нескольких исследований. Для эксперимента у части мышей стерилизовали толстую кишку, после чего нанесли ирританты – внутрь кожи вводили формальдегид. Удивительно, но у тех мышей, у которых микробиота была, развивалась эритема, но потом все проходило, а у мышей со стерильной кишкой наступал некроз. То есть иммунный ответ на подкожно введенный раздражитель у мышей с нормальной микробиотой наступал, а у стерильных мышей отсутствовал.
Еще один фантастический эксперимент. Исследовали две группы мышей: первая находилась на сбалансированном питании, вторую кормили гамбургами и чизбургерами. Мыши, питающиеся фаст-фудом, толстели. Дальше в ходе эксперимента брали мышей со стерильной кишкой и одной половине из них пересаживали микробиоту мышей на сбалансированном питании, другой – микробиоту растолстевших на фаст-фуде. И тех, и других продолжали кормить сбалансированно. Но если с первыми все было в полном порядке, вторые – начинали толстеть. Так выяснилось, что микробиота имеет непосредственное отношение к становлению синдрома инсулинорезистентности, глобальным метаболическим нарушениям, которые возникают в организме.
Еще одна интересная идея была представлена в 2010 году. Исследовали микробиоту афирканских и европейских детей. У африканских малышей, которые до 2 лет находились на грудном вскармливании и получали большое количество растительных волокон, бульшая часть микробиоты оказалась представлена бактероидами. И у этих детей не наблюдалась диатезов, диабета, воспалительных заболеваний кишечника. У европейских детей (грудное вскармливание – до года, много животных белков, мало растительных волокон и углеводов) в общей массе микроорганизмов бактероиды занимали очень скромный объем (рис. 11).

Следующее исследование изучало влияние на ребенка материнской микробиоты. Эксперимент продолжался с 2002 по 2012 год и в нем принимали участие беременные женщины.
В одной группе питались обычной едой, а в другой добавляли к обычной еде пробиотик. В результате у детей, родившихся во второй группе, оказалось на 45% меньше иммуноглобулин-Е-ассоциированной патологии. То есть бронхиальная астма, атопические дерматиты и целый ряд других заболеваний, которые сейчас так распространены в педиатрии, отсутствовали благодаря материнской микробиоте. Во многом такой эффект определяется работой клеток особого типа – дендритных (рис. 12).

Это группа антиген-презентирующих клеток костно-мозгового происхождения. На их поверхности представлен широкий набор рецепторов, способных распознавать и связывать как экзогенные, так и эндогенные антигены (основная функция дендритных клеток – «представление» антигенов Т-клеткам). Так вот, оказалось, что огромное количество дендритных клеток находится в кишечнике и в бронхах, то есть там, где есть контакт с внешней средой и присутствуют микроорганизмы. Также выяснилось, что дендритные клетки напрямую связаны с микробиотой кишки, от «качества» которой будет зависеть активность Т-клеток и особенности иммунных и аутоиммунных реакций в организме.
Сейчас такие факты, как много лактобацилл, мало бифидобактерий, не имеют того клинического значения, которое им придавали раньше.
Важно оценивать не только микробиоту толстой кишки, но и тонкой, где может развиться не только дисбаланс, но и перерост бактерий.
Как же сейчас оценивают микробиоту? Есть несколько методов:
• молекулярно-генетическое исследование;
• газожидкостная хроматография (по обнаружению летучих жирных кислот);
• хромато-масс-спектрометрия (по определению длинноцепочечных клеточных жирных кислот);
• скрининговый экспресс- метод (по протеолитической активности супернатантов фекалий и спектру протеаз);
• иммунологические исследования.
Но, к сожалению, в реальной практике все эти достижения научно- технической мысли часто заменяют бактериологический анализ кала, хотя именно он приводил к огромному количеству искажений в понимании кишечной микробиоты и не давал ответа на вопрос, какие микроорганизмы «правят балом» и влияют на наше здоровье. Очевидно, что этот метод давно себя изжил.
Влияние микробиоты отнюдь не ограничивается желудочно- кишечным трактом, а затрагивает практически все органы и системы (рис. 13).

Мы уже довольно много знаем о связи кишечных бактерий с аутоиммунными и аллергическими заболеваниями, ожирением, сахарным диабетом, артериальной гипертензией и даже… с аутизмом, болезнью Паркинсона и прочими нейродегенеративными заболеваниями. Все новые и новые факты потрясают умы ученых, и сегодня во всем мире проводятся крупномасштабные исследования, изучающие эти удивительные связи.
Микробиота и атеросклероз
Есть несколько факторов, обусловливающих развитие атеросклероза и непосредственно связанных с кишечными бактериями.
1. Во-первых, микробиота участвует в активации системного воспалительного ответа.
Микробный липополисахарид проникает через кишечную стенку и вызывает системное воспаление – ведущий патогенетический механизм атеросклероза.
2. Синтез некоторыми микроорганизмами проатрогенных метаболитов. Они переваривают мясные продукты с образованием особого вещества – ТМАО, обладающего проатерогенными свойствами (рис. 14).

То есть при определенных нарушениях микробиоты красное мясо негативно влияет на развитие атеросклероза. А если этих микробов нет, можно безнаказанно, в плане развития атеросклероза, употреблять мясные продукты. И это уже доказанный факт.
Есть и другие, не менее интересные механизмы:
3. участие в биотрансформации и энтерогепатической циркуляции холестерина и желчных кислот;
4. некоторые бифидо- и лактобактерии уменьшают всасывание холестерина, переводя его в нерастворимый копростанол;
5. влияние на различные звенья липидного обмена посредством синтеза сигнальных молекул (КЖК).
Микробиота и артериальная гипертензия
Выделены рецепторы, Olfactory78, на которые воздействуют метаболиты микроорганизмов (лактат), вызывая повышение артериального давления. (Изначально эти рецепторы были обнаружены в носу, а потом выяснилось, что они распространены по всему организму) (рис. 15).

Микробиота и ожирение
Наверное, наибольшее количество работ ведется именно в этом направлении. Тот факт, что на ожирение можно повлиять через кишечные микроорганизмы, привел к революционным изменениям в понимании патогенеза заболевания. После удивительных результатов, полученных на мышах, возникла естественная необходимость продолжить исследования уже на человеке. Стерильным мышам пересаживали кал от детей- близнецов, один из которых страдал ожирением, а второй был с нормальным индексом массы тела. Полученный результат был тем же: у мышей, которым пересадили микробиоту от тучного ребенка, развивалось ожирение. После эксперимента начались многочисленные клинические исследования по трансплантации кала от людей с нормальной массой тела пациентам с ожирением. Эффективность такой терапии оказалась намного выше, чем всех известных до того методов, а результат был столь продолжительный, что стало понятно: удалось не просто избавиться от лишнего жира, а в корне изменить метаболизм!
Естественно, возникает вопрос, как может микробиота повлиять на ассоциированные с ожирением заболевания?
Микробиота и сахарный диабет
Есть очень любопытные данные, что у пациентов с диабетом микроорганизмы способны напрямую влиять на углеводный обмен.
Интересные данные были получены в работе Brugman, где показано положительное влияние антибиотиков на гликемический профиль крыс с предрасположенностью к сахарному диабету.
У крыс без диабета также обнаружено достоверно более низкое содержание Bacteroidetes.
Предположили, что прием кишечных антисептиков приводит к снижению активности системного воспаления в ответ на уменьшение антигенной стимуляции, которое может способствовать деструкции бета-клеток поджелудочной железы.
Кишечник и мозг
Оказалось, что микробиота способна синтезировать определенные вещества, влияющие на работу нашей нервной системы. Основная гипотеза микробиологов – общение микроорганизмов друг с другом. Данные метаболиты необходимы им для передачи информации. За миллиарды лет эволюции бактерии научились коммуницировать друг с другом посредством выработки сигнальных молекул.
А мы «подслушиваем их разговоры», когда эти молекулы попадают в кровоток и доносятся до ЦНС. Оказывается, микробиотой могут вырабатываться даже такие нейромедиаторы, как ГАМК и серотонин. Получается, бактерии могут влиять даже на наше настроение. Кроме того, ведутся исследования по влиянию микробиоты на интеллект человека.
Микробиота и аутоиммунные заболевания
Микроорганизмы способны к объединению ДНК с нашей собственной, что потенциально ведет к генетическим мутациям, связанным с аутоиммунными болезнями. Вероятно, в этом случае иммунная система синтезирует антитела к фрагментам ДНК, которые сформировались в процессе фагоцитоза или апоптоза инфицированных клеток. Было показано, что коррекция избыточного бактериального роста в кишке приводит к уменьшению выраженности аутоиммунных процессов.
Возможно, всплеск аутоиммунных заболеваний, который мы наблюдаем сегодня, связан именно с нарушением микробиоты, с нерациональным использованием антибактериальных препаратов и питанием, с редким грудным вскармливанием и нарушениями процесса естественных родов – то есть со всеми теми факторами, что приводят к изменению спектра и снижению разнообразия кишечных микроорганизмов. Ревматоидный артрит, болезнь Крона, язвенный колит – сегодня уже доказана прямая связь этих заболеваний с нарушением кишечной микробиоты.
Аллергические заболевания
Некоторые кишечные бактерии помогают созревать иммунным клеткам, поддерживающим иммунную систему в состоянии «тревоги» при столкновении с аллергенами. При нарушениях микробиоты, особенно в раннем детстве, иммунная система остается несформированной.
Старение и микробиота
Сейчас ученые владеют очень интересными данными в отношении влияния состава микробиоты на продолжительность жизни и развитие онкологических заболеваний.
Оказывается, микроорганизмы могут блокировать механизм репарации ДНК, что, возможно, приводит к раннему старению или раку.
И тут уместно еще раз вспомнить Илью Ильича Мечникова, который впервые предложил гипотезу о влиянии кишечных бактерий на процессы патологического старения. Правда, он предлагал «лечить старость» резекцией толстой кишки.
Конечно, никто и не думает прибегать к столь радикальным методам, но необходимость поддержания нормального состава и, что еще важнее, разнообразия микробиоты у пожилых людей не вызывает сомнения, и сейчас это одно из перспективных направлений в гериатрии.
Если говорить о стратегии работы с нарушенной микробиотой, сегодня мы наблюдаем глобальный сдвиг всех представлений.
Надо сначала разобраться с той болезнью, которая могла привести к нарушению кишечной микробиоты. Далее создаем условия для жизни нашей собственной микробиоты (здесь как раз будут уместны пребиотики). Если выявлены патогены, с ними надо расправляться, в том числе путем рациональной антибактериальной терапии и использованием кишечных антисептиков и бактериофагов. И только в последнюю очередь мы будем думать о том, а не использовать ли пробиотик как таковой. Почему? Потому что большинство пробиотиков являются транзиторной микрофлорой. Те микробы, которые мы даем в препаратах, – капля в море от того, что на самом деле населяет наш кишечник, и они, как правило, не приживаются (рис. 16).

Однако все эти способы воздействия на микробиоту, в общем-то, дают немного. Было показано, что после приема пробиотика через несколько часов возникал всплеск ферментативной активности того микроба, который находился в препарате, но еще через несколько часов активность снижалась, микроб элиминировался из кишки. В конечном итоге все это привело к поиску совершенно новых способов воздействия на микробиоту.
К сожалению, пока мы еще находится в самом начале пути. И все же есть некоторые перспективные тенденции. В первую очередь – трансплантация кишечной микробиоты (FMT).
У метода уже огромная доказательная база, постоянно пополняющаяся новыми революционными фактами. Есть заболевания, где трансплантация кишечной микробиоты признана методом выбора – например, при псевдомембранозном колите. Первое исследование в этой области закончилось досрочно по этическим соображениям. И этические соображения выражались не в сути метода, не в отказе пациентов от лечения, а в том, что эффективность трансплантации оказалась выше 90% (!), тогда как стандартная антибиотикотерапия дает всего лишь 30%. Это привело к досрочному прекращению исследования и переводу всех пациентов на новый метод лечения. С тех пор количество клинических исследований, касающихся FMT, растет в геометрической прогрессии, а показания к трансплантации фекалий все расширяются и уже включают не только заболевания кишечника, но и ожирение, сахарный диабет и даже аутизм.
Как это происходит? На самом деле, метод очень простой: главное – найти хорошего, здорового во всех отношениях, донора. Забирается кал, гомогенизируется и вводится реципиенту.
Изначально существовало два способа введения трансплантата – в тощую кишку при эзофагогастродуоденоскопии и в толстую кишку посредством колоноскопа. Оказалось, первый «верхний» способ обладает намного большей эффективностью. Почему? Это пока остается загадкой. Кроме того, уже выпускают пероральные капсулы с «трансплантатом».
Сегодня по всему миру проводится большое количество клинических исследований, изучающих эффективность фекальной трансплантации при целом спектре заболеваний (рис. 17).
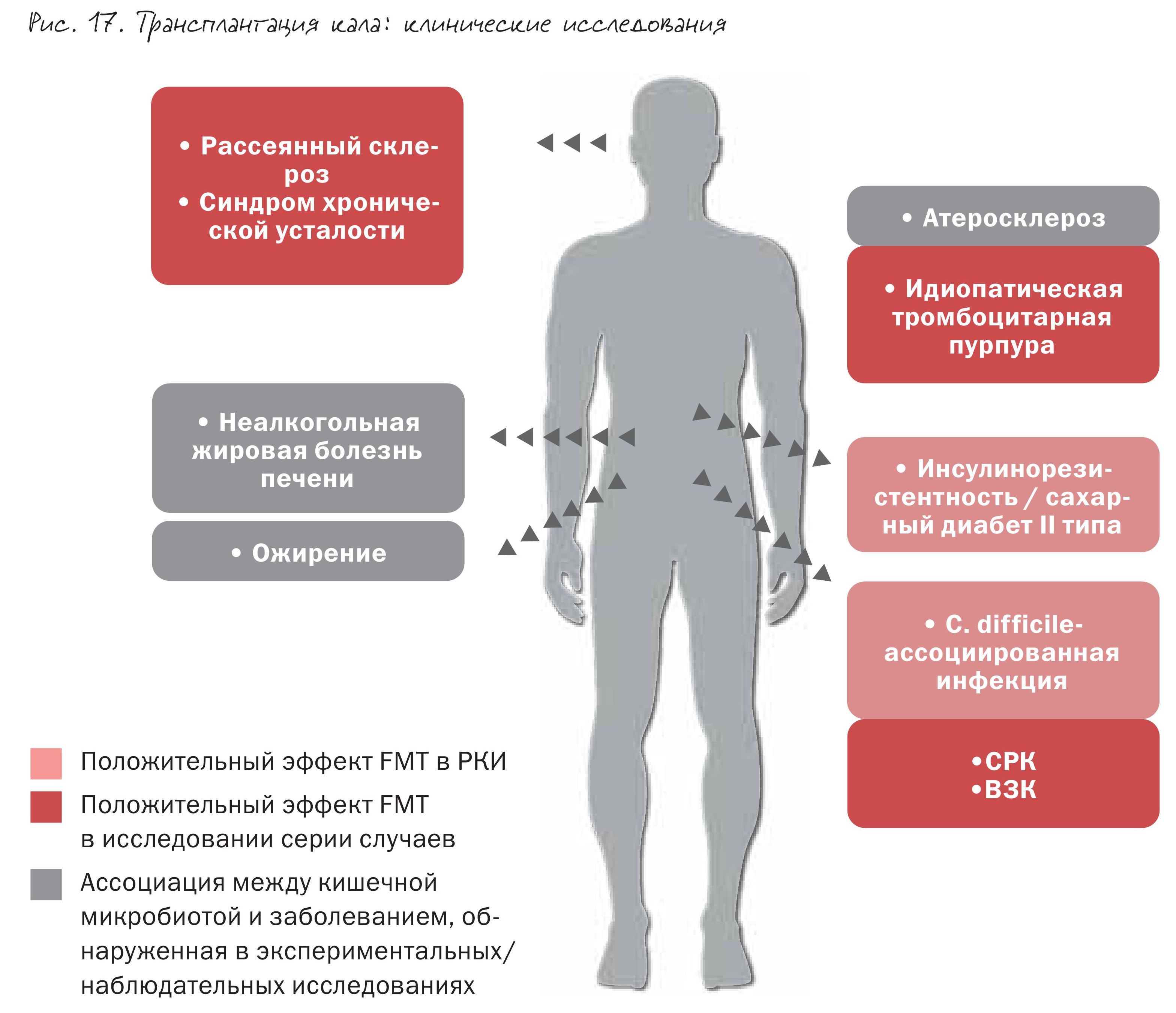
Болезни печени и инсулинорезистентность, заболевания кишечника и головного мозга, атеросклероз и артериальная гипертензия – при всех этих болезнях получены данные о той или иной степени эффективности метода.
Второе перспективное направление в коррекции микробиоты, которое также активно изучается, – подбор персонализированных диет на основании генотипирования кишечной микробиоты. По сути это «вскармливание» определенных, необходимых данному конкретному человеку штаммов бактерий. Но для эффективного внедрения данного метода необходима огромная база данных, которая в силу высокой стоимости генетических исследований пока еще не сформирована. Но и на данном этапе каждый их нас уже может помочь своей микробиоте хотя бы бережным отношением к ней, соблюдением принципов рациональной медикаментозной терапии и разумным подходом к питанию.
14.09.2020 | 22:38:23