Болезнь Лайма - клещевой боррелиоз, Лайм-боррелиоз.
Раздел: Статьи
/
Общая врачебная практика.
/
Инфекционные болезни.
/
Болезнь Лайма - клещевой боррелиоз, Лайм-боррелиоз.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
ИКСОДОВЫЙ КЛЕЩ - ГДЕ И КОГДА
КЛИНИЧЕСКАЯ КАРТИНА БОЛЕЗНИ ЛАЙМА
ДИАГНОСТИКА БОЛЕЗНИ ЛАЙМА
ОТ ДИАГНОСТИКИ К ЛЕЧЕНИЮ ЛАЙМ-БОРРЕЛИОЗА
Болезнь Лайма (клещевой боррелиоз, Лайм-боррелиоз) - инфекционное заболевание, переносимое иксодовыми клещами, а также оленьими кровососками, с преимущественным поражением кожи, нервной и сердечно-сосудистой системы, опорно-двигательного аппарата, склонное к длительному течению. Возбудитель заболевания – Borrelia burgdorferi sensu lato (далее – B. burgdorferi s.l.) – грамотрицательная бактерия из группы спирохет.

Комплекс B. burgdorferi s.l. на самом деле представлен генетически неоднородной группой микроорганизмов – геномовидами, среди которых наиболее распространенными и клинически значимыми являются B. garinii, B. burgdorferi sensu stricto и B. afzelii (циркуляция всех трех геномовидов зафиксирована на территории стран СНГ). Считается, что каждый геномовид боррелий тропен к определенным органам и системам на поздней стадии заболевания (например, B. burgdorferi sensu stricto преимущественно вызывает поздний Лайм‑артрит, B. garinii – нейроборрелиоз, B. afzaelii – хронический атрофический акродерматит), хотя данная ассоциация и не является абсолютной.
Инфицирование человека болезнью Лайма возможно только при присасывании зараженных возбудителем иксодовых клещей.
Иксодовый клещ в своем развитии проходит ряд стадий (яйцо – личинка – нимфа – взрослая особь), каждая стадия занимает в среднем 1 год. Опасными в плане заражения для человека являются нимфы и взрослые особи. Так как нимфы клещей характеризуются малыми размерами даже по сравнению со взрослой особью, пациенты часто не замечают их присасывание.
Подтверждено, что до 50–60% пациентов, заболевших БЛ, в принципе не указывают на присасывание клещей. Поэтому врачу, который подозревает БЛ, важно выявить косвенные эпидемиологические предпосылки: работу пациента на приусадебных участках, посещение лесов и лесопарков, в том числе в городской черте, частое пребывание на природе в регионах с высокой распространенностью БЛ, профессиональную деятельность на открытом воздухе и т. д. Следовательно, наличия факта пребывания пациента там, где можно встретить иксодовых клещей, вполне достаточно, чтобы думать о возможности данного заболевания.
Длительность присасывания иксодовых клещей коррелирует с вероятностью инфицирования человека боррелиями. По данным европейских исследований, показана возможность передачи клещом возбудителя в течение первых 5–6 ч от момента присасывания.
Несмотря на то что максимальная активность иксодовых клещей приходится на период с ранней весны до середины осени, заболевание протекает стадийно, и пациентов со II–III стадией БЛ можно встретить на приеме в течение всего года.
Инкубационный период болезни Лайма составляет от 3 до 30 дней. Появление пятна в месте присасывания клеща в 1–2‑е сутки связано с неспецифической кожной реакцией на компоненты его слюны и не должно расцениваться как мигрирующая эритема.
Для клинического течения БЛ характерно последовательное развитие трех стадий:
• ранней локализованной;
• ранней диссеминированной;
• и поздней.
Протекают они, как правило, последовательно, реже отдельные проявления последующей стадии накладываются на сохраняющиеся проявления предыдущей (например, возможно сохранение мигрирующей эритемы в месте инокуляции возбудителя и появление на этом фоне признаков диссеминированной инфекции с артралгиями, преходящими аритмиями, менингорадикулоневритом и т. д.).
Первая (ранняя локализованная) стадия болезни Лайма проявляется мигрирующей эритемой, образующейся в месте присасывания клеща, – кольцевидным или сплошным пятном бледно‑розовой или ярко‑красной окраски, постепенно увеличивающимся в диаметре. Пятно обычно не беспокоит пациента какими‑либо субъективными ощущениями, не выступает над уровнем кожи и зачастую обнаруживается пострадавшим либо его родственниками совершенно случайно (примеры мигрирующих эритем).

Вторая (ранняя диссеминированная) стадия клещевого боррелиоза характеризуется поражением одновременно нескольких органов и систем (кожи, опорно‑двигательного аппарата, нервной и сердечно‑сосудистой систем), иногда – появлением субфебрильной лихорадки и симптомов интоксикации.
Обычно развивается в течение от 1 до 6 мес с момента попадания возбудителя в организм, чаще на 2–3‑м месяце заболевания.
На коже в самых разных местах появляются множественные мигрирующие эритемы (от 2–3 до нескольких десятков сплошных или кольцевидных увеличивающихся в диаметре пятен) или боррелиозная лимфоцитома (безболезненный синевато‑красный узелок или бляшка, расположенные на мочке или завитке ушной раковины, в области ареолы молочной железы).
Развиваются артралгии с преимущественным вовлечением крупных суставов (классически коленных, реже – тазобедренных, плечевых, локтевых) без объективных признаков артрита.
Характерны мигрирующий характер болей в суставах и саморазрешение процесса у части пациентов (даже без лечения!). Поражение сердечно‑сосудистой системы встречаются относительно редко (около 5% нелеченых пациентов) и проявляются внезапным развитием экстрасистолии и атриовентрикулярной блокады различной степени выраженности (чаще I–II степени). Иногда встречаются полные атриовентрикулярные блокады, а также миокардиты и даже панкардиты, требующие имплантации электрокардиостимуляторов и являющиеся потенциально жизнеугрожающими.
Ранний нейроборрелиоз характеризуется развитием асептического менингита, радикулопатий, одно‑ или двустороннего неврита лицевого нерва, а также их сочетанием (менингорадикулоневрит, или синдром Банварта).
Ранний нейроборрелиоз вызывает наибольшие трудности в клинической практике по причине стертости клинической симптоматики и большого спектра дифференцируемых состояний со сходной клиникой (за исключением случаев неврита лицевого нерва). B. burgdorferi s.l. является одной из основных инфекционных причин одно‑ или двустороннего неврита лицевого нерва (помимо вирусов простого герпеса и вируса варицелла зостер). Для асептического менингита в раннюю диссеминированную стадию БЛ характерна стертая флюктуирующая менингеальная симптоматика – периодические умеренно выраженная головная боль без лихорадки, тошнота, рвота и практически всегда отсутствующие объективные менингеальные знаки. В 2012 г. ретроспективное когортное исследование в группе детей с боррелиозной этиологией менингита предложило правило «трех семерок»: если длительность головной боли до момента обращения за медицинской помощью менее 7 дней, лимфоцитов в цереброспинальной жидкости менее 70% и нет пареза (паралича) VII либо иного черепного нерва – можно исключить БЛ у 96% пациентов.
Для изолированной боррелиозной радикулопатии характерны сильные жгучие боли в межлопаточной области спины, часто иррадиирующие в верхние и нижние конечности, область груди или живота, более выраженные у лиц пожилого возраста, усиливающиеся в ночное время и плохо отвечающие на стандартную терапию купирования нейропатической боли. Диагноз БЛ в этом случае, безусловно, крайне сложен, если у пациента нет эпидемиологических предпосылок или других проявлений инфекции, так как врач в первую очередь думает о более распространенных причинах радикулопатии.
В связи с вышеперечисленными клиническими особенностями раннего нейроборрелиоза, при возникновении диагностических сомнений пациента следует госпитализировать и предложить выполнить диагностическую люмбальную пункцию. При этом объективные изменения в цереброспинальной жидкости (лимфоцитарный плейоцитоз, повышенный белок) характерны для всех пациентов даже с изолированной радикулопатией или парезом лицевого нерва.
Третья (поздняя) стадия болезни Лайма развивается не ранее 6 мес от момента инфицирования B. burgdorferi s.l. Для нее характерно поражение чего‑то одного: опорно‑двигательного аппарата, нервной системы или кожи.
При вовлечении в процесс опорно‑двигательного аппарата развивается Лайм‑артрит, для начала которого также специфично поражение крупных суставов, чаще коленных.
Приступы могут длиться от нескольких недель до нескольких месяцев с периодами полной ремиссии между ними, а в ряде случаев процесс в течение нескольких лет может саморазрешиться. В то же время у некоторых пациентов явления Лайм‑артрита сохраняются годами даже после адекватной этиотропной терапии (антибиотик‑рефрактерный Лайм‑артрит), при этом комплекс лабораторно‑инструментальных методов диагностики не подтверждает сохранение активной инфекции в организме.
Сегодня доказано, что случаи так называемого антибиотик‑рефрактерного Лайм‑артрита обусловлены активизацией аутоиммунитета и ассоциированы с сохранением персистенции антигенов боррелий (а не жизнеспособных микроорганизмов) в структурах суставов, а также генетической предрасположенностью к развитию данного состояния. Основное поражение кожи на поздней стадии БЛ – хронический атрофический акродерматит. После инфицирования состояние развивается годы спустя, при этом на коже дистальных отделов конечностей характерно появление краснофиолетовых пятен с последующим развитием атрофии в виде участков истонченной, морщинистой, легко собирающейся в складки кожи (вид «папиросной бумаги»).
Однако наиболее серьезные с клинических позиций поражения характерны для позднего нейроборрелиоза, протекающего в виде рассеянного энцефаломиелита либо подострой Лайм‑энцефалопатии. Гораздо реже встречаются поражения периферической нервной системы – симметричные и асимметричные нейропатии, васкулит сосудов ЦНС, синдром, имитирующий болезнь моторного нейрона, экстрапирамидные поражения и т. д. Среди доминирующих клинических проявлений рассеянного энцефаломиелита боррелиозной этиологии характерны краниальные нейропатии (чаще VII–VIII черепные нервы), спастические парапарезы, атаксия, нарушения функции тазовых органов, когнитивная дисфункция. У части пациентов при этом выявляются патологические изменения на МРТ головного мозга, в ряде случаев имитирующие картину рассеянного склероза или другого демиелинизирующего поражения ЦНС.
С целью дифференциальной диагностики нужно обследовать на нейроборрелиоз всех пациентов с впервые выявленной демиелинизацией ЦНС, если:
1) есть эпидемиологические предпосылки для БЛ (пациент проживает в эндемичной местности, указывает на многократные присасывания клещей в анамнезе);
2) клиническая и радиологическая картина заболевания не укладывается в классические критерии рассеянного склероза и другие аутоиммунные поражения;
3) демиелинизирующее заболевание ЦНС рефрактерно к традиционно проводимой в этих случаях терапии иммуносупрессантами;
4) несмотря на длительный анамнез заболевания, отсутствует поражение спинного мозга.
У пациентов с поздним нейроборрелиозом всегда имеются положительные серологические реакции, а в цереброспинальной жидкости определяются специфические интратекальные антитела к B. burgdorferi s.l.
Для подострой Лайм‑энцефалопатии характерны постепенно прогрессирующие интеллектуально‑мнестические расстройства, астенизация, раздражительность или депрессия, нарушения поведения при отсутствии объективных неврологических отклонений и изменений на МРТ головного мозга.
Точный механизм развития данного состояния окончательно не ясен. Высказывается ряд гипотез (дисбаланс провоспалительных и антивоспалительных цитокинов, гормональный дисбаланс, нарушение продукции нейромедиаторов и т. д.), а часть авторов считают данное состояние проявлением субклинически протекающей БЛ иной локализации за пределами ЦНС. У всех пациентов с подострой Лайм‑энцефалопатией положительны результаты серологических исследований и имеется клинический ответ на проводимую адекватную антибактериальную терапию.
Клиническая картина БЛ существенно различается в зависимости от стадии инфекции, поэтому врачам различных специальностей, к которым обращаются пациенты с теми или иными проявлениями заболевания, важно предположить наличие БЛ и для уточнения диагноза направить пациента на дообследование и лечение к инфекционисту.
Немало проблем по‑прежнему существует и с лабораторным подтверждением диагноза болезнь Лайма. Практикующему врачу следует помнить, что каждый из доступных сегодня методов лабораторной диагностики обладает определенной чувствительностью и специфичностью, особенностями применения при той или иной стадии БЛ. Не стоит слепо доверять результатам анализов без учета соответствующих эпидемиологических и клинических данных, так как нередки как ложноположительные, так и (гораздо реже) ложноотрицательные результаты. В случае сомнений в правильности интерпретации результатов исследований необходимо обращаться к специалистам в области клинической лабораторной диагностики и врачам‑инфекционистам. К сожалению, среди как медицинских работников, так и пациентов, особенно в сети Интернет, продолжают распространяться мифы о «хронической болезни Лайма», взаимосвязи между количественными показателями используемых серологических методов (титрах, значениях коэффициента позитивности антител и т. д.) и сохраняющейся инфекцией в организме, что приводит к необоснованным повторным и длительным курсам антибактериальной терапии, «уходу пациента в болезнь», серьезным социально-экономическим потерям.
Наиболее значимыми для подтверждения БЛ на II и III стадиях заболевания (I стадия диагностируется только клинически) являются методы серодиагностики (реакция непрямой иммунофлюоресценции – РНИФ, иммуноферментный анализ – ИФА, иммуноблоттинг – ИБ).
Для их адекватного использования и интерпретации результатов важно представлять особенности гуморального иммунного ответа при БЛ. Учитывая, что первые антитела класса IgM появляются лишь через 3 нед с момента инфицирования, а IgG – с 4–6‑й недели, нет смысла обследовать пациента, чтобы подтвердить диагноз при наличии мигрирующей эритемы – высок риск получить ложноотрицательный результат. Кроме того, раннее назначение антибактериальной терапии гипотетически может отсрочить появление первых антител. В случае ранней диссеминированной стадии БЛ (за исключением множественных мигрирующих эритем) практически всегда в сыворотке крови есть антитела класса IgG, а при поражениях ЦНС – дополнительно и специфических интратекальных антител класса IgG в цереброспинальной жидкости.
При позднем боррелиозе в сыворотке крови всегда выявляются IgG‑антитела и интратекальные IgG, если развилось поражение нервной системы.
В качестве серологических реакций скрининга (первичного обследования пациента с предполагаемой БЛ) во всем мире предпочтение отдается ИФА, хотя в ряде стран СНГ до сих пор с этой целью также используют РНИФ.
РНИФ характеризуется высокой чувствительностью, однако менее валидирована по данным крупных клинических исследований по сравнению с ИФА, обладает незначительной специфичностью, связанной с субъективностью интерпретации получаемого результата.
Если на протяжении 30 дней и более при скрининге обнаруживаются только IgM к B. burgorferi s.l. без появления соответствующих IgG, данные нужно расценивать как неспецифический ложноположительный результат. В эти сроки при наличии активной инфекции должны обязательно начать выявляться IgG.
Для подтверждения положительных результатов скрининга применяют ИБ, позволяющий выявлять антитела к отдельным специфическим протеинам клеточной стенки боррелий. Только применение двухступенчатого подхода (ИФА + иммуноблоттинг или появившийся в последние годы альтернативный подход – два ИФА тест‑системами разных производителей) обладает оптимальной на сегодня чувствительностью и специфичностью и рекомендовано как «золотой стандарт» и основной метод диагностики Лайм-боррелиоза в большинстве существующих рекомендаций. Не следует использовать иммуноблоттинг при отрицательных результатах скрининговых методов (РНИФ, ИФА), так как в этом случае велика вероятность получить неспецифичный ложноположительный результат.
Практикующему врачу следует помнить об определенном проценте серопозитивных по антителам к боррелиям лиц в эндемичном регионе, у которых нет клинических проявлений заболевания и которые, соответственно, не нуждаются в назначении этиотропной терапии. По данным ряда авторов, в эндемичных по БЛ регионах антитела к B. burgdorferi s.l. обнаруживались у 5–25% здоровых субъектов. Причинами выявления антител у здоровых лиц может быть низкая специфичность серологических методов вследствие кросс‑реактивности с другими штаммами боррелий (Treponema pallidum – возбудитель сифилиса, Treponema denticola – этиологически значимый агент при пародонтозе), поликлональная гаммапатия, имеющаяся у пациентов с синдромом системного воспалительного ответа, абортивная сероконверсия без развития активной инфекции после контакта с возбудителем, перенесенная ранее и излеченная болезнь Лайма или сифилис и т. д.
ПЦР при клещевом боррелиозе обладает низкой чувствительностью при исследовании большинства клинических образцов и применима только для исследования биоптата кожи (в случае мигрирующей эритемы, когда врач сомневается в диагнозе) и синовиальной жидкости для верификации Лайм‑артрита.
Сегодня в большинстве стран не рекомендуется обследовать снятых с пациента клещей на инфицированность боррелиями.
Во‑первых, в Европе 20–25% клещей могут быть инфицированы B. burgdorferi s.l., однако инфекция развивается только в 1–5% присасываний (1 случай на 20–100 присасываний клеща). Позитивный результат означает инфицированность клеща, но не позволяет прогнозировать вероятность трансмиссии возбудителя человеку.
Во‑вторых, нет убедительных исследований, оценивающих качество методов прямой детекции возбудителей в клеще, их чувствительность, специфичность и воспроизводимость.
В‑третьих, назначение постконтактной профилактики антибиотиком возможно только в ближайшие 72 ч от момента присасывания клеща, при этом результат исследования клеща на боррелии пациенты зачастую получают в сроки, когда проведение профилактики уже неэффективно.
В‑четвертых, и это также подтверждает собственный опыт авторов, нередки случаи заболевания БЛ при отрицательном результате обследования снятого клеща на боррелии. Отрицательный результат исследования создает чувство ложной безопасности, и пациент не получает постконтактную профилактику, не наблюдает за местом присасывания клеща и не обращается к врачу даже при появлении клинических проявлений инфекции.
С целью верификации диагноза и определения показаний для этиотропной терапии БЛ рекомендуется использовать алгоритм, приведенный на рис. 1, а в диагностически затруднительных случаях консультироваться по вопросам лабораторной диагностики с сотрудниками референс‑лабораторий и клиник, занимающихся данной проблемой.


При антибактериальной терапии любого инфекционного заболевания важно понимать критерии адекватности ее проведения, включающие:
1) правильный выбор антибиотика на основании прогнозируемой чувствительности к нему возбудителя при исследовании in vitro. Например, на сегодняшний день резистентность B. burgdorferi s.l. к используемым для терапии антибиотикам отсутствует. Так, проведенное в 2012 г. на европейских штаммах боррелий исследование продемонстрировало 100% чувствительность возбудителя к доксициклину, амоксициллину, цефуроксиму, цефтриаксону и азитромицину. Данные препараты можно использовать в терапии БЛ, однако выбор в пользу того или иного лекарственного средства может отличаться на разных стадиях заболевания;
2) выбор адекватного пути введения лекарственного средства и строго определенных режимов дозирования, эффективность которых подтверждена многочисленными исследованиями и рекомендована соответствующими практическими руководствами. Так, применение парентеральных антибиотиков для лечения БЛ подразумевает только внутривенный путь введения, клиническая и микробиологическая эффективность терапии при внутримышечном введении не изучена в исследованиях и потенциально может приводить к отсутствию клинического эффекта и рецидивам заболевания;
3) соблюдение рекомендуемых сроков длительности антибиотикотерапии, необоснованное сокращение которых может привести к дальнейшему прогрессированию процесса. В то же время увеличение длительности антибактериальной терапии, даже после сохранения каких‑либо резидуальных последствий БЛ (не связаных с сохраняющейся персистенцией возбудителя в организме), не способствует улучшению и в ряде случаев представляет угрозу для здоровья и жизни пациента из‑за риска развития тяжелых побочных эффектов;
4) адекватное качество используемого антибактериального лекарственного средства. Только в случае соблюдения всех четырех перечисленных критериев можно говорить об адекватно проведенной этиотропной терапии БЛ и быть уверенными в благоприятном исходе заболевания.
Наиболее эффективен для лечения ранних стадий болезни Лайма доксициклин. Антибиотики подходят для терапии мигрирующей эритемы у всех пациентов, за исключением детей до 8 лет и беременных женщин. При наличии противопоказаний для назначения доксициклина можно заменить его бета‑лактамными антибиотиками (амоксициллин, цефуроксим аксетил) и лишь при аллергии на них – макролидами (кларитромицин, азитромицин), которые являются в данном случае средством третьей линии и уступают по клинической эффективности доксициклину и бета‑лактамным антибиотикам.
Сегодня в связи с лучшим пониманием фармакокинетических и фармакодинамических предикторов эффективности антибактериальной терапии предпринимаются попытки оптимизировать существующие схемы лечения. Согласно исследованиям, в первые 3 дня терапии суточная доза доксициклина может быть безопасно увеличена в 2 раза уже в начале лечения. Кроме того, традиционно рекомендуемое введение внутривенно всей суточной дозы цефтриаксона (2 г) лучше разбить на два этапа в связи с тем, что бета‑лактамы являются времязависимыми антибиотиками и большая кратность введения увеличивает вероятность достигнуть целевые фармакокинетические‑фармакодинамические предикторы клинической эффективности.
Объединенные рекомендации по этиотропной терапии БЛ приведены в таблице 1.
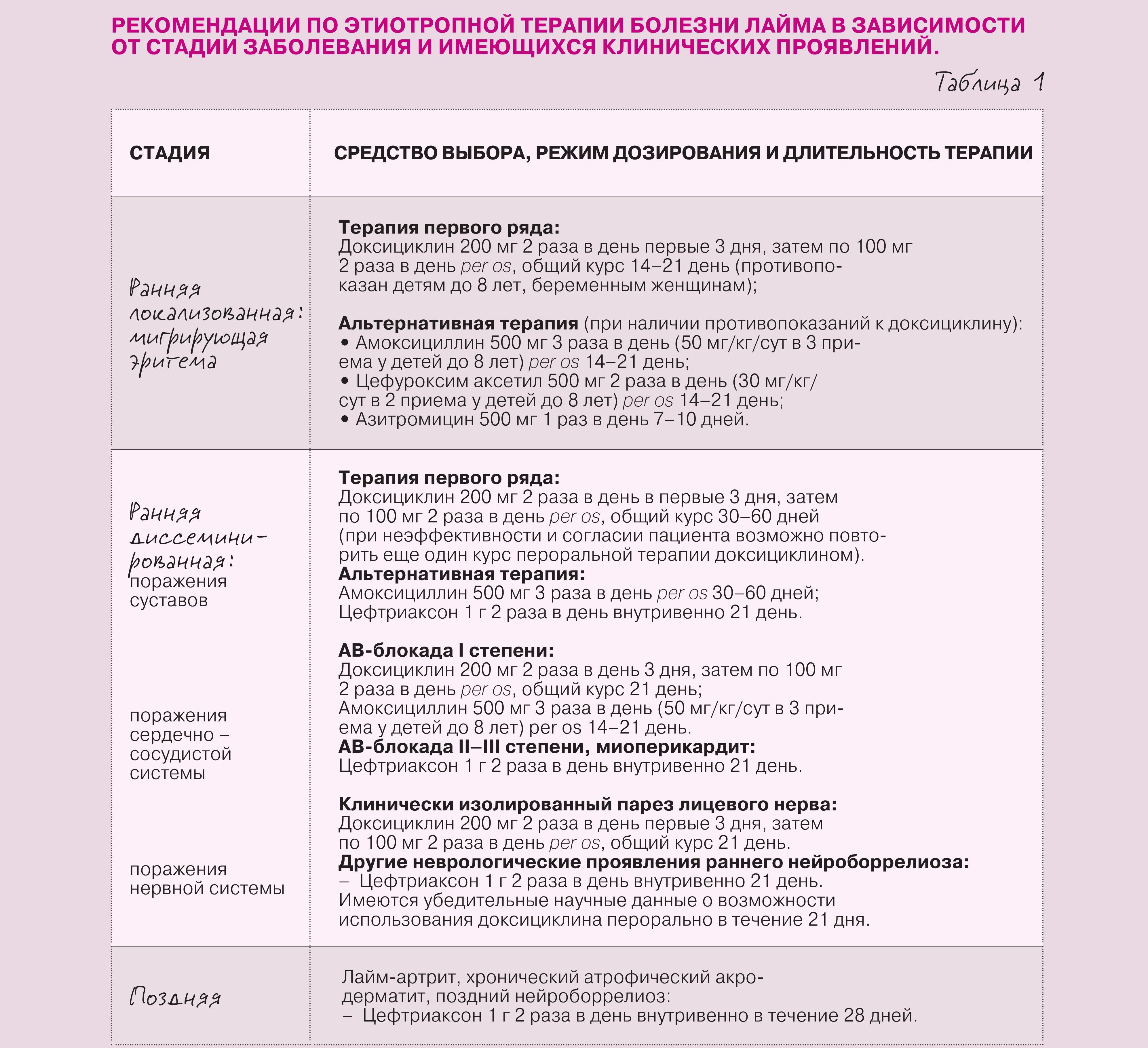
Оценка эффективности проведенной этиотропной терапии БЛ осуществляется только клинически. Не следует назначать лечение по результатам лабораторных обследований пациента (например, при наличии титров антител) после проведенного курса адекватной антибиотикотерапии, равно как инициировать терапию при наличии положительных результатов серодиагностики, но отсутствии каких‑либо проявлений, потенциально связанных с болезнью Лайма.
На сегодняшний день в клинической практике нет адекватных лабораторных маркеров, позволяющих контролировать эффективность проведенной этиотропной терапии.
В литературе есть описания длительного сохранения IgM к В. burgdorferi в течение 20 лет и более после успешной терапии БЛ. В исследовании Glatz и соавт. положительные результаты выявления IgM и IgG методом ИФА и иммуноблоттинга отмечались у 8–44% пациентов даже спустя 1 год после успешной антибактериальной терапии мигрирующей эритемы и полного клинического выздоровления. Поэтому нет необходимости в повторных серологических обследованиях после окончания курса этиотропной терапии БЛ, так как ни наличие антител, ни их количественное определение не коррелируют с эффективностью проведенной антибиотикотерапии, единственным критерием успеха которой является исчезновение клинических признаков заболевания.
Следует помнить, что в случае лечения БЛ на поздней стадии, особенно при длительном сроке болезни, у некоторых пациентов могут сохраняться остаточные проявления поражений опорно‑двигательного аппарата либо нервной системы, и это не показатель клинической неэффективности терапии, а резидуальные последствия перенесенного заболевания. Также могут наблюдаться длительно сохраняющиеся соматические и/или нейрокогнитивные симптомы без объективных клинико‑лабораторных признаков активной инфекции. В этом случае говорят о «постлаймском синдроме», имеющем четкие критерии диагностики. Данное состояние не связано с сохраняющейся персистенцией боррелий в организме и не нуждается в повторных и длительных курсах антибактериальной терапии.
В эндемичных по болезни Лайма регионах рекомендовано использовать постконтактную химиопрофилактику после каждого эпизода присасывания клещей.
Единственным эффективным средством антибиотикопрофилактики БЛ является доксициклин, принимаемый однократно внутрь в дозировке 200 мг в первые 72 ч от момента присасывания клеща. Клиническая эффективность химиопрофилактики БЛ доксициклином достигает 87–95%, уменьшая вероятность развития заболевания, по данным метаанализа, в 11 раз. В то же время профилактический эффект доксициклина изучен только в сроки до первых 3 сут с момента предполагаемого попадания в организм человека боррелий, поэтому промедление с его использованием недопустимо.
В случае, если химиопрофилактика БЛ в ближайшие 72 ч от момента присасывания клеща не проводилась, пациенту необходимо наблюдать в течение 1 мес за местом укуса и при появлении мигрирующей эритемы либо других клинических признаков заболевания своевременно обратиться к специалисту.
25.03.2020 | 22:52:07