Хроническая болезнь почек.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
СТАВИМ ДИАГНОЗ
МЕТОДЫ ОЦЕНКИ ФУНКЦИИ ПОЧЕК
ПРИЗНАКИ ПОВРЕЖДЕНИЯ ПОЧЕК ПРИ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК
ЧТО ДОЛЖЕН ОТРАЖАТЬ ДИАГНОЗ ХБП?
ЛЕЧЕНИЕ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК
ОГРАНИЧЕНИЕ БЕЛКА
ЛЕЧЕНИЕ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ ПРИ НЕФРОПАТИИ
СТРАТЕГИЯ НЕФРОПРОТЕКЦИИ
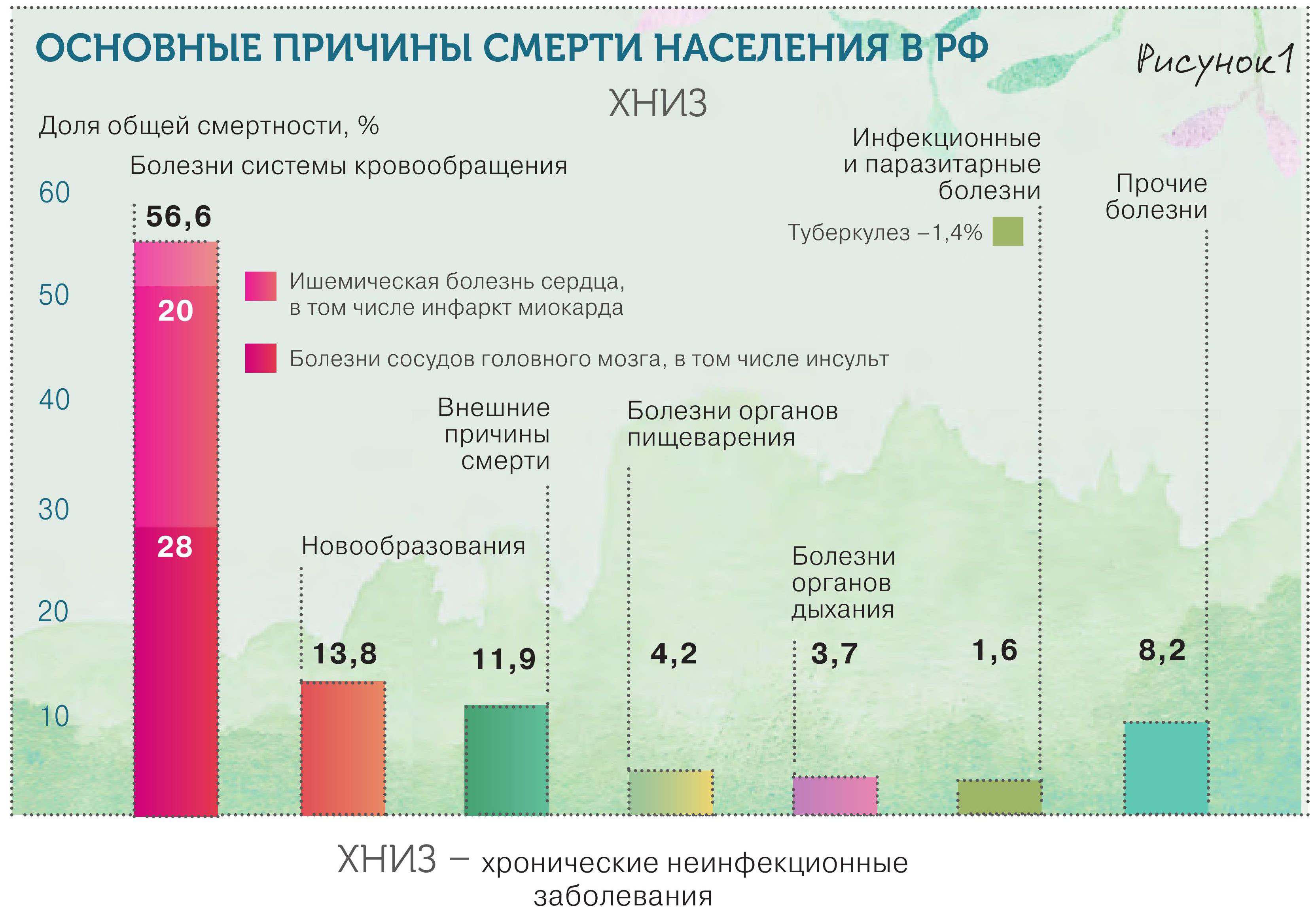
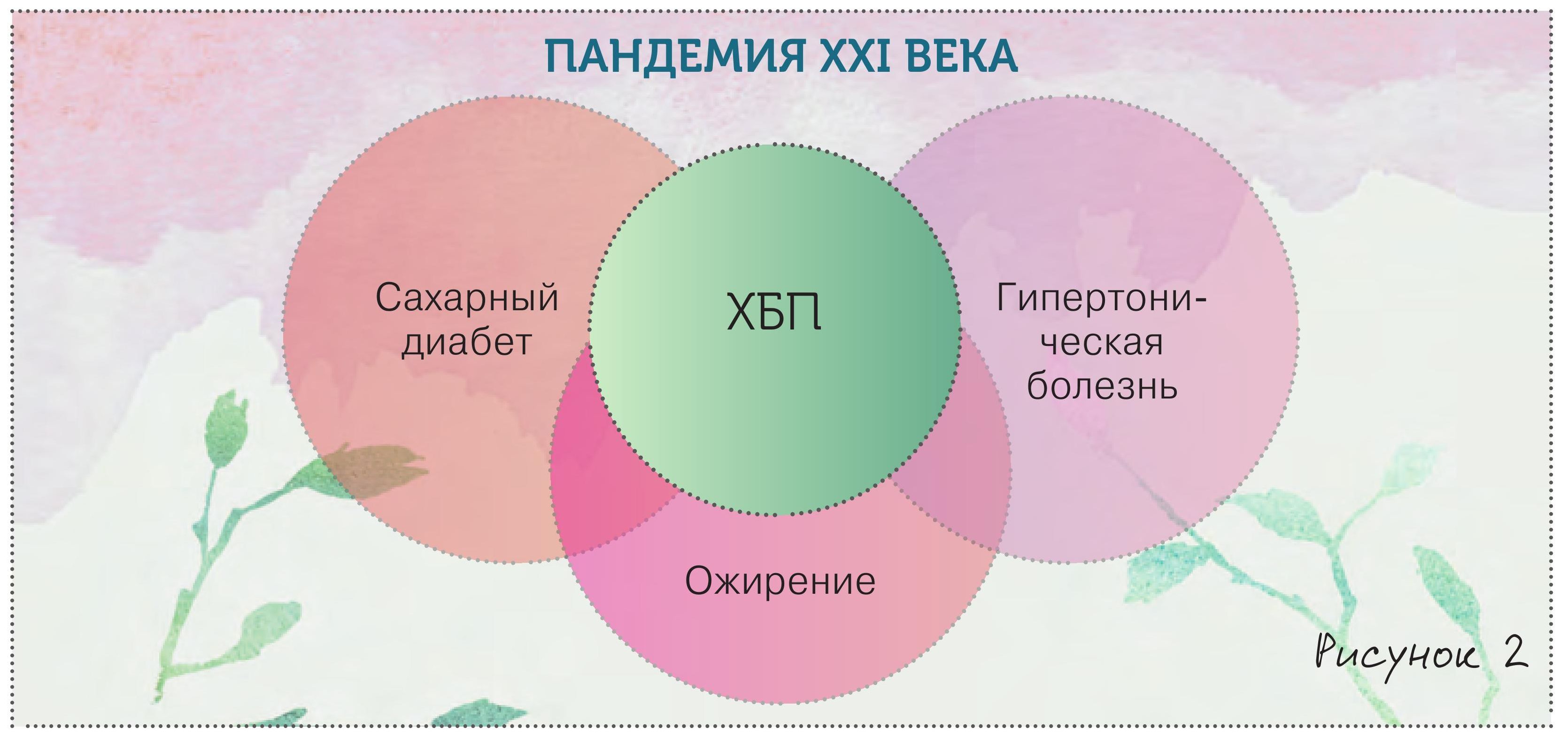
Cамое главное, что должен знать терапевт о хронической болезни почек (ХБП), что она, вопреки официальной статистике и привычным представлениям, распространена очень широко и находится на стыке практически всех ключевых заболеваний человека (рис. 1., 2).

ЭТАПЫ РАЗВИТИЯ НЕФРОЛОГИИ У САМЫХ ИСТОКОВ
До начала ХIХ века представления о роли почек в организме и их болезнях носили запутанный и нередко фантастический характер.
Была диагностика по моче в свете «гуморальной» теории Гиппократа. Однако никто тогда толком не знал, что такое моча, из чего она образуется. Врачи прошлого пробовали ее на вкус, оценивали цвет и запах, но функция почек оставалась тайной. И вот 1827 г. Лондон. Госпиталь Гая, где работают три крупнейших врача эпохи: Томас Ходжкин, Томас Аддисон и Ричард Брайт. Каждый из них внес свой вклад в становление нефрологии, но особый принадлежит все-таки Брайту.
Врач общей практики, терапевт, он нередко принимал участие во вскрытиях. И отметил любопытную вещь – у наблюдаемых им при жизни пациентов с апоплексией (тогда так называли это состояние, понятия «гипертония» не существовало и тонометров не было) – с красным лицом, страдающих носовыми кровотечениями и пульсирующей головной болью, с высоким уровнем мочевины в крови и белком в моче (он уже тогда мог это определить!) после смерти обнаруживалась одна особенность – сморщенные или, наоборот, большие, воспаленные почки. Сопоставив факты, он не только описал клинико-лабораторные признаки нефротического синдрома, уремии, но и установил их связь со структурными признаками поражения почек. Так в медицине появляется понятие Брайтова болезнь, закрепившееся на долгие годы. Спустя сто лет после клинических описаний Р. Брайта Евгений Михаилович Тареев написал книгу, которая так и называлась – «Анемия брайтиков», в которой он описал наблюдаемые при ухудшении функции почек изменения сердечно-сосудистой системы, включая почечную гипертонию.
Поэтому он считается отцом российской нефрологии. Сегодня любой грамотный врач с закрытыми глазами нарисует нефрон.
Первым же, кто его увидел, был Марчелло Мальпиги, без какой-либо сложной оптики разглядевший в корковом веществе почек маленькие шарики, которые потомки будут называть мальпигиевыми тельцами. Капсулу опишет русский врач Александр Шумлянский, а детализирует описание – англичанин Уильям Боумен, поэтому мы до сих пор говорим: капсулы Шумлянского – Боумена.
Систему канальцев изучит немец Фридрих Генле, а Карл Людвиг объединит все знания, доказав что почки – не железы внешней секреции, что в клубочках происходит фильтрация, а в канальцах – обратное всасывание. И выведет таким образом фильтрационно-реабсорбционную теорию работы почек.
60‑Е ГОДЫ
Ознаменованы двумя важными в истории нефрологии событиями:
1) В клиническую практику вошел преднизолон, которым начинают лечить все вплоть до шизофрении. Единственное противопоказание – язвенная болезнь. Он стал первым патогенетически обоснованным и эффективным средством терапии хронического гломерулонефрита, применяют его в нефрологии и до сих пор.
2) Стала доступна заместительная почечная терапия (ЗПТ) – диализ и трансплантация почки.
9 марта 1960 г., когда Белдинг Скрибнер наложил первый артерио-венозный шунт и начал с его помощью лечение гемодиализом пациента с терминальной почечной недостаточностью, продлив ему этим жизнь на 11 лет, считается днем рождения нефрологии. В нашей стране формирование нефрологии как отдельной медицинской специальности проходило благодаря услиям Евгения Михайловича Тареева, создавшего старейшую в нашей стране научную нефрологическую школу, его учеников – Николая Алексеевича Мухина, Ирины Евгеньевны Тареевой, Валентина Михайловича Ермоленко.
Большой вклад в развитие нефрологии как науки и создание Московской и Ленинградской нефрологических служб внесли Мария Яковлевна Ратнер, организовавшая первые нефрологические койки, Наталья Аркадьевна Томилина, Сергей Иванович Рябов.
В Советском Союзе отделения диализа назывались отделениями искусственной почки.
В студенческие годы мы считали, что там лежат «почечные» больные. Но мы ошибались.
Как тогда, так и сейчас основные пациенты на диализе – не те, у кого хронический гломерулонефрит или поликистоз почек, а диабетики и гипертоники. И к нефрологу они попадают уже на стадии, когда надо экстренно начинать диализ, а возможности нефропротекции уже упущены. По данным главного нефролога России Евгения Михайловича Шилова, стоимость нефропротективной терапии, которая назначается до начала диализа и должна предотвратить или отдалить необходимость его проведения, примерно в 100–150 раз дешевле, чем стоимость лечения самим диализом, которая ложится тяжелым бременем на систему здравоохранения. По данным Регистра больных, получающих заместительную почечную терапию, Российского диализного общества, обеспеченность всеми видами ЗПТ в России увеличилась с 55,8 до 301,2 пациента на миллион населения, однако и этот показатель остается в 2–3 раза ниже, чем в странах Восточной Европы. Этот явный сохраняющийся дефицит делает задачу адекватной нефропротекции особенно актуальной для нашей страны.

80–90‑Е
Идет изучение неиммунных механизмов прогрессирования нефропатий и разработка нефропротекции. Выясняется, что при совершено разных заболеваниях механизмы повреждения почек схожи, что является предпосылкой для введения понятия «хроническая болезнь почек».
2000‑Е
2002 г. приносит долгожданную концепцию ХБП. Почему долгожданную, видно из табл. 1.


Различие в выборе критериев и определяемых по ним стадий заболевания наблюдалось во всем мире (как говорится, кто в лес, кто по дрова), что и продиктовало необходимость создать некую единую методологическую базу. Ее основы заложила в 2002 г. американская группа экспертов KDOQI, а через 10 лет существенно доработала и развила международная экспертная группа KDIGO. Клинические рекомендации Научного общества нефрологов России были приняты в 2012 г.
Хроническая болезнь почек (ХБП) – понятие наднозологическое, объединяющее всех людей с наличием:
• признаков повреждения почек (альбуминурия, протеинурия и другие отклонения в анализах мочи, изменения в почках по данным УЗИ и др.);
• снижением функции почек, оцениваемой по скорости клубочковой фильтрации.
Указанные признаки должны сохраняться в течение не менее 3 мес. Стадии ХБП: их нужно знать наизусть, как мы знаем цифры давления, глюкозы, гемоглобина (табл. 2).
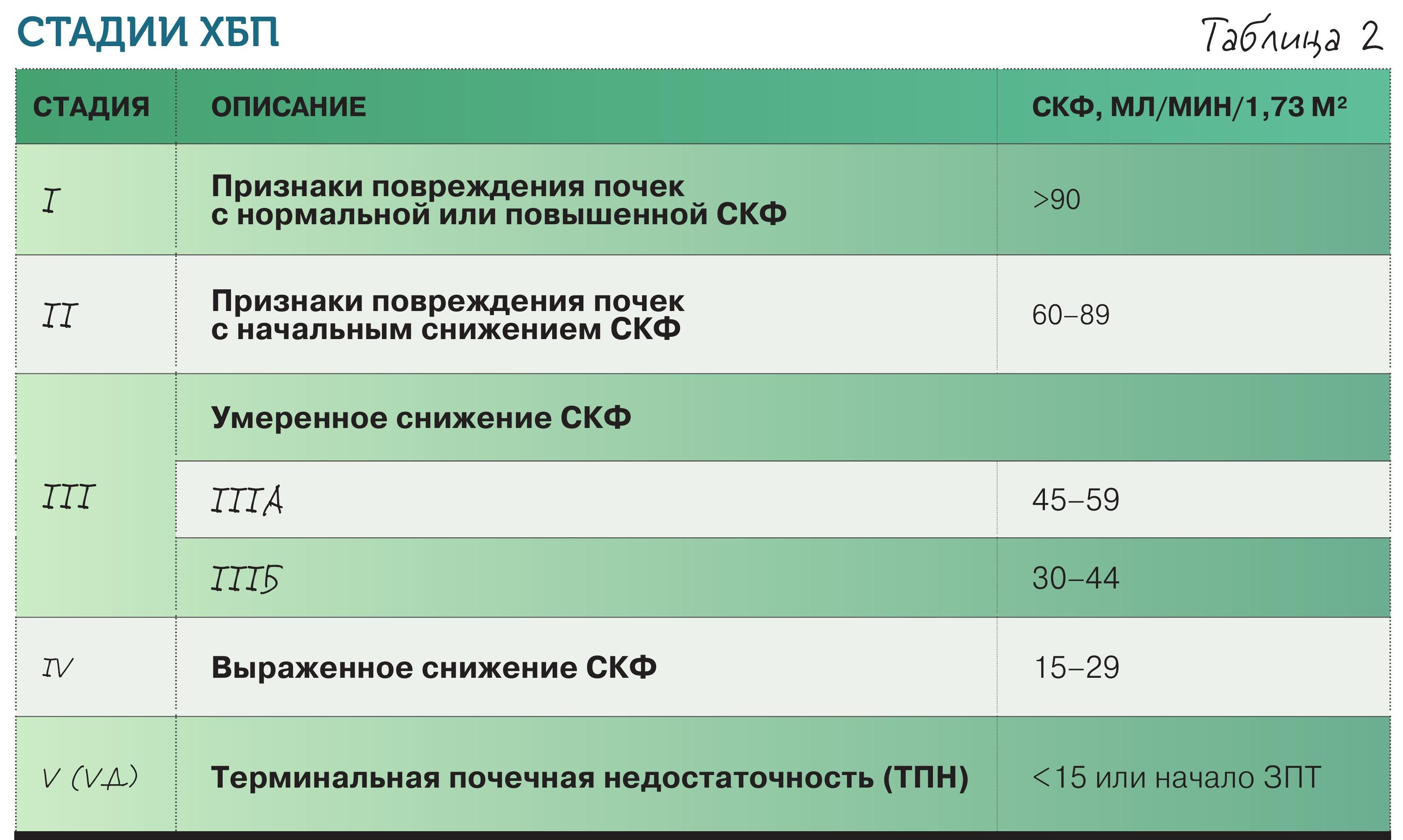
Какова норма скорости клубочковой фильтрации (СКФ)? Оптимально – 90–120 мл/мин/1,73 м2. Но вот очень важный момент: когда есть какие-то признаки повреждения почек – по анализам (например, белок в моче) или данным УЗИ и при этом СКФ выше 90 мл/мин/1,73 м2, ставят первую стадию ХБП – ХБП С1, если СКФ при наличии признаков повреждения почек составляет 60–89 мл/мин/1,73 м2, ставят вторую стадию – ХБП С2. А при СКФ ≥ 60 мл/мин/1,73 м2 без признаков повреждения почек диагноз ХБП не выставляется. При СКФ 30–59 мл/мин/1,73 м2 независимо от наличия маркеров повреждения почек диагностируется третья стадия – ХБП С3. На сегодня ее рекомендуют делить на две подстадии: ХБП С3а при СКФ 45–59 мл/мин/1,73 м2 и ХБП С3б при СКФ 30–44 мл/мин/1,73 м2. Далее, при СКФ 15–29 мл/мин/1,73 м2, следует ХБП С4. На этой стадии (заранее!) обсуждаются перспективы ЗПТ, выбирается оптимальный для данного больного ее метод и проводится необходимая подготовка. Пятая стадия ХБП – ХБП С5 при СКФ менее 15 мл/мин/1,73 м2 носит еще название терминальной. Это ситуация, когда вопрос о ЗПТ требует уже непосредственного решения (обычно начинают при СКФ 8–10 мл/мин/1,73 м2). СКФ – универсальный показатель, характеризующий функциональное состояние почки в целом, определяющий стадию ХБП и тактику ведения. При СКФ <60 мл/мин/1,73 м2 пациенту надо менять терапию. Использовать препараты, которые выводятся печенью и будут безопасны в случае плохой работы почек.
По данным метаанализа экспертов KDIGO 2009 г., уровень СКФ <60 у лиц как моложе, так и старше 65 лет имеет критическое значение для общего и почечного прогнозов.
Выводам предшествовало исследование, в ходе которого были изучены 1,5 миллиона человек по трем группам:
1. Представители общей популяции.
2. Лица с высоким риском развития ХБП (АГ, сахарный диабет, сердечно-сосудистые заболевания, признаки ХБП в анамнезе).
3. Лица с уже имеющейся ХБП.
Анализировали 5 видов неблагоприятного исхода:
• смертность по любой причине;
• смертность от сердечно-сосудистых осложнений;
• развитие ТПН (терминальная почечная недостаточность);
• развитие ОПН (острая почечная недостаточность);
• прогрессирующее снижение функции почек: снижение СКФ на ≥2,5 мл/мин/1,73 м2 в год, приводящее к показателю <45 мл/мин/1,73 м2 к концу наблюдения.
Выяснилось, что при СКФ ниже 60 мл/мин/1,73 м2 резко повышается риск неблагоприятных исходов. При альбуминурии ≥30 мг/г отмечаются повышение смертности и риск неблагоприятных почечных исходов даже при СКФ выше 60 мл/мин/1,73 м2.
Основаны либо на определении степени азотемии, либо на определении клиренса различных веществ.
1) Уровень креатинина сыворотки крови
Это очень «сырой», неточный показатель работы почек, не позволяющий с уверенностью говорить о норме и патологии, о стадии ХБП. Его можно использовать только для грубой оценки (если повышен, то явное снижение СКФ) и для динамического контроля. Причина в том, что кинетика креатинина и его индивидуальная «норма» непосредственно зависят от массы мышечной ткани, а она варьирует в широких пределах как в популяции, так и у конкретного человека в течение его жизни.
Всего два случая, когда мы оцениваем функцию почек по креатинину сыворотки:
а) При остром повреждении почек (ОПП) или острой почечной недостаточности (ОПН) – когда уровень креатинина увеличивается в полтора раза менее чем за 2 сут.
б) При быстропрогрессирующем снижении функции (например, при быстропрогрессирующем гломерулонефрите), когда уровень креатинина сыворотки увеличивается в полтора раза менее чем за 2 мес.
! Если речь идет о ХБП, мы не судим по креатинину, только по СКФ. Потому что при одинаковом уровне креатинина у разных пациентов может быть разная степень дисфункции почек.
2) Определение СКФ с помощью клиренсовых методов или специальных формул.
а) Оценка СКФ по клиренсу креатинина: проба Реберга – Тареева.
Что такое клиренс? Это расчетная величина, которая показывает, какой объем крови может быть полностью очищен за единицу времени от экзогенного или эндогенного вещества, свободно проходящего через клубочковый фильтр.
Вещество должно постоянно образовываться, поступать в кровь с одинаковой скоростью, не реабсорбироваться и не секретироваться в почечных канальцах. Таким веществом оказался креатинин.
Проба Реберга – Тареева – сложный, но при этом достаточно точный метод определения СКФ (уступает в точности лишь радиоизотопному исследованию). СКФ рассчитывается следующим образом: объем выделенной за сутки мочи делится на количество минут в сутках и умножается на отношение концентрации креатинина мочи к концентрации креатинина сыворотки крови, взятой в конце пробы.
Однако этот метод неудобен, особенно для амбулаторной практики, и применяется в основном в стационарах.
б) Радиоизотопное исследование
Есть очень яркие умные методики – нефро- или реносцинтиграфия, позволяющая в том числе раздельно оценить функцию правой и левой почки. Это референтные методы, в основе которых лежит определение плазматического клиренса 99mТс-DTPA – диэтилентриаминпентауксусной кислоты,меченой радиоизотопным технецием. К сожалению, сегодня изотопные исследования уходят из нашей практики, поскольку радиофармпрепараты невероятно дорогие. Очень обидно за сцинтиграфию – редкую методику, которая в отличие от более распространенных инструментальных методов (УЗИ, эндоскопия, КТ, МРТ) показывает не анатомию, а функционирующую паренхиму.
в) Расчетные методы
Наконец, мы добрались до формулы СKD-EPI (Chronic Kidney Disease Epidemiology Collaboration), которую сегодня используют во всем мире для амбулаторных пациентов и скрининговых исследований. На что стоит обратить внимание?
На то, что помимо гендерных, есть возрастные и расовые особенности – для лиц монголоидной расы свой вариант уравнений. Формула очень простая: Х надо умножить на Y в степени возраста и умножить на креатинин, деленный на Z в отрицательной степени. Необходимые значения можно взять из таблиц.
Расчет СКФ очень важен – вы должны провести через него каждого больного с диабетом, гипертонией, мерцательной аритмией. Только так вы поймете, что делать с этим пациентом.
Только представьте, у пациентов 3-я и 5-я стадия, и они никогда не были у нефролога, им никогда не ставили диагноз болезни почек. И у каждого из нас таких пациентов на приеме очень много.
На 3-й стадии уже нужно пересматривать терапию, да и на 2-й по-хорошему тоже. Вы определили СКФ, допустим 78 мл/мин. И понимаете, что это еще не 3-я стадия ХБП, но где 78, там через полгода будет 65, и, значит, пора действовать!

Каковы преимущества формулы СKD‑EPI:
1) Мощная доказательная база – 8 254 обследованных, средняя СКФ 68 мл/мин/1,73 м2 .
2) Учитывает повышение канальцевой секреции креатинина на поздних стадиях ХБП.
3) Отражает расовые особенности, в частности для представителей монголоидной расы.
4) В отличие от прежних формул (Кокрофта – Голта, MDRD), может с высокой точностью применяться на любой стадии ХБП.
5) Учитывает возраст пациентов и его влияние на СКФ.
6) Одобрена как лучшая в Российских клинических рекомендациях по диагностике и ведению ХБП.
Остановимся на деталях.
Канальцевое повышение креатинина на поздних стадиях ХБП? Безусловно! Поступление креатинина в кровь зависит от мышечной массы.
90–95 % вещества удаляется из крови за счет клубочковой фильтрации, 5–10 % – за счет канальцевой секреции. При развитии ХБП, особенно на поздних стадиях, мышечная масса снижается, соответственно снижается количество креатинина, поступающего в кровь. При этом уменьшение клубочковой фильтрации отчасти компенсируется усилением канальцевой секреции, доля которой для креатинина увеличивается до 50 %! И формула CKD-EPI эти моменты учитывает. Также учитывается возраст и его влияние на СКФ. Почка очень привередлива, обидчива и злопамятна. В 25 лет ОПН или преэклампсия, прошедшие, казалось бы, без последствий, а в 55 – почечная недостаточность!
Еще одна особенность в том, что почка поздно созревает. До 30 лет она восходит к зениту своей зрелости, а с 30 лет начинает увядать. После 30 лет СКФ неуклонно снижается на 1–2 мл/мин каждый год. Чем старше человек, тем меньше СКФ в силу возрастных инволютивных изменений почек, однако при всей «естественности» этого процесса все риски, связанные с СКФ ниже 60 мл/мин/1,73 м2, сохраняют свою силу.
Вот почему почки надо в буквальном смысле «беречь смолоду».
Каковы ограничения в использовании формулы?
• нестандартные размеры тела (пациенты с ампутированными конечностями, бодибилдеры);
• выраженные истощение и ожирение;
• заболевания скелетной мускулатуры;
• параплегия и квадриплегия;
• вегетарианская диета;
• быстрое снижение функции почек (острый и быстропрогрессирующий гломерулонефрит, острое почечное повреждение);
• необходимость назначения токсичных препаратов, выводимых почками (например, химиотерапии);
• при решении вопроса о начале ЗПТ;
• больные с почечным трансплантатом;
• беременные женщины.
Если эти нюансы не учтены, неизбежна ошибка. Например, представьте огромного бодибилдера и сухонькую старушку. У них одинаковый уровень креатинина в крови – 150 мкмоль/л (по М. Я. Ратнер – 1-я стадия ХБП). Но при этом у спортсмена с его большой мышечной массой это соответствует СКФ 57 мл/мин/1,73 м2 (ХБП С3а), а у старушки – СКФ 30 мл/мин/1,73 м2, т. е. переходу из 3б в 4-ю стадию.
! Поэтому запомните: при одном и том же уровне креатинина могут быть совершенно разные функции почек.
Как их выявить? Хроническая болезнь почек твердо стоит на двух ногах: одна – это нарушение функции и вторая – задокументированные повреждения почек.
1. Стойкие изменения мочевого осадка: эритроциты, лейкоциты и цилиндры, какой из трех элементов осадка является бесспорно почечным? Конечно, цилиндры! Эритроциты и лейкоциты могут иметь урологическое происхождение, и их повышенный уровень в моче требует консультации уролога. А цилиндры – не что иное как слепки канальцев.
2. Изменения почек по данным УЗИ или других визуализирующих методов исследования:
• аномалии развития, кисты, камни, гидронефрозы, опухоли;
• признаки нефросклероза: уменьшение размеров почек и толщины паренхимы, повышение эхогенности, нарушение кортикомедуллярной дифференцировки.
Сегодня только ленивый врач, проводящий УЗИ почек, не находит в почке признаков хронического пиелонефрита. Расширение, деформация чашечно-лоханочной системы почки (ЧЛС) свидетельствуют о нефрологической проблеме, уплотнение ЧЛС – только о возрасте.
3. Патоморфологические изменения в ткани почки.
Конечно, при многих болезнях почек самый точный способ постановки диагноза – нефробиопсия, но если в США или Европе это нередко рутинная процедура, у нас она доступна в небольшом числе центров.
4. Повышенная альбуминурия/протеинурия. Что еще говорит о повреждении почки? Появление альбумина в моче. Может ли белок обнаруживаться в моче человека без заболевания почек? В общем, может – при больших физических нагрузках (маршевая протеинурия), беременности, лихорадке нередко отмечается заметная, но неопасная потеря белка с мочой, не связанная с патологией почек. (Норма в табл. 3).
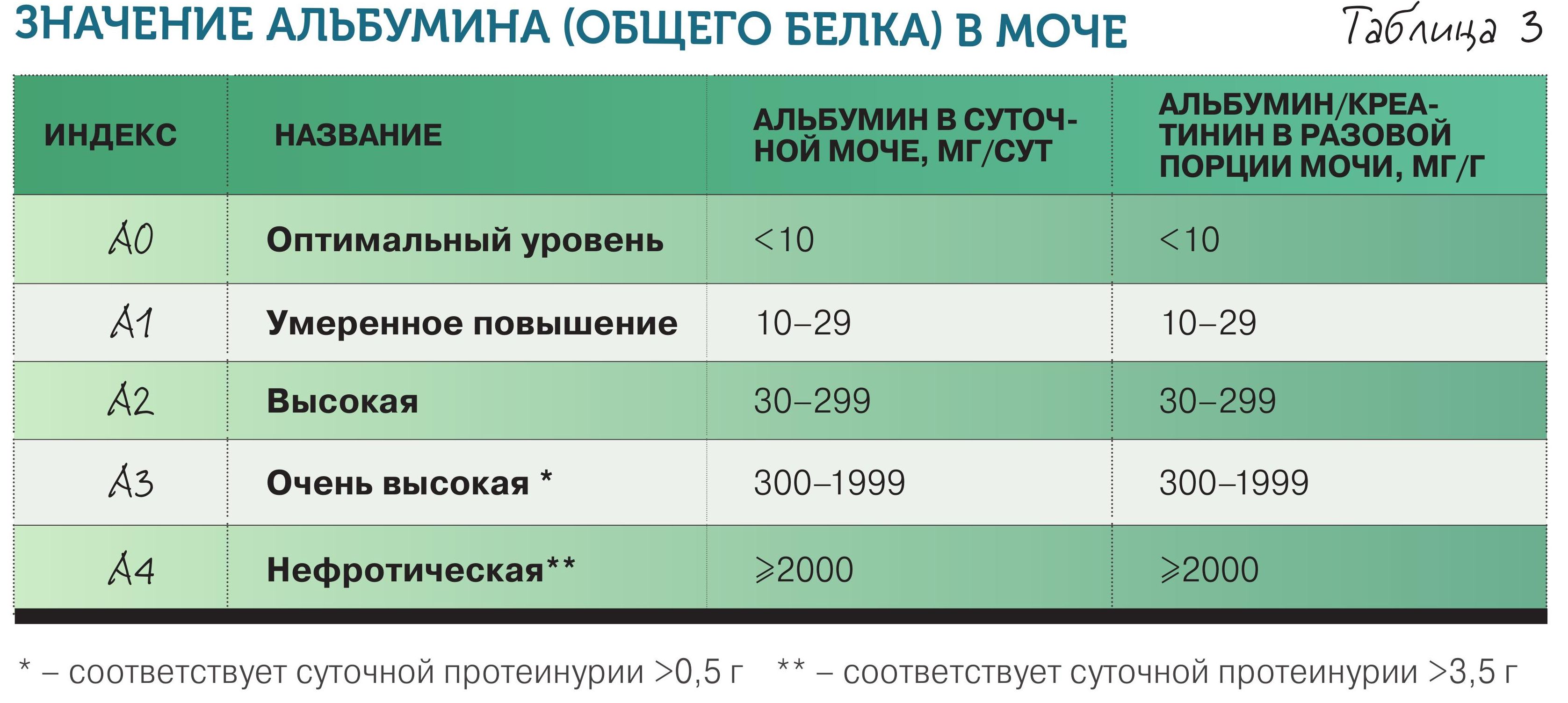
Если человек выделяет с мочой менее 10 мг альбумина в сутки – это вариант нормы или категория альбуминурии 0 (А0). Альбуминурия 10–29 мг/сут – умеренное повышение (А1), 30–299 мг/сут – высокая альбуминурия (А2), ≥300 мг/сут, что примерно соответствует протеинурии ≥0,5 г/сут, – очень высокая (А3). Уровень альбуминурии должен обязательно отражаться в виде соответствующего индекса в диагнозе ХБП после ее стадии. Например, у больного с СКФ 55 мл/мин/1,73 м2 и протеинурией 1,5 г/л будет диагностирована ХБП С3аА3.
Конечно, золотым стандартом по оценке состояния почек будет исследование суточной мочи, но этот метод более приемлем для стационара. При исследовании разовых порций мочи рекомендуется расчет отношения: общий белок: креатинин мочи или альбумин: креатинин мочи.
Альтернативой выступает определение микроальбуминурии с использованием тест-полосок.
Но такая альтернатива – скорее, от безысходности, когда других доступных способов исследования нет. Положительные результаты, полученные с их помощью, нуждаются в уточнении с помощью количественных методов.
При высоком риске развития ХБП целесообразно начинать сразу с количественных методов.
Ставим либо основное заболевание почек, если это нефрологический больной, либо сопутствующее заболевание, которое привело к нефропатии.
Дальше в диагнозе должно быть:
• стадия ХБП;
• выраженность альбуминурии/протеинурии, наличие АГ, риск ССО;
• нарушение обмена вещества пуринового, липидного, углеводного, фосфорно-кальциевого;
• наличие анемии.


Например, в карте терапевтического пациента с поражением почек вы пишете: гипертоническая болезнь III стадии, АГ – 2-й степени, риск 4.
Гипертоническая нефропатия. ХБП С3бА3. Гиперлипидемия. Гиперурикемия.
У пациента нефрологического:
Хронический гломерулонефрит гематурического типа (морфологический – IgA-нефропатия). ХБП С1А3. Гиперлипидемия.
Тяжелый наследственный случай:
Аутосомно-доминантная поликистозная болезнь почек. ТПН – ХБП 5 Д (постоянный гемодиализ с января 2010). АГ III стадии, риск 4. Анемия. Вторичный гиперпаратиреоз.

По МКБ остался тот же шифр, что был для ХПН. N18. Поменялась только формулировка – ХПН на ХБП. И после точки ставится стадия. N18.1, N18.3 и так далее. Код N18.9 обозначает ХБП с неуточненной стадией.
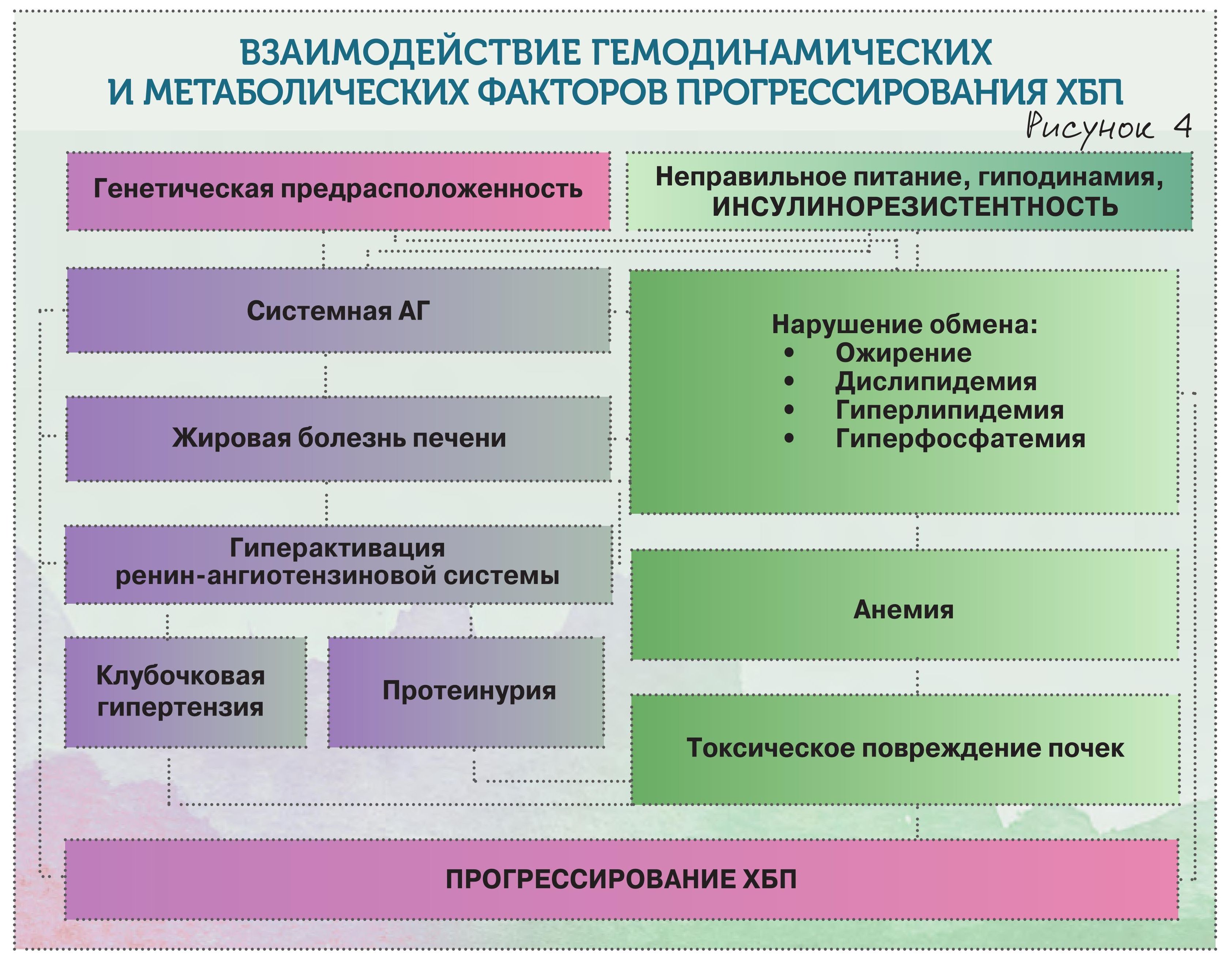
Лечение ХБП – это нечто абстрактное, а вот терапия соматического пациента с учетом нефропротекции – конкретное. На что нужно обратить внимание? На очень многие моменты, но в первую очередь – на инсулинорезистентность. У полных пациентов ХБП развивается куда чаще, чем у худых. И если не работать с инсулинорезистентностью, мы упустим пациента. Это ожирение, гипергликемия, жировая болезнь печени, системная гипертензия, анемический синдром.
! Не пропустите повышение глюкозы натощак. Пациентов с поврежденными почками, имеющих повышение уровня гликемии натощак, куда больше, чем с нормогликемией. Немедленно разрабатывайте нефропротективную стратегию.
Принципы нефропротективной стратегии:
1. Вводим обязательные особенности по режиму
• Диета 30–35 ккал/кг.

• Соль менее 5 г.
• Белок 1,0–1,2 г/кг массы тела при ХБП С1–2, 0,6–0,8 г/кг при ХБП С3, 0,6–0,3 г/кг при ХБП С4.
• Физ. нагрузки 3–5 ч/нед (рис. 5).
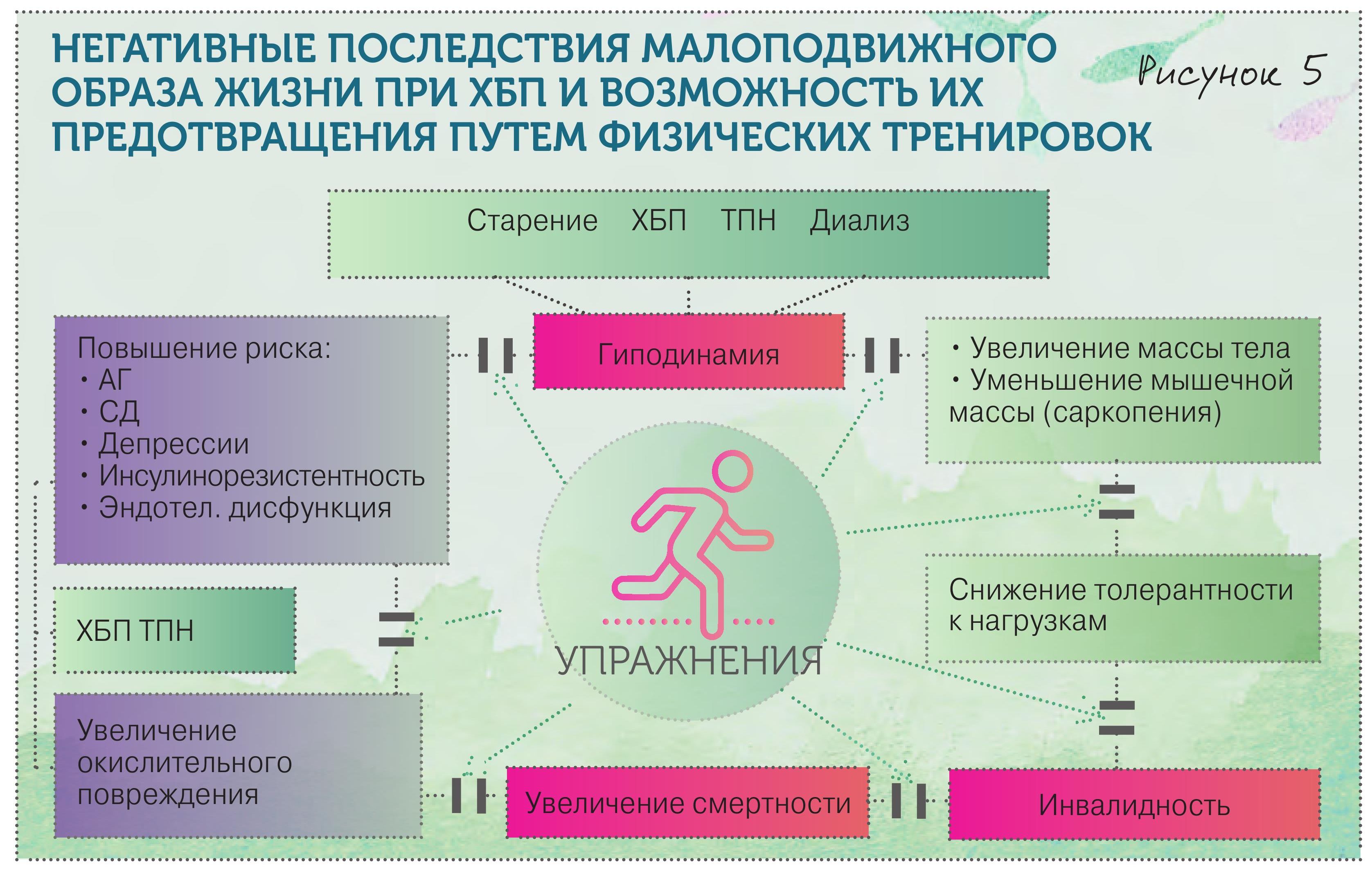
• Отказ от курения.
• Ограничения по применению анальгетиков и НПВП.
2. Снижаем протеинурию и артериальное давление:
• препараты, подавляющие активность ренин-ангиотензиновой системы;
• другие антигипертензивные препараты по ситуации.
3. Нормализуем метаболические показатели (табл. 4):

• статины, аллопуринол – при СКФ менее 45 мл/мин/1,73 м2 – с большой осторожностью, при СКФ менее 30 мл/мин/1,73 м2 назначать не рекомендуется, либо фебуксостат;
• метформин – только до определенной степени снижения СКФ, аналогично аллопуринолу;
• стимуляторы эритропоэза, препараты железа;
• витамин D3 и его аналоги, фосфатсвязывающие препараты, кальцимиметики.
Начинается с 3а стадии. То, что ограничение потребления белка замедляет прогрессирование ХБП, доказано большим количеством исследований. Чем меньше пациент с ХБП потребляет белка, тем медленнее снижается СКФ.
Малобелковая диета уменьшает протеинурию, улучшает почечную гемодинамику и пуриновый обмен, повышает эффективность антигипертензивных препаратов, способствует коррекции гиперфосфатемии, гиперкалиемии и профилактике метаболического ацидоза. На первый взгляд – сплошные плюсы, но у низкобелковой диеты есть глобальный минус – синдром белково-энергетической недостаточности, когда организм начинает брать белок у самого себя. И в первую очередь из мышц, включая сердечную.
Синдром белково‑энергетической недостаточности:
• дефицит калорий, незаменимых аминокислот, нарушение синтеза жизненно важных белков;
• гиперкатаболизм белкового тела;
• снижение массы тела и мышечной массы, клетчатки;
• гипоальбуминемия, парадоксальное повышение азотистых шлаков, гиперкалиемия;
• высокая смертность.
Поэтому имеет смысл давать компенсацию в виде соевого изолята и, с 3б-стадии – кетокислот.
На поздних стадиях ХБП (4–5) надо уменьшить количество всего, что является донаторами фосфора: рыба, морепродукты, плавленый сыр, творог и так далее. И все, что является рекордсменами по калию – сухофрукты (прежде всего, курага, чернослив, изюм), орехи, бобовые, картофель – начиная с 4-й стадии, на все вводятся ограничения.
На 5-й стадии, когда начинают гемодиализ, появляется псевдобонус, очень многие запреты исчезают, хотя сохраняется ограничение соли, фосфора, необходимо контролировать потребление воды. И пациент может позволить себе все то, в чем давно себе отказывал. Сейчас также очень активно обсуждается вопрос о том, что неоправданное снижение физической нагрузки приводит к ухудшению ситуации с почками – как на ранних стадиях ХБП, так и у больных, получающих лечение диализом. На Западе к вопросу подошли радикально: врачи говорят пациенту:
«Не двигаешься без меня, будешь двигаться со мной!» И в процессе гемодиализа он… крутит педали!
До каких цифр снижать артериальное давление (АД)? Сегодня европейские рекомендации звучат так: у пациентов всех возрастных групп (до 80 лет) рекомендуется снижать АД до уровня <140/90 мм рт.ст. У более молодых (18–55 лет) АД может быть снижено до более низкого уровня (<130/80 мм рт.ст.) при условии хорошей переносимости. Хотя раньше пациентам с сахарным диабетом и ХПН рекомендовали более строгий контроль АД (<130/80 мм рт.ст.), преимущества такого подхода для всех случаев ХБП остаются недоказанными и следует его снижать до уровня <140/90 мм рт.ст.
Но! Есть исключение. По данным метаанализа и систематического обзора, чем выше протеинурия, тем жестче должен быть контроль АД. И тут крайне важна степень потери белка: для больных с альбуминурией ≥ 300 мг/сут или протеинурией ≥ 0,5 г/сут предпочтительнее уровень АД (<130/80 мм рт.ст.).
Антигипертензивные средства представлены:
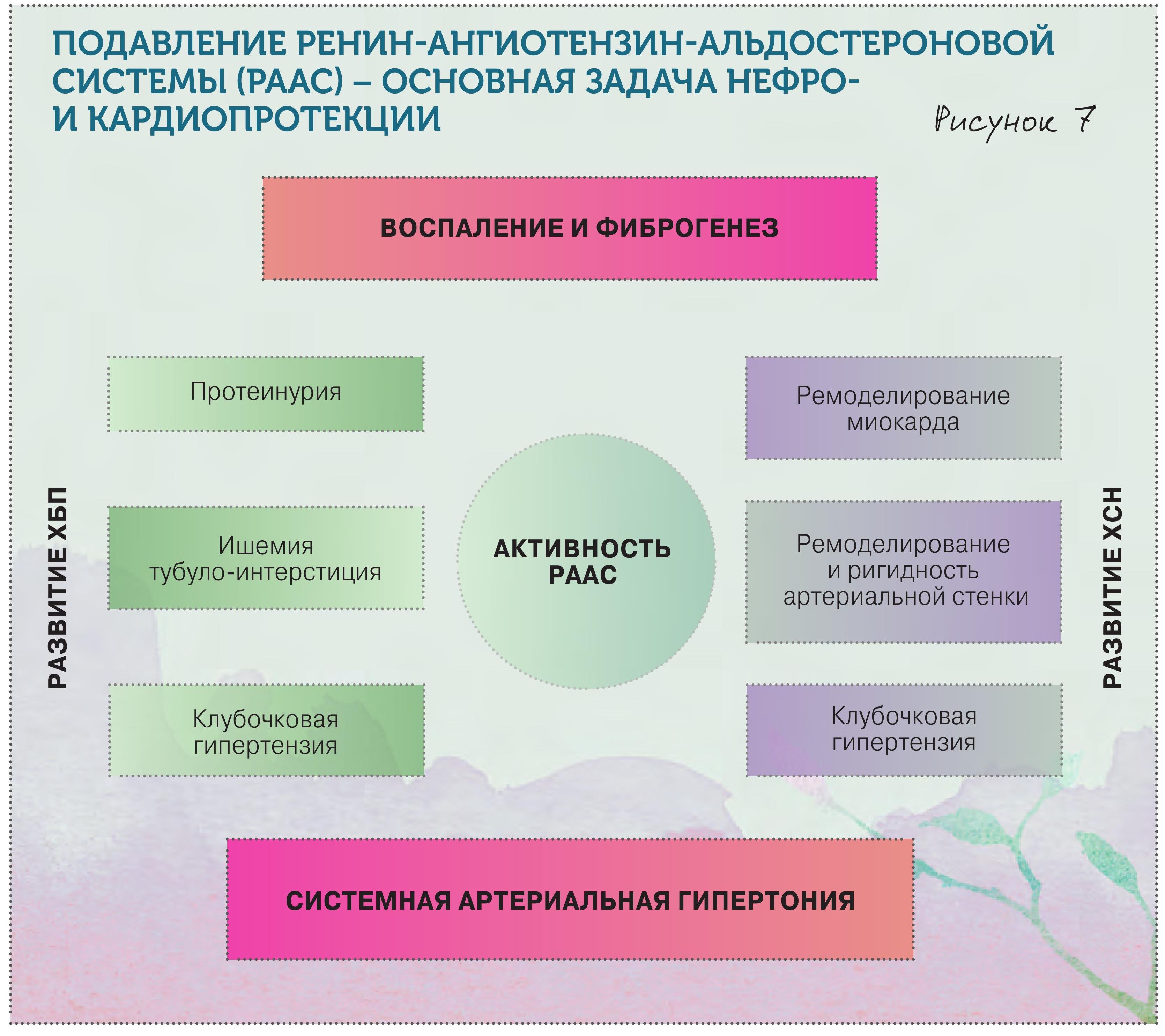
1) Препаратами, блокирующими РААС
Подавление РААС – основной инструмент нефро- и кардиопротекции! Соответственно, нужно использовать препараты, блокирующие РААС, – ингибиторы АПФ и сартаны. Если их сравнивать, то по влиянию на защиту почки они во многом сопоставимы, только у сартанов меньше побочных эффектов.

2) Антагонистами кальция
Представлены двумя группами – дигидропиридинами и недигидропиридинами. Дигидропиридиновые антагонисты кальция, особенно нифедипин, расширяют только приносящую артерию. Что при этом происходит внутри клубочка? Растет внутриклубочковое давление, растут альбуминурия и протеинурия.
Недигидропиридиновые расширяют и приносящую артериолу, и выносящую, поэтому давление внутри клубочка снижается, потеря белка уходит, по данным экспериментальных исследований, они также подавляют склероз почечного мезангия. Однако при клиническом применении преимущества недигидропиридинов оказались не столь заманчивыми. В то же время дигидропиридины в сочетании с блокаторами РААС в клинических исследованиях благоприятно влияли на почки за счет эффективного снижения АД. Отсюда правило: при высоком АД назначаем дигидропиридины, но обязательно в сочетании с иАПФ или БРА, как в свободной, так и в фиксированной комбинации; при умеренной АГ и высокой протеинурии предпочтительнее недигидропиридины.
3) Бета‑блокаторы
Говоря о гипертензии, нельзя не упомянуть бета-блокаторы. У них нет нефропротективных свойств, но зато они подавлют гиперактивацию симпатоадреналовой системы, развивающуюся у больных с ХПН, и вносят дополнительный вклад в подавление РААС, они снижают риск сердечно-сосудистых осложнений, уменьшают потребность миокарда в кислороде. Поэтому с точки зрения кардиопротекции бета-адреноблокаторы можно использовать как важный компонент антигипертензивной терапии.
Клиническое сравнение иАПФ и БРА
• По влиянию на протеинурию и прогрессирование ХБП сопоставимы.
• При использовании БРА побочные эффекты отмечаются реже:
– сухой кашель
– ангионевротический отек
– гиперкалиемия
Риск острого повреждения почек и нарушений эмбриогенеза сопоставимы. У сартанов есть удивительные свойства молекул, не связанные с давлением. Например, лозартан снижает мочевую кислоту сыворотки. Ни один другой сартан этого не может. Поэтому это лучшее, что можно предложить гипертонику с гиперурикемией. Препарат телмисартан активирует PPR-гамма-рецепторы. Это лекарство, которое вроде как от давления, но при его применении также может отмечаться снижение уровня липопротеидов, триглицеридов. Ирбесартан, помимо антигипертензивного эффекта, так-же проявляет нефропротективные свойства.
Как повысить эффективность ингибиторов АПФ или сартанов?
• Ранее начало лечения – ДА!
• Применение адекватно высоких доз – разумеется.
• Низкосолевая и малобелковая диета – есть данные, что уменьшение в рационе соли и белка повышает чувствительность АТ1-рецепторов! То есть диета позволяет снизить дозу препарата.
• Сочетание с мочегонными – Важно! При СКФ <60 мл/мин следует избегать гидрохлоротиазида, потому что при этом его эффективность снижается, а риск гиперурикемии нарастает. В этих случаях рекомендуется использовать петлевые диуретики.
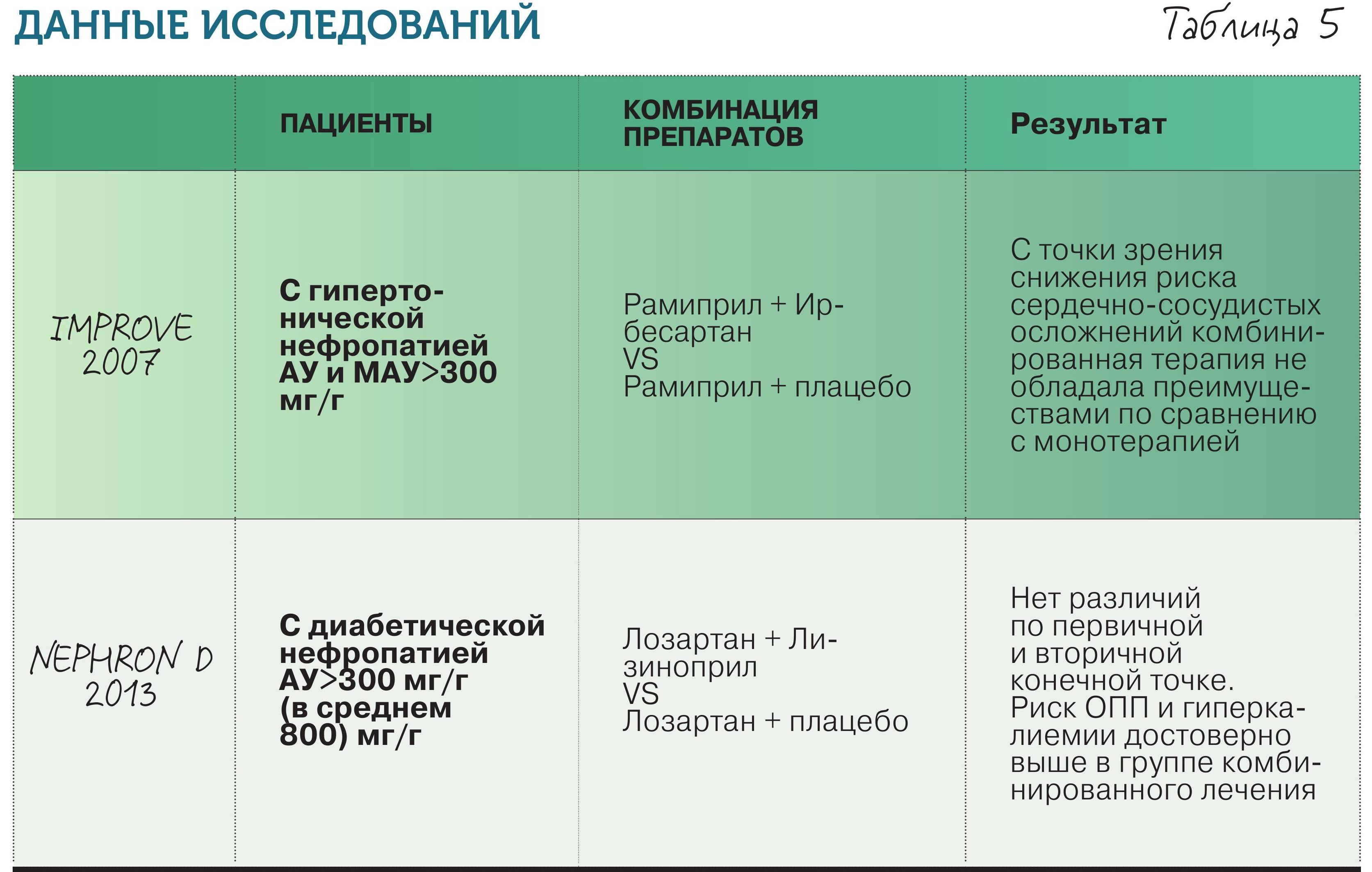
• Комбинация препаратов, подавляющих РААС, между собой – НЕТ, не стоит сочетать ингибиторы и сартаны, хотя логично предположить, что это должно повысить эффективность терапии. Рандомизированные исследования и их систематический обзор показали, что монотерапия ингибиторами АПФ или БРА предпочтительнее комбинированного лечения ввиду недоказанности преимуществ последнего и повышения риска побочных эффектов (табл. 5).
Правила назначения препаратов, подавляющих РААС:
1. Оценивать эффект и подбирать дозы, ориентируясь на уровень протеинурии, а не на АД!Чем выше потери белка, тем интенсивнее должна быть работа с давлением.
2. Соблюдать крайнюю осторожность при ХБП 3б-5 ст. Для лечения СН, нефропатии, ИБС – исключить каптоприл, эналаприл. Можно – рамиприл, фозиноприл, периндоприл, так как они выводятся печенью. Также большинство сартанов выводится печенью, соответственно, вы не рискуете вызвать передозировку.
3. Контролировать калий и креатинин крови (через 5–7 дней от начала приема/увеличения дозы, затем не реже 1 раза в 1–3 мес). Повышение креатинина до 30 % допустимо, более 30 % – опасно! Резкий скачок креатитина – верный маркер ишемической болезни почек.
Существует ряд антигипертензинвых препаратов, имеющих доказательную базу в отношении нефропротекции. Однако следует отметить, что не все препараты в одинаковой степени изучены на разных стадиях ХБП у пациентов с артериальной гипертонией и сопутствующим сахарным диабетом. Ярким примером наличия доказанных преимуществ в отношении нефропротекции может служить молекула Ирбесартана, применение которого было изучено в исследовательской программе PRIME, состоявшей из двух частей: первая часть называлась IRMA, а вторая – IDNT. Это были пациенты с сахарным диабетом, получавшие сартаны. В чем был смысл этого исследования?
В первой части исследования IRMA определяли, насколько Ирбесартан способен затормозить развитие ХБП в принципе. А исследование IDNT включало пациентов с ХБП, чтобы определить, насколько Ирбесартан способен отсрочить терминальную стадию. Итак, 600 пациентов с сахарным диабетом, микроальбуминурией, гипертензией, но нормальной функцией почек, то есть ХБП – нет.
200 пациентов на плацебо, 200 пациентов на Ирбесартане 150 мг и 200 пациентов на Ирбесартане 300 мг. Исследование длилось 2 года. Важно, что АД за это время во всех 3-х группах вывели на один уровень.
И вот результат: хуже всего нефропротекция была в группе плацебо, где больше всего пациентов перешли в ХБП, меньше – в группе, получавшей 150 мг. И совсем мало среди тех, кто получал 300 мг Ирбесартана. Причем побочных эффектов больше всего было опять же в группе плацебо, а меньше – в группе Ирбесартана 300 мг. Таким образом сделали вывод, что нефропротективный эффект не был связан с влиянием на уровень артериального давления.
Ирбесартан в дозе 300 мг на 70 % снижал риск прогрессирования протеинурии. Мало того, у пациентов восстанавливалась функция почек.
У пациентов с микроальбуминурией снижалось прогрессирование ХБП, показателей уровня альбуминурии. В IDNT Study включались пациенты с СД, с уже имеющейся нефропатией, гипертензией и протеинурией более 900 мг в сутки.
И здесь изучалось, может ли Ирбесартан не допустить перехода в терминальную стадию. 570 пациентов на плацебо, 570 – на амлодипине и 570 – на Ирбесартане 300 мг. Исследование в целом длилось 3 года, также было отмечено одинаковое снижение давления. И самые плохие результаты оказались даже не в группе плацебо, а в группе амлодипина. Соответственно, Ирбесартан – единственный сартан с доказанной эффективностью на всех этапах прогрессирования ХБП.
То есть Ирбесартан может быть назначен у пациентов с артериальной гипертонией и ХБП на фоне имеющихся нарушений углеводного обмена, что позволит отсрочить прогрессирование нефропатии.
25.03.2020 | 21:20:06