Аутоиммунный гепатит. Распространенность, причины, диагностика и лечение, прогноз.
Раздел: Статьи
/
Общая врачебная практика.
/
Гастроэнтерология
/
Аутоиммунный гепатит. Распространенность, причины, диагностика и лечение, прогноз.
Содержание
Эпидемиология аутоиммунного гепатита
Этиология и патогенез аутоиммунного гепатита
Диагностика аутоиммунного гепатита
Алгоритм диагностики аутоиммунного гепатита
Лечение аутоиммунного гепатита
Прогноз пациентов с аутоиммунным гепатитом
Аутоиммунный гепатит (АИГ) – хроническое заболевание печени неизвестной этиологии, характеризующееся перипортальным или более обширным воспалением и протекающее со значительной гипергаммаглобулинемией и появлением в сыворотке широкого спектра антител. Аутоиммунный гепатит считается редким заболеванием, распространенность которого в Европе составляет 16–18 случаев на 100 тыс. человек. Аутоиммунный гепатит может возникнуть в любой этнической группе, однако замечено, что распространенность заболевания выше в регионах с менее разнообразной этнической структурой населения. Среди коренных жителей Аляски распространенность АИГ составляет 42,9 случаев на 100 тыс. человек, а в Новой Зеландии – 24,5 случаев на 100 тыс. человек. Наблюдаются и некоторые этнические особенности течения заболевания. Например, у афроамериканцев АИГ чаще приводит к развитию цирроза, хуже ответ на лечение, прогноз и выше частота рецидивов после трансплантации печени.
Женщины преобладают в структуре заболеваемости – 71–95%, среди детей девочки составляют 60–76%. Предварительные эпидемиологические данные свидетельствуют о двух пиках манифестации заболевания – 10–30 лет и 40–60 лет, хотя, например, в Дании и Новой Зеландии второй пик манифестации заболевания приходится на возраст старше 65 лет.
Причина возникновения АИГ досконально не изучена. Современные представления о патогенезе АИГ предусматривают взаимодействие факторов окружающей среды, нарушения механизмов иммунной толерантности и генетическую предрасположенность. На молекулярном уровне это взаимодействие представлено антигенами – триггерами, белками главного комплекса гистосовместимости (MHC) и рецепторами Т-лимфоцитов.
Триггерными антигенами могут быть вирусы (корь, вирусные гепатиты, вирус простого герпеса, ветряная оспа, цитомегаловирус, Эпштейн–Барр), лекарственные препараты (оксифенизатин, метилдопа, нитрофурантоин, диклофенак, миноциклин и т. д.) и травы.
Генетическая предрасположенность к АИГ реализуется преимущественно через ассоциации с MHC. Напомню, что у человека этот комплекс генов находится в 6-й хромосоме и называется «человеческим лейкоцитарным антигеном» (Human Leukocyte Antigens – HLA). Например, у представителей белой расы АИГ 1-го типа тесно связан с серотипом HLA-DR3 и HLA-DR4, причем HLA-DR3 чаще встречается у женщин, ассоциирован с ранней манифестацией заболевания и более тяжелым течением, а HLA-DR4, напротив, чаще встречается у людей с поздней манифестацией заболевания, более частыми внепеченочными проявлениями и хорошим ответом на лечение. Существует связь и с мутациями в генах белков, участвующих в пролиферации и созревании аутореактивных лимфоцитов, продукции провоспалительных цитокинов, регулирующих иммунный ответ в целом.
Кратко патогенез аутоиммунного гепатита можно описать следующим образом (рис. 1).
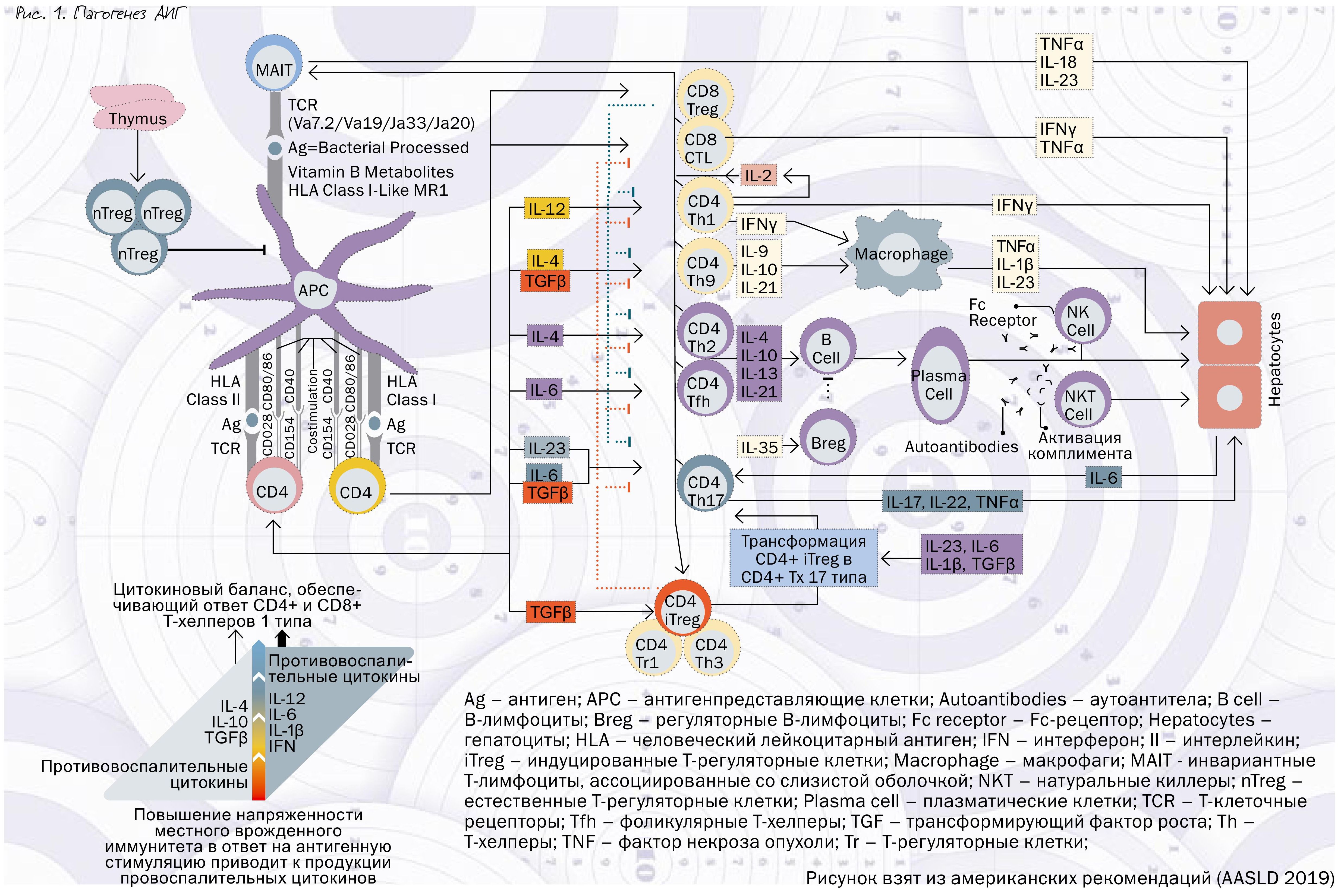
У генетически предрасположенных лиц во время системного и местного (в печени) иммунного ответа на внешние триггеры (например, вирус или ксенобиотик) по какой-то причине возникает ошибка, и компоненты клеточной стенки гепатоцитов начинают восприниматься печеночными макрофагами как чужеродные. Одновременно с этим Т-регуляторные лимфоциты (Treg), задача которых подавлять активацию Т-хелперов и Т-киллеров, перестают это делать, в результате чего запускается механизм активации CD4+ и CD8+ лимфоцитов и связанных со слизистой инвариантных Т-лимфоцитов (Mucosal-associated invariant T cells – MAIT), что приводит к активации клеточного и гуморального звеньев иммунитета и образованию цитотоксических лимфоцитов и антител к компонентам клеточной стенки гепатоцитов. Молекулы адгезии и хемокины обеспечивают миграцию иммунных клеток из сосудов в паренхиму печени, что приводит к воспалению прежде всего вокруг портальных трактов («интерфейс-гепатит»), апоптозу, некрозу гепатоцитов и фиброгенезу.
Диагностика аутоиммунного гепатита базируется на гистологических признаках (перипортальный гепатит), в сочетании с клиническими и лабораторными проявлениями (повышение АЛТ, АСТ, IgG, гамма- глобулинов) и наличием одного или нескольких характерных аутоантител.
В 25–34% случаев АИГ протекает бессимптомно. И это является одной из причин, по которой почти у 1/3 пациентов диагноз ставится уже на стадии цирроза печени. Кроме того, у таких пациентов довольно редко наблюдается спонтанная ремиссия заболевания (всего 12%) и прогноз в целом хуже, поскольку диагноз и лечение они получают позже.
У большинства пациентов АИГ протекает с общими неспецифическими симптомами:
общая слабость, повышенная утомляемость, сонливость, боли в суставах, нарушения менструации, боль в правом верхнем квадранте живота, периодически возникающая желтуха.
Кроме того, результаты недавно проведенных исследований свидетельствуют, что у пациентов с АИГ наблюдается высокий уровень депрессии и тревоги, что может имеет очень важное значение на этапе назначения иммуносупрессивной терапии.
В 25% случаев заболевание манифестирует остро: либо как истинно острое начало, либо как обострение хронического поражения печени.
Характерных внешних признаков АИГ нет, но могут быть обнаружены общие признаки цирроза печени и внепеченочных проявлений аутоиммунных заболеваний (например витилиго).
Острое или фульминантное течение аутоиммунного гепатита может ничем не отличаться от такового при гепатитах другой этиологии. Клинические рекомендации сходятся на том, что АИГ необходимо заподозрить у всех пациентов с острым и хроническим поражением печени, особенно при наличии гипергаммаглобулинемии.
При типичном течении заболевания активность АЛТ и АСТ может быть разной: от небольшого уровня до 50-кратного превышения нормы. Активность показателей холестаза при этом не повышена или повышена незначительно. Чаще наблюдается повышение ГГТ, причем этот показатель может быть использован в качестве прогностического фактора (в отличие от ЩФ).
Другими важными б/х показателями АИГ являются гаммаглобулины и IgG, наблюдаемые у 85% пациентов. После начала иммуносупрессивной терапии уровень IgG снижается, поэтому вкупе с АЛТ и АСТ снижение IgG считается признаком биохимической ремиссии заболевания.
В зависимости от спектра обнаруживаемых аутоантител в крови больного, выделают два типа данной нозологической формы. В таблице 1 представлены их основные различия.
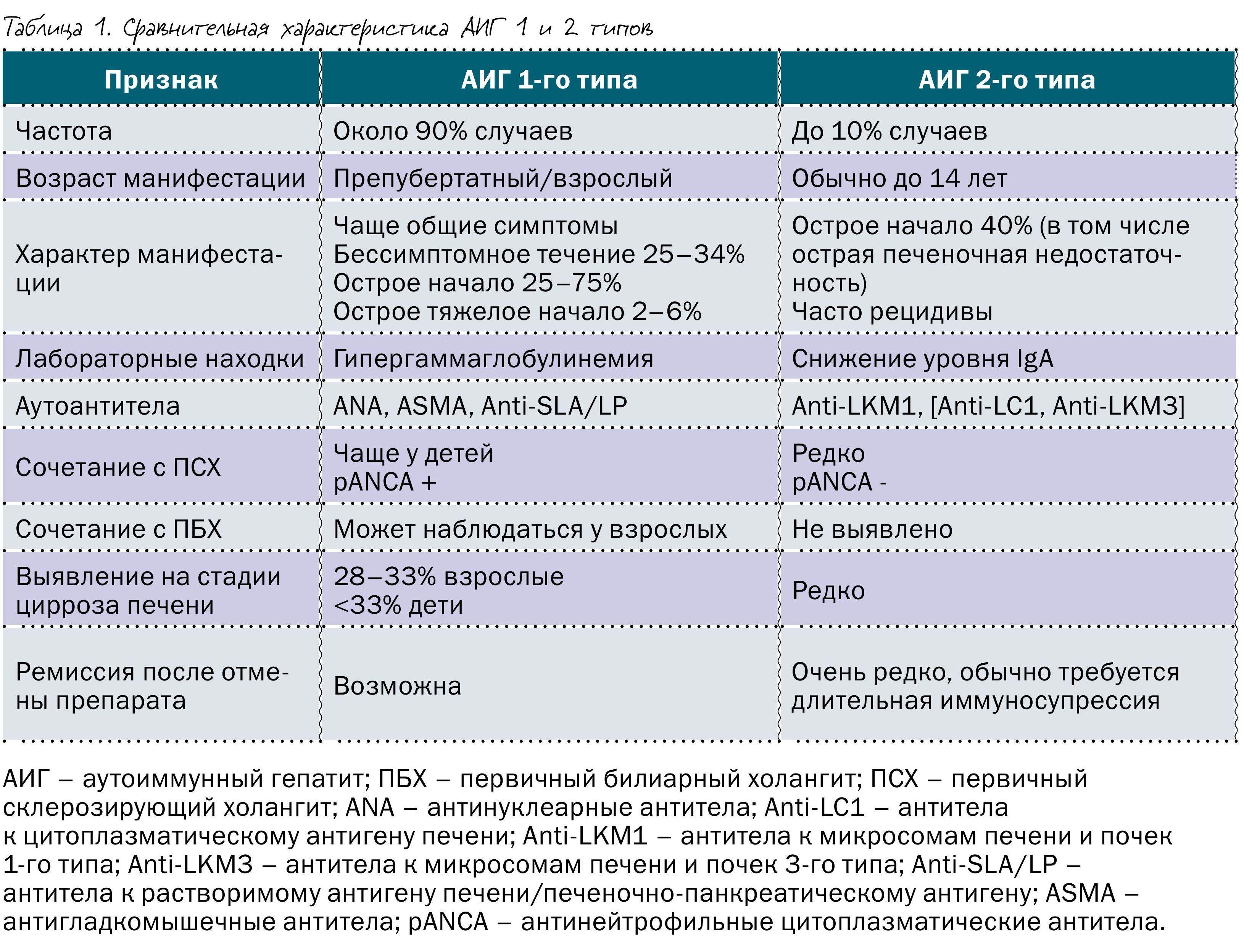

Иногда выделяют еще и 3-й тип, характеризующийся наличием в крови anti- SLA, anti- LP и anti- Ro52, но в последнее время чаще всего его рассматривают в качестве подтипа Аутоиммунный гепатит 1-го типа из-за сходства клинических проявлений. В 20% случаев, несмотря на наличие гистологических и клинико-лабораторных характеристик аутоиммунного гепатита, аутоантитела не определяются. В таком случае его классифицируют как серонегативный.
Несмотря на то что определение аутоантител в крови – один из самых важных параметров постановки диагноза, необходимо помнить, что чувствительность и специфичность этого метода диагностики нельзя назвать высокими.
Например, ANA и ASMA обнаруживаются у 80% и 63% пациентов с АИГ 1-го типа (США), Анти-LKM1 и анти- LC1 у 66% и 53% пациентов с АИГ 2-го типа. Положительные ANA могут быть обнаружены и при других заболеваниях печени, например, при ПСХ (29%), гепатите С (26%), гепатите В (32%), НАЖБП (34%), АБП (21%). ASMA могут быть положительными при ПСХ (6%), гепатите С (6%) и алкогольной болезни печени (4%). При одновременном обнаружении ANA и ASMA точность диагноза составляет 74%.
Наиболее высокой диагностической значимостью для АИГ 1-го типа обладают аутоантитела SLA/LP, правда, чувствительность этих маркеров не превышает 30%, зато специфичность составляет 99%.
Если вышеописанные аутоантитела в крови не обнаружены, но подозрение на АИГ все еще сохраняется, целесообразно провести исследование на атипичные антитела к цитоплазме нейтрофилов – рANCA. Они могут быть в крови пациентов с АИГ 1-го типа в 50–92% случаев. Однако их присутствие может также свидетельствовать о наличии у пациента ПСХ, ЯК или сочетания АИГ с ПСХ или даже при лекарственно- индуцированном поражении печени (миноциклин). И тем не менее у небольшого количества пациентов с АИГ это может оказаться единственным маркером заболевания.
Кроме того, необходимо помнить, что у части серонегативных (на момент постановки диагноза) пациентов аутоантитела могут быть обнаружены позднее. Именно поэтому в алгоритм серологической диагностики АИГ, предложенный Европейским обществом по изучению печени (EASL), входит рекомендация повторного определения аутоантител в случае отрицательного результата первичной их диагностики (рис. 2).
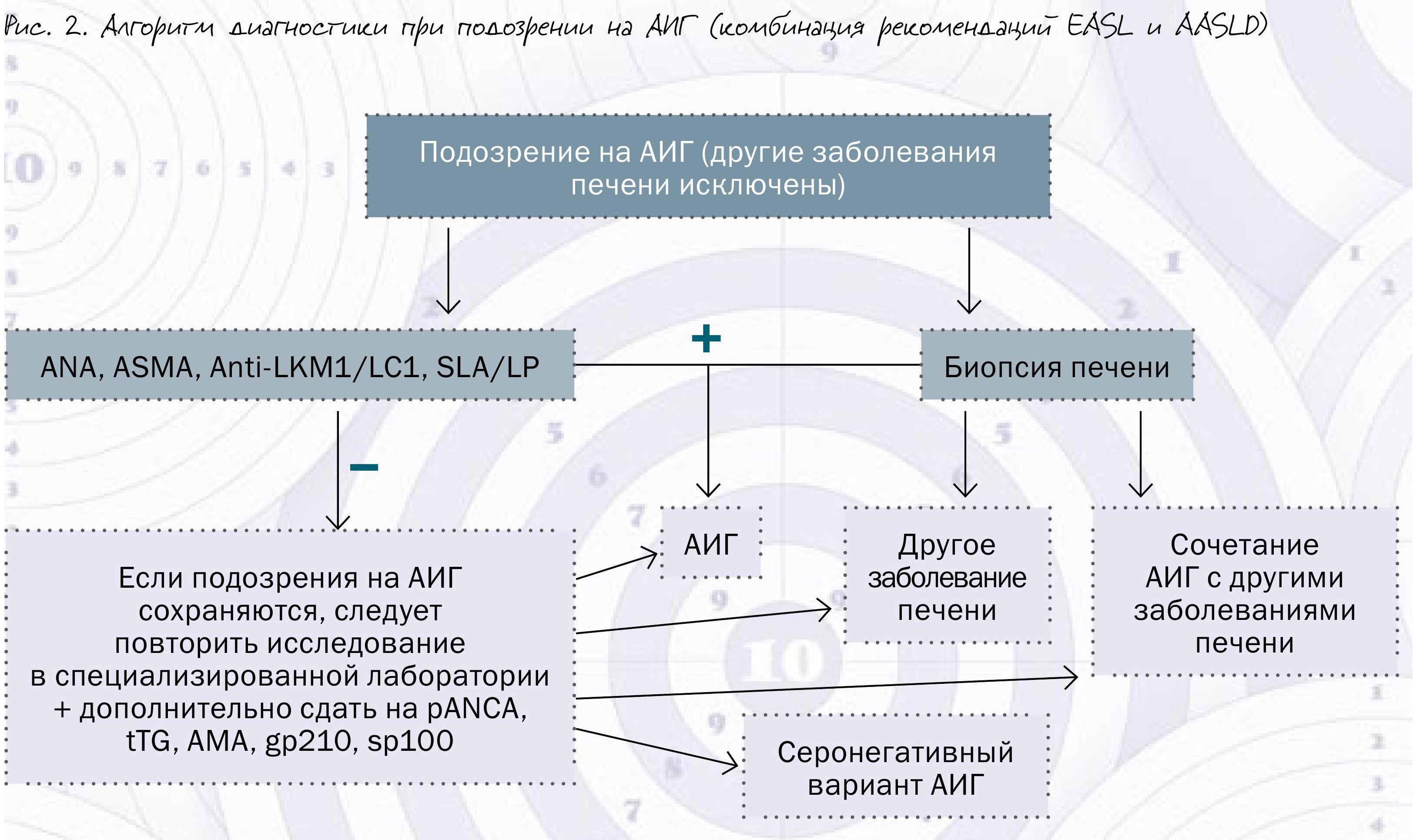

У взрослых пациентов титры аутоантител очень слабо коррелируют с активностью заболевания и ответом на лечение, поэтому необходимости в регулярном контроле их уровня, как правило, нет. У детей же, напротив, титры аутоантител служат ценными прогностическим параметром активности заболевания и ответа на лечение.
Постановка диагноза аутоиммунного гепатита невозможна без биопсии печени. Она необходима также и для определения активности заболевания, стадии (цирроз/не цирроз), исключения сочетанных и сопутствующих заболеваний печени. При наличии абсолютных противопоказаний к чрескожной биопсии печени (например, при выраженной коагулопатии) альтернативой может быть трансюгулярная биопсия (доступ через яремную вену), если, конечно, это технически возможно.
Характерными гистологическими признаками АИГ являются:
• лимфоплазмацитарная инфильтрация вокруг портальных трактов или «интерфейсный» гепатит с постепенным распространением воспаления в центр печеночной дольки;
• преобладание плазматических клеток в инфильтрате;
• эмпериополез (когда одна клетка «вдавливается» в соседнюю клетку, причем обе они сохраняют свою структуру и функции);
• «розетки» гепатоцитов – группы регенерирующих гепатоцитов (рис. 3).
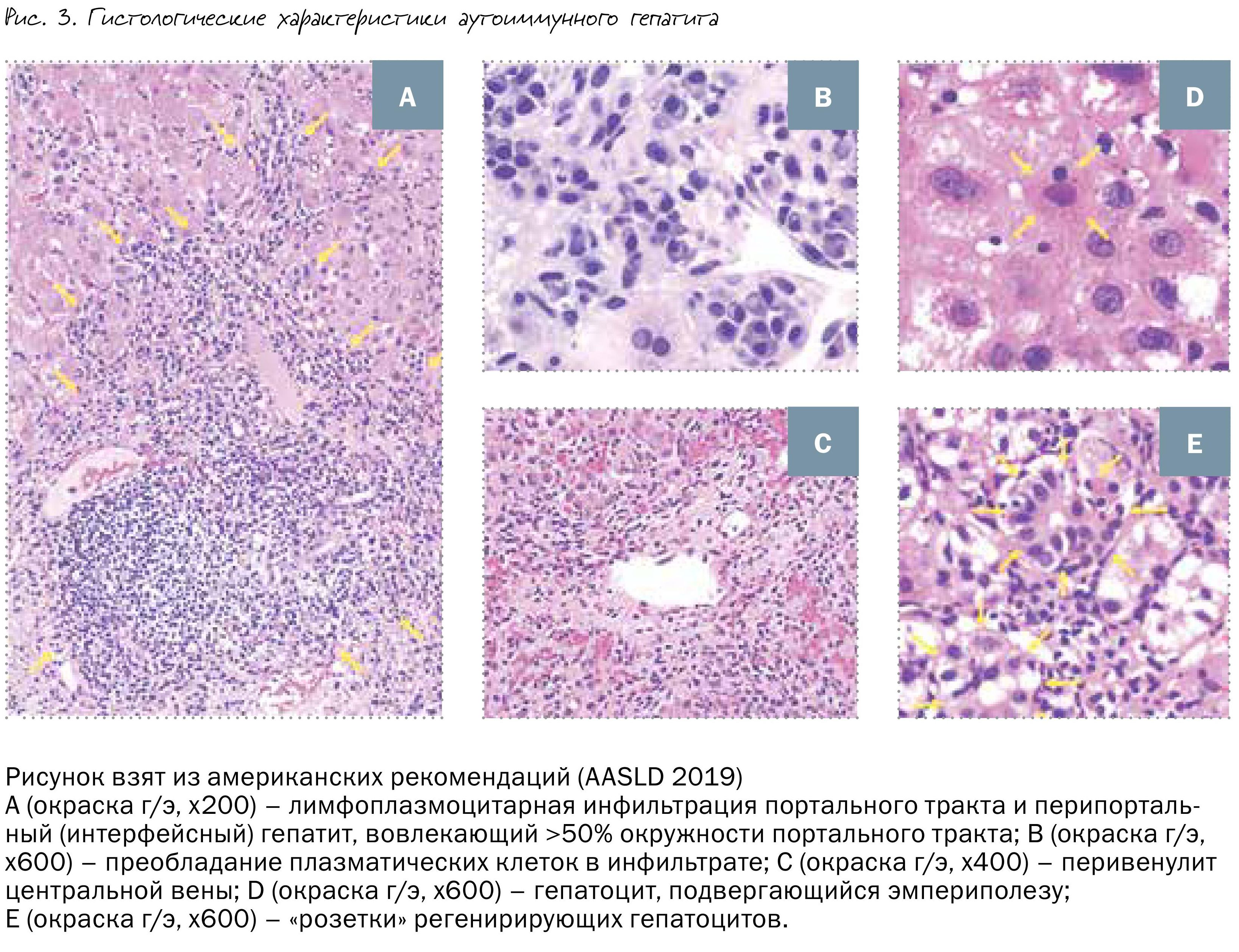

• при остром течении заболевания преобладает центролобуллярное воспаление и некроз.
Примерно у трети пациентов (преимущественно пожилого возраста) во время первой биопсии выявляется стадия цирроза печени.
Дифференциальный диагноз аутоиммунного гепатита проводится, по сути, со всеми другими заболеваниями печени, включая первичный билиарный холангит (ПБХ), первичный склерозирующий холангит (ПСХ) и IgG4-ассоциированный холангит, а также с печеночными проявлениями других аутоиммунных заболеваний (целиакия, СКВ и т. д.) и ВИЧ-инфекции (холангит).
Наибольшую сложность представляет дифференциальная диагностика с так называемыми перекрестными синдромами: АИГ + ПБХ, АИГ + ПСХ. Трудно провести дифференциальный диагноз между лекарственно- индуцированным АИГ и лекарственным поражением печени, протекающими с признаками АИГ. Мы не будем подробно касаться деталей сочетанных заболеваний печени, поскольку эта тема заслуживает отдельной публикации.
Важным в процессе обследования и постановки диагноза АИГ является поиск других аутоиммунных заболеваний у пациентов и родственников 1-й линии (таблица 2).


Клинические рекомендации указывают на необходимость диагностики аутоиммунного тиреоидита, целиакии, ревматоидного артрита, аутоиммунной гемолитической анемии, ВЗК, СД 1-го типа как самых частых патологий, ассоциированных с аутоиммунным гепатитом.
В 1993 году Международная группа по изучению АИГ (IAIHG) предложила использовать балльную систему оценки вероятности диагноза АИГ.
В 1999 году она была пересмотрена и обновлена, а в 2008 году вышла ее укороченная и упрощенная версия, более удобная в повседневной работе. Система предусматривает ранжирование каждого клинического, лабораторного и гистологического признака, а также ответ на лечение кортикостероидами (таблица 3 и 4).
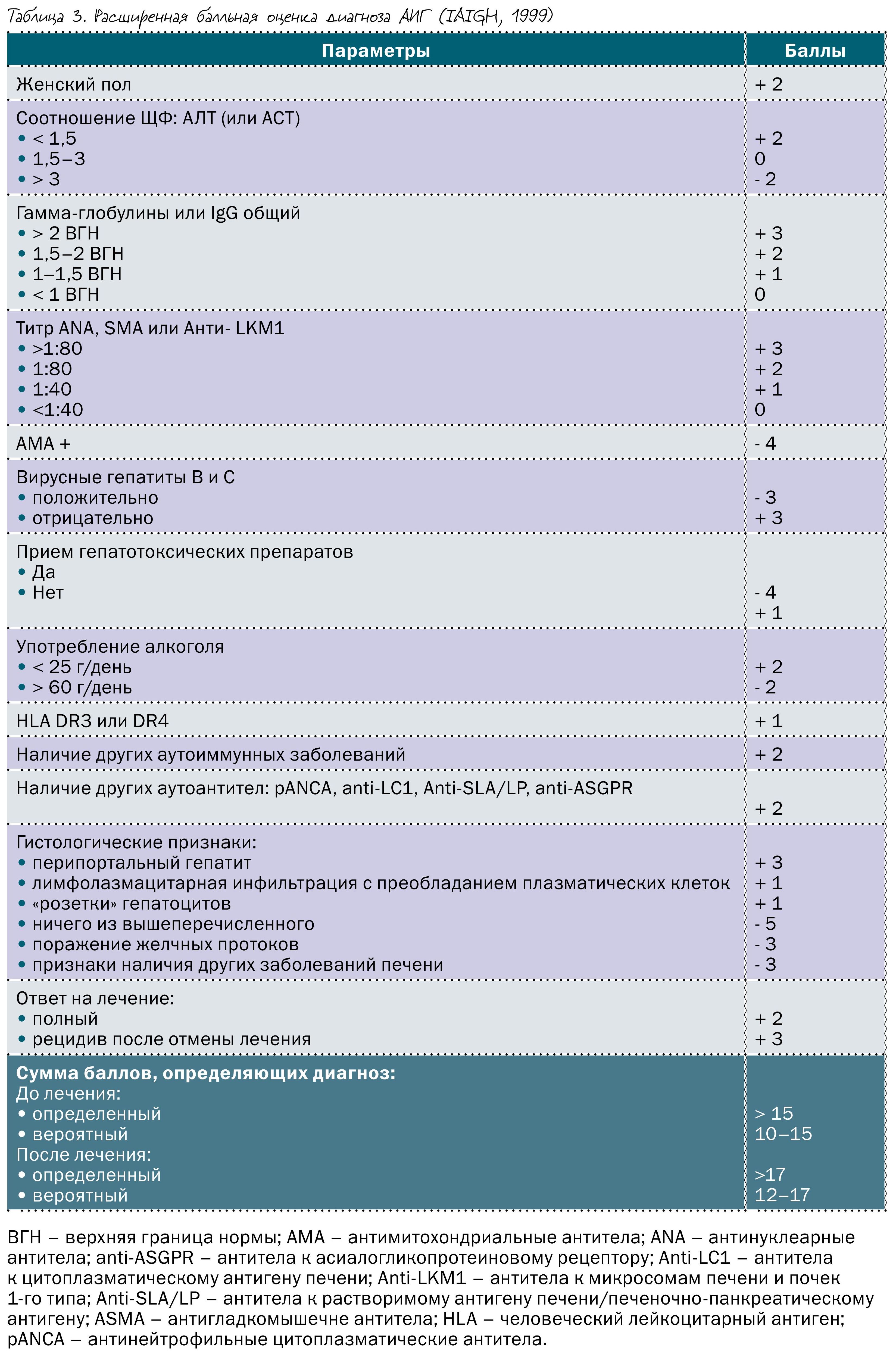

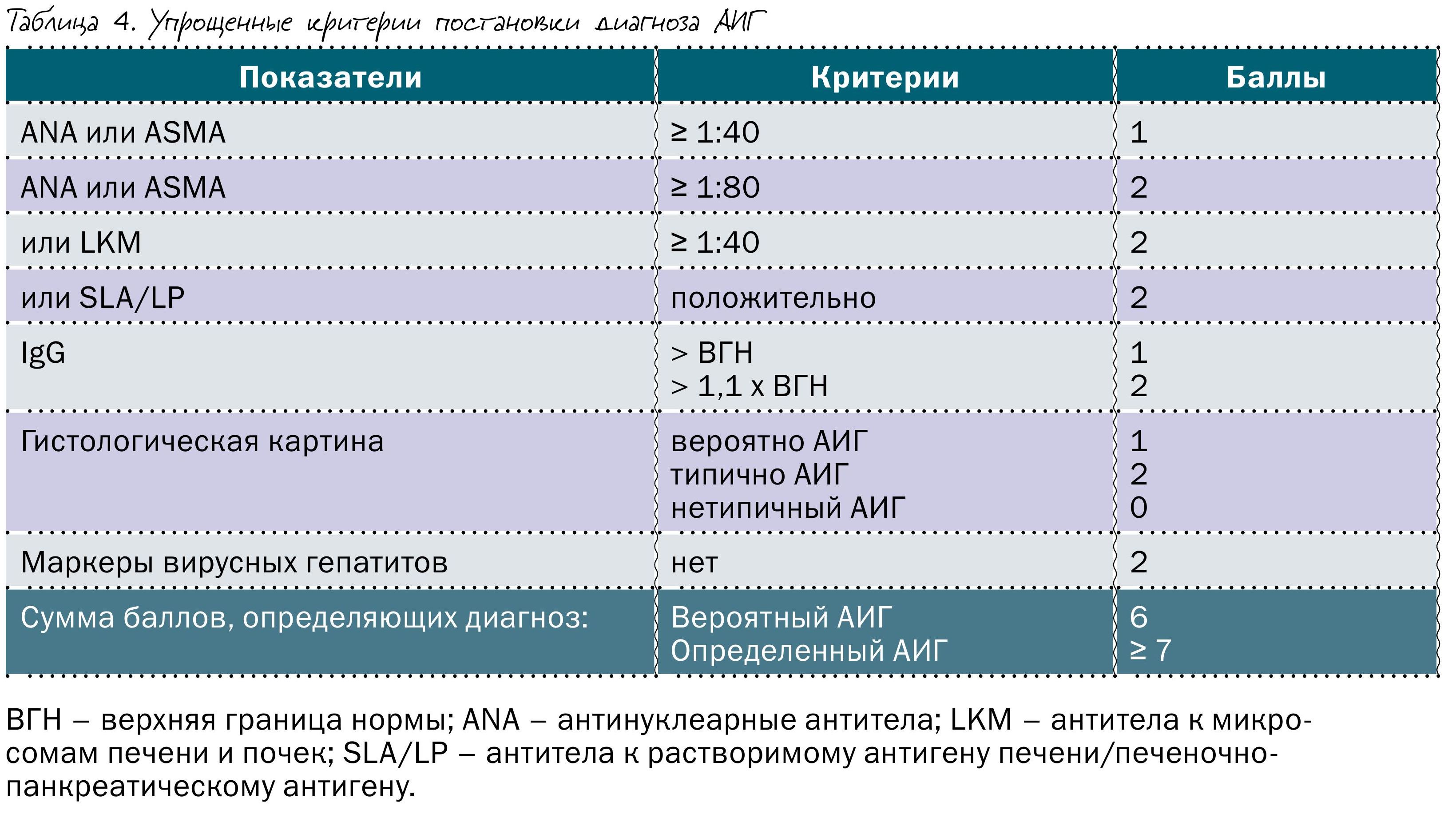

Расширенная балльная система имеет большую чувствительность по сравнению с укороченной версией – 100 против 95% соответственно, зато укороченная версия имеет большую специфичность – 92 против 73% и большую диагностическую точность – 92 против 82% соответственно. В клинических рекомендациях предложено использовать расширенную систему оценки вероятности АИГ, если по упрощенной схеме получается низкий балл или речь идет о необычной клинико-лабораторной картине аутоиммунного гепатита. В диагностически сложных случаях лучше направить пациента в профильный центр до начала лечения.
Мероприятия перед началом лечения
• Вакцинация. Во время терапии иммуносупрессорами применение живых вакцин нежелательно, в то время как инактивированные и рекомбинантные вакцины считаются безопасными. Всем пациентам с аутоиммунным гепатитом до начала планируемой терапии желательно провести вакцинацию от гепатита А и В. На фоне терапии эффективность вакцинации от гепатита В снижается до 76%.
• Тестирование на гепатит В (HBsAg, HBcorAb, anti- HBsAg). Как правило, HBV-положительным пациентам требуется назначение противовирусной терапии на фоне терапии ГКС для предупреждения прогрессирования заболевания. В HBsAg негативной фазе (HBsAg -, HBcorAg+, HBV DNA-) риск реактивации вируса возрастает в случае высоких доз ГКС и продолжительного лечения, особенно при значении препаратов 2-й линии, в связи с чем рекомендована регулярная (1 раз в 3 мес) оценка HBsAg и HBV DNA у данной группы пациентов.
• Оценка плотности костной ткани должна быть проведена в группах риска развития остеопороза до лечения и каждые 2–3 года после его начала. Профилактически необходим прием препаратов кальция (1000–1200 мг/сут) и витамина Д (400–800 ЕД/сут). При выявленном остеопорозе показана терапия бисфосфонатами.
• Определение уровня витамина D до начала лечения и ежегодно после. В случае дефицита – прием согласно соответствующим рекомендациям.
• Скрининг метаболического синдрома. Его наличие может повлиять на дозу ГКС, определит индивидуальный режим терапии.
• Консультирование пациента с оценкой статуса тревожности, депрессии. Приверженность длительной иммуносупрессивной терапии будет значительно выше у пациентов, хорошо информированных о целях и задачах лечения, о рисках, связанных с несоблюдением рекомендаций врача, прогрессировании заболевания. Необходимо помнить, что депрессия и тревожность у пациентов с АИГ встречаются часто и могут усиливаться на фоне терапии, особенно у подростков, в том числе и за счет ожидаемых побочных эффектов терапии. Это необходимо учитывать при выборе терапии и в случае неполного ответа на лечение.
Цель лечения АИГ – достижение полной ремиссии заболевания, прежде всего клинической и биохимической, а также остановка прогрессирования фиброза печени. Для этого необходима, как правило, длительная терапия иммунносупрессивными препаратами с возможностью отмены при достижении стойкой ремиссии заболевания.
В настоящее время принята концепция, согласно которой лечить надо всех пациентов с активным АИГ, фиброзом и циррозом печени. Воздержаться от лечения можно при спонтанной ремиссии заболевания, но необходимо помнить, что в этом случае необходим регулярный контроль – 1 раз в 3–6 месяцев. Лечение пациентов с низкой активностью заболевания и бессимптомным течением принимается индивидуально в зависимости от возраста пациента и наличия сопутствующих заболеваний, при которых длительная терапия ГКС нежелательна (рис. 4).


Препаратами первой линии для лечения аутоиммунного гепатита являются преднизолон или будесонид в комбинации с азатиоприном. Будесонид может быть использован как альтернатива преднизолону в качестве терапии 1-й линии в случае высокого риска ожидаемых побочных эффектов и низкой приверженности лечению. Однако будесонид нельзя использовать у пациентов с циррозом печени и тромбозом воротной вены, а также в случае тяжелого АИГ или развития печеночной недостаточности. Азатиоприн добавляют через 2 недели после начала лечения преднизолоном/будесонидом, если уровень билирубина не превышает 100 мкмоль/л. Существует также и альтернатива для азатиоприна – мофетила микофенолат (ММФ). Согласно последнему мета-анализу ММФ+преднизолон даже эффективнее комбинации преднизолон+азатиоприн в достижении биохимической ремиссии аутоиммунного гепатита.
Однако эксперты пока осторожны в своих рекомендациях и формально ММФ остается только в режимах 2-й линии.
Скорость биохимического ответа на лечение имеет важное прогностическое значение. Первая реакция на индукционную дозу ГКС должна быть оценена через 2 недели. Известно, что достижение полной биохимической ремиссии в течение 6 месяцев после начала лечения обладает хорошим прогностическим признаком в плане низких рисков формирования цирроза печени и потребности в ТП. Хорошим прогностическим признаком является повышенный (>2,1 ВГН) уровень ферритина до начала лечения, а плохим признаком – дефицит витамина Д. Однако не следует рекомендовать пациенту активную инсоляцию. Как мы все прекрасно помним, инсоляция – провоцирующий фактор обострения любого аутоиммунного заболевания.
Пациенты с тяжелым острым аутоиммунным гепатитом или острой печеночной недостаточностью, которые не ответили на лечение высокими дозами ГКС в течение 1–2 недель, должны быть направлены на трансплантацию печени как можно быстрее.
После достижения биохимического ответа (снижения уровня АЛТ, АСТ, IgG) доза преднизолона постепенно снижается до минимально необходимой для поддержания биохимической ремиссии. Гистологическая ремиссия всегда отстает от улучшения биохимических показателей, поэтому продолжительность лечения ГКС после биохимической ремиссии должна быть не менее 24 месяцев, а общая продолжительность – не менее 3-х лет.
Стратегия поддерживающей терапии выбирается индивидуально в зависимости от стадии поражения печени, тяжести первых проявлений, переносимости индукционной терапии, показателей плотности костной ткани, сопутствующих заболеванию, а также возраста пациента. Чаще всего выбирается стратегия монотерапии азатиоприном (или ММФ), но если есть его непереносимость, пациент фертильного возраста или необходимо уйти от его побочных эффектов, то можно остаться на минимальной поддерживающей дозе преднизолоном (как правило, 5–10 мг/сут).
Если у пациента достигнута устойчивая биохимическая ремиссия, которая длится на протяжении как минимум 2-х лет, можно попытаться отменить иммуносупрессивную терапию. Решение о проведении биопсии печени для того, чтобы убедиться в достижении гистологической ремиссии, принимается индивидуально, биопсия в данном случае не является строго обязательной (за исключением детей).
Необходимо понимать, что частота достижения безрецидивной ремиссии на протяжении не менее 3 лет у детей и взрослых составляет 19–40%. Рецидив обычно протекает бессимптомно, с умеренным повышением активности трансаминах и быстро реагирует на повторное лечение. 90% всех рецидивов происходит в первые 2 года после отмены препаратов, причем в первые 3 месяца – 50%. Основным фактором, определяющим риск рецидива, является продолжительность ремиссии до отмены лечения.
Лечение рецидива происходит по таким же принципам, как и первое лечение, и такие пациенты, как правило, хорошо реагируют на «перелечивание», но период повторного лечения должен быть более продолжительным. Чем больше рецидивов, тем выше риск цирроза печени и необходимости выполнения ее трансплантации.
Неполный ответ на лечение наблюдается примерно у 15% пациентов и характеризуется улучшением лабораторных и/или гистологических показателей, но без соответствия критериям ремиссии. Отсутствие ответа на лечение – ухудшение течения заболевания, несмотря на соблюдаемое лечение, – наблюдается у 7–9% пациентов. В этих случаях обычно рассматривается вопрос о повышении дозы ГКС и азатиоприна либо о переводе на препараты 2-й линии терапии, а в случае сильного прогрессирования заболевания – о трансплантации печени.
При неспособности продолжать лечение из-за побочных эффектов (13% случаев) рекомендовано перейти на препараты 2-й линии. К ним относится ММФ и ингибиторы кальциневрина (циклоспорин или такролимус), циклофосфамид. Другие альтернативные стратегии лечения АИГ включают назначение метотрексата, 6-тиогуанина, инфликсимаба и ритуксимаба, однако решение о назначении подобных препаратов возможно только в специализированных центрах с большим опытом ведения пациентов с АИГ.
Общая 10-летняя и 20-летняя выживаемость пациентов с аутоиммунным гепатитом, получающих лечение, составляет 91 и 70% соответственно. 10-летняя выживаемость нелеченых пациентов с легким течением заболевания составляет 67%.
Естественное течение АИГ, как и любого другого хронического заболевания печени, предполагает развитие в исходе заболевания цирроза печени или гепатоцелюллярной карциномы (ГЦК). Обязательным мероприятием диспансерного наблюдения в этой связи должно быть регулярное проведение УЗИ органов брюшной полости 1 раз в 6 месяцев.
К моменту постановки диагноза цирроз печени уже имеется у 28–33% пациентов (особенно старше 60 лет), а частота его развития у пациентов, получающих или получавших лечение, составляет от 10 до 40%.
ГЦК у пациентов с АИГ развивается преимущественно на фоне цирроза печени в 1–9% случаев. Факторами риска помимо цирроза и портальной гипертензии являются неполный ответ на лечение и иммуносупрессивная терапия более 3 лет. В 5% случаев у пациентов с АИГ могут развиться внепеченочные раки (шейки матки, лимфатической ткани, молочной железы, мочевого пузыря, мягких тканей, кожи), особенно немеланомный рак кожи. Поэтому одним из пунктов рекомендаций профессиональных сообществ является онконастороженность у этой группы больных (в соответствии с профильными рекомендациями).
25.07.2020 | 22:40:08