Ревматоидный артрит и болезнь Шегрена. Причины, клиника и лечение ревматоидного артрита и болезни Шегрена.
Раздел: Статьи
/
Общая врачебная практика.
/
Ревматология.
/
Ревматоидный артрит и болезнь Шегрена. Причины, клиника и лечение ревматоидного артрита и болезни Шегрена.
Содержание
- Введение
- Патогенетические особенности ревматоидного артрита и болезни Шегрена
- Генетические факторы патогенеза
- Эпигенетические факторы патогенеза
- Адаптивный иммунитет в патогенезе болезни Шегрена
- Иммунологические особенности сочетания ревматоидного артрита и болезни Шегрена
- Суставной синдром при ревматоидном артрите и болезни Шегрена
- Поражение глаз при болезни Шегрена и ревматоидном артрите
- Системные проявления ревматоидного артрита и болезни Шегрена
- Лимфопролиферативные осложнения ревматоидного артрита и болезни Шегрена
- Лечение ревматоидного артрита и болезни Шегрена
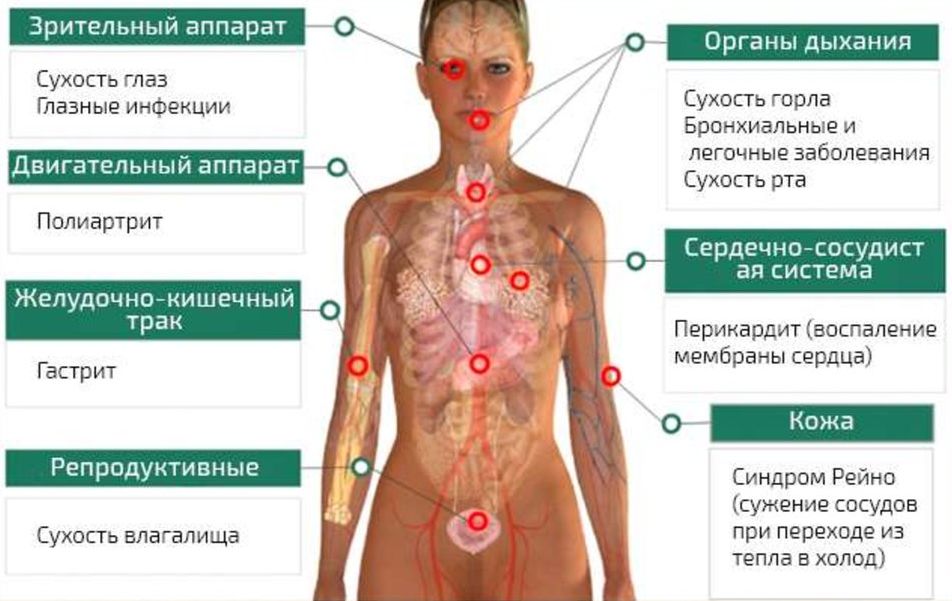
Болезнь Шегрена (БШ, сухой синдром, ксеростомия) — хроническое аутоиммунное заболевание, поражающее экзокринные железы с формированием воспалительных инфильтратов и развитием выраженной гипофункции желез в связи с их деструкцией. У третьей части пациентов развиваются системные внежелезистые проявления заболевания, такие как интерстициальное заболевание легких, поражение почек, нервной системы и, конечно, суставов.
Болезнь Шегрена часто протекает в сочетании с другими аутоиммунными заболеваниями, такими как СКВ, системная склеродермия (ССД), полимиозит и ревматоидный артрит (РА). В таких случаях исторически синдром Шегрена (сухой синдром Шегрена) принято считать вторичным. Определение «вторичный» исходно было в основном связано с временными рамками развития заболеваний. Так, в ряде исследований было показано, что БШ диагностировалась существенно позднее, чем ревматоидный артрит. При этом не принимается в расчет тот факт, что БШ длительное время может протекать субклинически и суставной синдром при РА быстрее заставит пациента обратиться за медицинской помощью, чем сухость. Кроме того, несвоевременность диагностики БШ можно объяснить ее сложностью.
Частота сочетаний болезни Шегрена с СКВ варьирует от 9 до 19%, а распространенность болезни Шегрена при ревматоидном артрите, по некоторым данным, может достигать 55%. Большой разброс частоты встречаемости БШ при аутоиммунных заболеваниях может быть обусловлен использованием различных диагностических критериев болезни Шегрена.
За последние несколько десятилетий диагностические критерии БШ претерпевали изменения. В настоящее время одними из наиболее широко принятых и цитируемых критериев являются американо-европейские классификационные критерии консенсусной группы (AECG), которые были опубликованы в 2002 г. и представляли собой пересмотр исходных критериев Европейской исследовательской группы от 1996 г.. В 2016 г. были разработаны и утверждены новые классификационные критерии ACR/EULAR.
Так называемый вторичный синдром Шегрена существенно менее изучен и часто исключается из клинических испытаний. Распространенность БШ среди пациентов с РА разных стран варьирует от 3 до 17% в зависимости от того, использовали авторы диагностические критерии БШ или постановка диагноза БШ основывалась только на клинических проявлениях сухого синдрома. Самые первые классификационные критерии БШ, сформулированные в 1965 г., позволяли верифицировать диагноз «“вторичный” синдром Шегрена» у пациентов с сухим кератоконъюнктивитом, ксеростомией, ревматоидным артритом или другим заболеванием соединительной ткани. Последние критерии «вторичного» синдрома Шегрена опубликованы в 2002 г. Европейской консенсусной группой. Примечательно, что, согласно этим критериям, ни антитела к Ro/La-антигенам, ни результаты гистологического исследования не являются обязательным условием для диагностики «вторичного» синдрома Шегрена, тогда как диагностика «первичного» синдрома Шегрена требует наличия указанных антител и соответствующих гистологических изменений. Авторы классификационных критериев ACR 2012 г. выступали за отказ от терминов «“первичный” синдром Шегрена» и «“вторичный” синдром Шегрена» и предлагали использовать одни и те же критерии для всех пациентов с БШ, в том числе в сочетании с другими системными аутоиммунными заболеваниями. При этом пациенты с СКВ, РА, ССД при разработке критериев исключались из анализа, что определяет сомнения в их надежности для диагностики «вторичного» синдрома Шегрена. Последние классификационные критерии ACR/EULAR 2016 г. при создании были полностью ориентированы на пациентов с «первичным» синдромом Шегрена, поскольку пациенты с «вторичным» синдромом Шегрена обычно не подходят для клинических испытаний и, соответственно, для них данные критерии неприменимы. Позднее в популяционных исследованиях было показано, что критерии ACR/EULAR 2016 г. могут быть использованы и для классификации вторичного синдрома Шегрена (табл. 1.1).
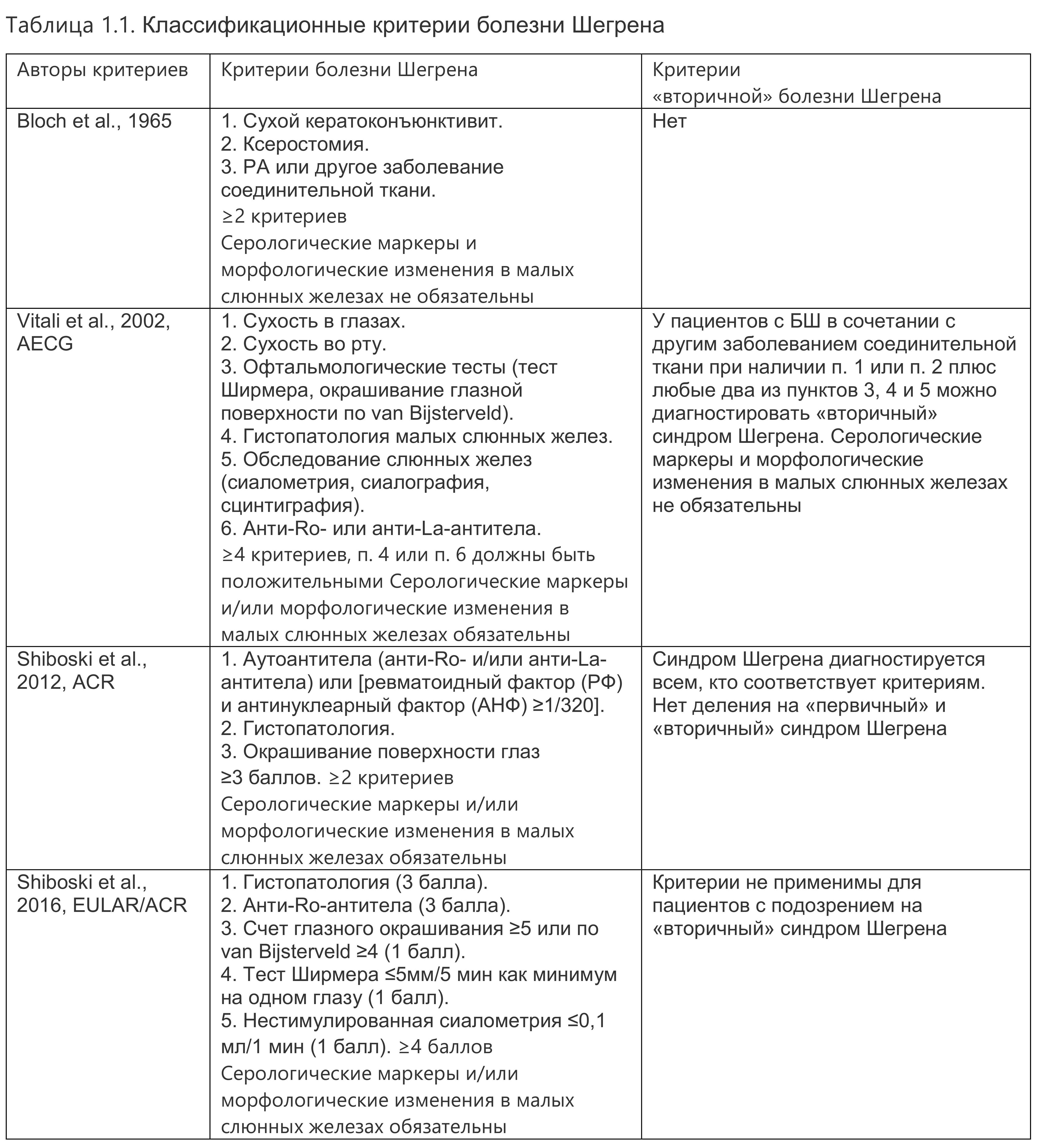
Вместе с тем критерии 2016 г. имеют ряд существенных недостатков. Во-первых, в них в качестве критерия входа используются симптомы сухого синдрома, которого на ранних стадиях и/или у молодых пациентов может не быть. Кроме того, данные критерии основаны на морфологической верификации БШ, что требует проведения морфометрии и определенной квалификации врача-гистолога. Большое значение в критериях 2016 г. имеет наличие aRo-антител у пациента. Если у пациентов с изолированной БШ aRo-антитела выявляются в 80% случаев, то у пациентов с ревматоидным артритом в сочетании с болезнью Шегрена — только в 60%. Таким образом, при использовании этих критериев велика вероятность ошибочно пропустить диагноз БШ, особенно при сочетании с другими системными аутоиммунными заболеваниями.
Таким образом, для верификации БШ пациенты с РА должны пройти дополнительное инструментальное обследование для выявления железистого поражения, типичного для БШ (сиалограмма, определение саливации, биопсия малых слюнных желез, обследование глаз с использованием витальных красителей).
Сочетание болезни Шегрена с различными аутоиммунными заболеваниями может рассматриваться в рамках полиаутоиммунитета или же в рамках overlap-синдрома. Полиаутоиммунный и множественный аутоиммунный синдром — это термины, используемые для описания наличия более чем одного аутоиммунного заболевания у одного и того же пациента. Полиаутоиммунитет характеризует сочетание несколько аутоиммунных заболеваний, одновременно возникших у пациента, в то время как множественный аутоиммунный синдром — трех и более.
Основное различие между полиаутоиммунными синдромами и overlap-синдромом заключается в том, что первый представляет собой наличие двух четко определенных аутоиммунных заболеваний или более, соответствующих утвержденным классификационным критериям, тогда как последний представляет собой частичное присутствие признаков и симптомов различных аутоиммунных заболеваний. При полиаутоиммунных состояниях существует отставание во временном интервале между первым и вторым аутоиммунным заболеванием. Подобная особенность характерна и для overlap-синдромов. Например, при смешанном заболевании соединительной ткани, классическом перекрестном синдроме, у 40% пациентов со временем развивается СКВ, ССД или РА, а у 60% больных заболевание так и будет протекать как смешанное заболевание соединительной ткани.
Amador-Patarroyo et al., проанализировав когорту из 410 пациентов с БШ, наблюдали проявления полиаутоиммунитета в 32,6% случаев. Наиболее частыми сопутствующими заболеваниями были аутоиммунный тиреоидит (21,5%), РА (8,3%), СКВ (7,6%) и воспалительное заболевание кишечника (0,7%). Множественный аутоиммунный синдром наблюдался у 8,5% пациентов. Аналогичные результаты были получены M.N. Lazarus et al.. Следовательно, пациенты с БШ должны регулярно обследоваться на наличие других аутоиммунных заболеваний.
Доподлинно неизвестно, существует ли зависимость между длительностью течения РА и частотой развития сопутствующей БШ. По данным A. Young et al., у пациентов с РА исходная частота синдрома Шегрена (СШ) составляла 4%, а при длительности заболевания 10 лет — уже 12%. По результатам других исследований частота развития СШ не имела никакой взаимосвязи с длительностью или активностью РА. Только в 10% случаев сочетание РА и БШ впервые манифестирует с проявлений БШ. Однако при анализе подобных данных важно принимать во внимание длительное субклиническое течение болезни Шегрена.
До сих пор некоторые исследователи считают БШ внесуставным проявлением РА, несмотря на то что различия в генетических и эпигенетических патогенетических факторах хорошо известны.
- Генетические факторы патогенеза
Для поддержания определения «вторичности» БШ при РА использовались генетические различия между БШ и РА/БШ. Наследственный фактор имеет определяющее значение в развитии РА в 53–60% случаев. Согласно некоторым данным, БШ при РА возникает на особом генетическом фоне (HLA DR4). Кроме того, у представителей европеоидной расы с БШ по сравнению с пациентами с сочетанием БШ и РА отмечалась более высокая распространенность HLA-B8, HLA-DR3 и HLA-Dw2. Было обнаружено, что аллель HLA-DRB1*04 определяет риск РА позитивного по антителам к циклическому цитруллинированному пептиду (АЦЦП), а HLADRB1*03 связан с позитивностью по анти-SSA, анти-SSB при БШ. Авторы делают вывод, что БШ в сочетании с РА имеет другой патогенез, чем БШ в сочетании с волчанкой или склеродермией. При этом некоторые гены, участвующие в передаче сигналов интерферона I типа, такие как преобразователь сигнала и активатор транскрипции 4 (STAT4), играют важную роль в патогенезе как РА, так и БШ. В одном из исследований пациентам с сочетанием БШ и РА выполнялось секвенирование всего экзома, и были идентифицированы новые и редкие мутации, среди которых наиболее важными для развития полиаутоиммунитета считались те мутации, которые содержались в локусе LRP1/STAT6. Мутация LRP1/STAT6 вовлечена во внеклеточные и внутриклеточные противовоспалительные пути, которые играют ключевую роль в поддержании гомеостаза иммунной системы.
- Эпигенетические факторы патогенеза
Наиболее изученная эпигенетическая особенность, встречающаяся как при РА, так и при БШ, — снижение метилирования ДНК в интерферон-индуцированных генах. Кроме того, большое внимание исследователей привлекли микроРНК, эндогенные одноцепочечные некодирующие РНК, составляющие примерно 22 нуклеотида в длину, считающиеся регуляторами иммунитета. Было обнаружено участие сверхэкспрессии микроРНК 146a в патогенезе РА и БШ.
- Адаптивный иммунитет в патогенезе болезни Шегрена
Хорошо известно, что нарушение регуляции Т-клеток играет важную роль в патогенезе РА. Доказано также влияние CD4+ Т-лимфоцитов на развитие БШ, при которой избыточно активированные Т-лимфоциты облегчают активацию В-лимфоцитов.
Принято считать В-лимфоциты центральным звеном патогенеза БШ. При БШ избыточный уровень фактора активации В-лимфоцитов (BAFF) способствует аккумуляции аутореактивных В-лимфоцитов в пораженных органах. Роль В-клеток при РА в основном ограничена продукцией аутоантител к цитруллинированным пептидам и РФ. Было показано, что повышение концентрации BAFF коррелировало с уровнем РФ и АЦЦП и рентгенологической прогрессией ревматоидного артрита.
Ревматоидный фактор (РФ) и антитела к цитруллинированному белку (АЦЦП) — серологические маркеры, входящие в классификационные критерии РА. До 75% пациентов с РА позитивны по ревматоидному фактору (РФ). Однако этот маркер обладает недостаточной специфичностью и может встречаться при других аутоиммунных заболеваниях, в частности, 60–70% пациентов c БШ также позитивны по РФ. Таким образом, определение РФ не позволяет дифференцировать пациентов с РА. АЦЦП — высокоспецифичный маркер ревматоидного артрита. Наличие данных антител у здоровых доноров является прогностическим маркером РА и может наблюдаться за много лет до появления первых симптомов ревматоидного артрита.
Позитивность по АЦЦП встречается примерно у 10% пациентов с БШ, в том числе у серонегативных по РФ и не имеющих артрита. Наблюдение в течение 5 лет АЦЦП-позитивных пациентов с БШ показало, что почти у половины из них развивается РА, особенно при повышении белков острой фазы. По данным N. Iwamoto et al., АЦЦП выявлялись у 21% пациентов с БШ и артритом и ни у одного пациента без артрита. Примечательно, что АЦЦП были обнаружены у 71% пациентов с сочетанием БШ и РА и только у 6% пациентов с изолированной БШ и суставным синдромом. Несмотря на наличие АЦЦП-антител, у большинства пациентов с БШ эрозивный процесс не формируется, однако примерно треть пациентов с БШ, имеющих АЦЦП, эволюционируют в истинный ревматоидный артрит.
Анти-Ro- и анти-La-антитела — наиболее специфические для БШ серологические маркеры. Высокий титр данных антител наблюдается у 82% пациентов при изолированной БШ, тогда как при сочетании РА и БШ анти-Ro- и анти-La-антитела определяются существенно реже, только в 12–60% случаев.
Антинуклеарный фактор (АНФ) — важный серологический маркер аутоиммунных заболеваний. При этом 20–30% здоровой популяции также имеют повышенный уровень АНФ.
Роль положительного результата АНФ в диагностике и лечении ревматоидного артрита неясна. В существующей клинической практике анализ АНФ не используют в качестве скрининга. Распространенность АНФ в популяции пациентов с РА может доходить до 75%, однако высокие титры встречаются гораздо реже (около 47%). При этом наличие АНФ не во всех случаях определяет сопутствующий синдром Шегрена. Некоторым пациентам с РА и АНФ так и не удается диагностировать БШ согласно общепринятым критериям.
Интерес к определению уровней АНФ при РА связан в том числе с возможностью развития волчаночно-подобного синдрома у пациентов с РА, позитивных по АНФ на фоне терапии ингибиторами ФНО-α. Кроме того, пациенты с РФ при наличии АНФ, по некоторым данным, хуже отвечают на терапию ингибиторами ФНО-α. В работе Paknikar et al. было показано, что у пациентов, серопозитивных по АНФ, период времени между первыми проявлениями и полным соответствием критериям ревматоидного артрита дольше, и соответственно дольше период времени до назначения первого базисного противовоспалительного препарата. В качестве первого базисного противовоспалительного препарата (БПВП) пациенты с ревматоидным артритом и АНФ чаще получали гидроксихлорохин, чем метотрексат. Этот факт можно объяснить тем, что такие пациенты классифицировались как имеющие системное аутоиммунное заболевание, а гидроксихлорохин — общепринятый препарат первой линии при СКВ и БШ.
Суставные проявления часто наблюдаются при изолированной БШ, их распространенность варьирует от 30 до 70%. Наиболее часто отмечаются артралгии, артриты развиваются только у 15–25% пациентов. Как правило, это acимметричный, нестойкий полиартрит, но в ряде случаев поражение суставов по клиническим проявлениям схоже с РА, однако отсутствие эрозивного поражения, суставной деструкции помогает дифференцировать генез суставного синдрома.
Попытки определить особенности течения заболеваний у пациентов с изолированным РА и при сочетании ревматоидного артрита и болезни Шегрена не всегда приводят к однозначным результатам. По некоторым данным, сочетание РА и БШ приводит к подавлению деструктивного процесса в суставах, стиханию суставных проявлений и превалированию со временем у этих больных симптоматики БШ.
По мнению других исследователей, сочетание РА и БШ характеризуется более тяжелым поражением суставов, более высокой частотой экстраартикулярных проявлений, таких как анемия и поражение легких, а также высоким риском развития неходжкинских лимфом, чем у пациентов, страдающих только РА.
Здесь стоит отметить сложность в дифференцировке суставного синдрома у пациентов с БШ и РА. Хорошо известно, что у 1/3 пациентов с БШ отмечается синовит, клинически схожий с синовитом при РА. Особенностью течения БШ является отсутствие формирования эрозий даже в ходе длительного наблюдении, а также нормальные значения СРБ в большинстве случаев. У пациентов с БШ и суставными проявлениями чаще отмечается более высокий балл по шкале ESSDAI, а также значительное увеличение лимфатических узлов, что может быть признаком хронической активации B-клеток.
Ревматоидный артрит часто сочетается как с истинной болезнью Шегрена, так и с отдельными симптомами, характерными для нее при отсутствии полного соответствия диагностическим критериям. У пациентов с РА могут наблюдаться признаки сухости глаз независимо от наличия БШ или другого сопутствующего заболевания. Было высказано предположение, что причиной сухости глаз у больных ревматоидным артритом может быть местная патология, воздействующая на конъюнктиву, роговицу или состав и количество слезной жидкости, а не сочетание с БШ. По имеющимся данным, и при изолированном РА нередко поражается поверхность глазного яблока.
Наиболее частый вариант поражения глаз при РА, хотя не самый тяжелый, — сухой кератоконъюнктивит. Если распространенность синдрома сухого глаза при РА может составлять до 90%, то сочетание РА с истинной БШ наблюдается только у 11–31% пациентов. При этом, по некоторым данным, существуют глубокие этиопатогенетические различия между сухим кератоконъюнктивитом при РА и при БШ. В одной из работ использование конфокальной микроскопии позволило исследовать структуру роговицы in vivo у пациентов с РА с сопутствующей БШ и без нее. У пациентов обеих групп с РА центральная роговица и толщина стромы были значительно тоньше, чем у здоровой контрольной группы. Эти же изменения характерны для всех пациентов с системной склеродермией (ССК). Истончение роговицы может происходить за счет увеличения апоптотических и протеолитических процессов в ее строме. Кроме того, это истончение роговицы может быть результатом увеличения трения на поверхности эпителия и нарушения регулярности расположения клеток эпителия роговицы. У пациентов обеих групп отмечалась одинаковая плотность поверхностных и базальных эпителиальных клеток, а также передних и задних стромальных клеток при значительном повышении количества гиперрефлексивных стромальных клеток, находящихся на определенной стадии метаболической активации, индуцированной провоспалительными цитокинами, такими как ИЛ-1 и ИЛ-6, чем у пациентов в контрольной группе. По мнению J.M. Benitez del Castillo et al., эти кератоциты играют ключевую роль в воспалительном процессе, связанном с сухостью глаз. Активированные кератоциты, по-видимому, способны продуцировать фактор роста нервов, тем самым внося соответствующий вклад в процессы активации и реорганизации нервных волокон суббазального сплетения. В обеих группах у больных РА нервные волокна имели повышенную извитость и большее количество утолщений по типу четок, что может быть признаком метаболической активации сплетения. Таким образом, при различных аутоиммунных вариантах сухого кератоконъюнктивита наблюдаются одни и те же виды воспалительных, нейродегенеративных и регенеративных изменений, отличающихся только лишь интенсивностью.
Еще один тяжелый вариант поражения глаз, встречающийся при РА как при наличии сопутствующей БШ, так и без нее, — язвенный кератит. Распространенность данного осложнения снизилась с активным использованием ГИБП и составляет около 3%.
Развитие язвенного кератита сопровождается болезненностью и покраснением глаз, слезотечением и нечеткостью зрения. По локализации язв выделяют периферический язвенный кератит и центральный язвенный кератит. Периферический язвенный кератит в 39% случаев развивается как осложнение склерита, является двусторонним в 40% случаев, часто ассоциируется с системным васкулитом. У трети пациентов кератит осложняет хирургические вмешательства на глазах, например по замене хрусталика. Продолжительность РА до развития кератита составляет в среднем 20 лет. В таких случаях проводится усиление иммуносупрессивной терапии с использованием глюкокортикоидов и ГИБП. Центральный язвенный кератит может развиваться как при сочетании РА с БШ, так и при изолированном РА. Важно помнить о возможности развития герпетической и бактериальной инфекции как осложнений кератита, что существенно утяжеляет и без того плохой прогноз заболевания. Воспаление в строме роговицы приводит к потере остроты зрения в течение нескольких дней. Риск развития перфорации достигает 60%, трансплантация роговицы часто осложняется реакцией отторжения, особенно при недостаточной иммуносупрессивной терапии РА.
Таким образом, поражение глаз при РФ, БШ и при сочетании этих заболеваний определяет тяжесть состояния и потребность в более интенсивной терапии.
Первоначальные исследования клинического фенотипа пациентов с БШ и с сочетанием РА и БШ (РА/БШ) показали, что при БШ выше частота рецидивирующих паротитов, синдрома Рейно, пурпуры, лимфаденопатии, миозита и поражения почек. В современных исследованиях частота развития лимфаденопатии, поражения почек и синдрома Рейно не отличалась между группами пациентов с БШ и РА/БШ, тогда как пурпура, паротиты по-прежнему чаще встречались при изолированной БШ, а вот ИБЛ — при сочетании РА и БШ.
В работе J. He et al. проанализированы особенности клинических проявлений при сочетании РА и БШ и при изолированных РА и БШ. У пациентов РА/БШ отмечалась более высокая частота развития гематологических изменений, лихорадки и пурпуры, чем при РА. По сравнению с изолированной БШ пациенты с РА/БШ были старше, отличались более высокой частотой анемии и поражения легких. Лихорадка, поражение кожи, лейкопения, тромбоцитопения, гипертиреоидизм чаще встречались при изолированной БШ, чем при сочетании РА и БШ. При изолированном РА лейкопения и тромбоцитопения встречаются редко и связаны в основном с токсическим действием лекарственных препаратов. Частота аутоиммунных поражений печени при РА/БШ была выше, чем при РА, но ниже, чем при БШ. Частота поражения почек у РА/БШ выше, чем при РА. Интерстициальное заболевание легких у пациентов с РА/БШ отмечается чаще, чем при изолированных БШ или РА. Интересно, что среди вариантов интерстициального поражения легких при БШ чаще встречается неспецифическая интерстициальная пневмония, в то время как при РА — обыкновенная интерстициальная пневмония. При анализе группы пациентов с РА/БШ во всех случаях паттерн интерстициального поражения легких соответствовал неспецифической интерстициальной пневмонии, в связи с чем был сделан вывод, что при сочетании этих заболеваний интерстициальное поражение легких развивается именно в рамках системной активности БШ, а не РА. Важно помнить, что обычная интерстициальная пневмония хуже отвечает на иммуносупрессивную терапию, может приобретать необратимое течение и характеризуется неблагоприятным прогнозом.
Представленные данные подтверждают, что сочетание РА и БШ характеризуется особым клиническим фенотипом, который требует несколько иных терапевтических подходов в связи с высокой частотой системных проявлений.
Риск развития лимфопролиферативных заболеваний (ЛПЗ) при болезни Шегрена повышен многократно. В исследовании Smedby et al. были проанализированы данные более чем 12 тыс. пациентов с неходжкинскими лимфомами и их взаимосвязь с различными аутоиммунными заболеваниями. Было обнаружено более чем 250-кратное увеличение риска неходжкинских лимфом околоушных слюнных желез и 1000-кратное увеличение риска развития лимфомы околоушной железы MALT-типа при БШ. Наблюдалась также высокая частота встречаемости В-крупноклеточных лимфом и нодальных лимфом. Важно, что на риск развития лимфом не влияла получаемая пациентом терапия БШ (ГК и иммуносупрессивные препараты, исследование было выполнено до начала активного использования анти-В-клеточной терапии при БШ). В то же время в этой работе не было обнаружено повышения риска неходжкинских лимфом у пациентов с РА. При этом в других исследованиях риск развития ЛПЗ у пациентов с РА повышен в 2,5–5,0 раз. Очевидно, что оценки риска значительно различаются между исследованиями. При этом важно отметить, что в более ранних и небольших исследованиях оценка риска более высокая по сравнению с более крупными, популяционными исследованиями. Это может быть связано с точностью постановки диагноза и упущением сопутствующего синдрома Шегрена при ревматоидном артрите, в большей степени определяющего риск развития В-клеточных лимфом.
Неудивительно, что и при сочетании РА с БШ частота лимфопролиферативных осложнений увеличена. Работы, где отдельно оценивались пациенты с БШ и РА и сочетанием этих заболеваний, единичны. Так, например, в исследовании M. Kauppi et al. проанализирован риск ЛПЗ по данным национального регистра Финляндии. Стандартизированный коэффициент заболеваемости для неходжкинских лимфом составил 2,2 у пациентов с РА, 4,5 — у пациентов с синдромом Шегрена в сочетании с другими заболеваниями, в основном с РА, 8,7 — для изолированной БШ. По всей вероятности, В-клеточная гиперактивность, лежащая в основе патогенеза, определяет и увеличивает риск развития лимфопролиферации в группах пациентов с БШ.
Концепция Treat to target (лечение до достижения цели), внедренная в клиническую практику с 2010 г., существенно изменила стандарты оказания помощи пациентам с РА и позволила улучшить прогноз заболевания. В этой программе большое внимание уделяется факторам, влияющим на эффективность лечения, таким как возраст, пол, продолжительность болезни, позитивность по РФ и АЦЦП, исходный уровень активности заболевания. Известны работы, в которых оценивается влияние сопутствующей БШ на выбор терапевтического подхода при РА. Так, в исследовании H. Zhang et al. было показано, что сочетание РА и БШ снижает вероятность достижения ремиссии или низкой активности РА в 20–30% случаев независимо от возраста, статуса РФ и АЦЦП и DAS28-СРБ при первом посещении. При этом сочетание с БШ имело более существенное значение у пациентов с развернутой стадией РА по сравнению с пациентами с ранним РА. Использование индексов активности, включающих оценку СОЭ у пациентов с сочетанием РА и БШ, имеет большую погрешность в оценке активности РА, поскольку высокая СОЭ у таких пациентов в большей степени связана с активностью БШ и гипергаммаглобулинемией.
При увеличении количества иммуносупрессивных препаратов в ревматологической практике особое значение стала иметь оценка риска развития ЛПЗ на фоне их приема, и в научное обращение был введен термин «ятрогенное иммунодефицит-ассоциированное ЛПЗ». Крайне важным остается вопрос влияния как непосредственно активности заболевания, так и иммуносупрессивной терапии РА на риски развития лимфом и их исходы.
Метотрексат — БПВП первой линии для лечения РА. Эффективности метотрексата при БШ посвящено одно открытое исследование, в котором приняли участие 17 пациентов. По результатам данного исследования ни на железистые функции, ни на показатели воспалительной активности (СОЭ, IgG) при БШ терапия метотрексатом не влияла.
В 4-й редакции классификации ВОЗ отдельно выделено ятрогенное метотрексат-ассоциированное лимфопролиферативное расстройство (МАЛР). Наиболее часто это состояние развивается у пациентов с РА, получающих длительно низкие дозы метотрексата.
Патогенез метотрексат-ассоциированного лимфопролиферативного расстройства до конца не ясен, есть сообщения об ассоциации данного состояния с вирусом Эпштейна–Барр, что подтверждается высокой частотой обнаружения вируса Эпштейна–Барр при иммуногистохимическом исследовании и купированием ЛПЗ на фоне отмены метотрексата. Согласно данным крупных международных исследований ЛПЗ, развившиеся на фоне приема метотрексата, представлены в основном В-клеточными лимфомами, лимфомами Ходжкина, редко, до 8%, встречаются Т-клеточные ЛПЗ. Метотрексат-ассоциированные лимфопролиферативные расстройства могут быть как нодальные, так и экстранодальные с частым поражением околоушных и поднижнечелюстных слюнных желез. Продолжительность приема метотрексата до развития ЛПЗ широко варьирует и составляет в среднем около 4 лет.
По некоторым данным, прием глюкокортикоидов и иммуносупрессивных препаратов также ассоциировался с некоторым повышением риска развития лимфом. Однако в систематическом обзоре литературы не было выявлено значимой взаимосвязи приема метотрексата и азатиоприна с риском развития лимфопролиферации. Вместе с тем существуют обоснованные опасения, что ингибиторы ФНО-α могут повышать риск неходжкинских лимфом при ревматоидном артрите. Повышение риска лимфом было показано, например, в метаанализе, посвященном терапии ингибиторами ФНО-α, такими как инфликсимаб и адалимумаб. Однако включение в него разнородных исследований с короткими периодами наблюдения ограничивало интерпретацию полученных результатов. При этом проспективное французское исследование, посвященное анализу риска лимфомы у пациентов, получающих терапию ингибиторами ФНО-α по поводу различных аутоиммунных заболеваний, показало повышенный риск лимфом в 2–3 раза по сравнению со здоровой популяцией. Однако при сравнении с пациентами с такими же аутоиммунными заболеваниями, но не получающими терапии ингибиторами ФНО-α, повышения риска развития лимфом уже не отмечалось. Это может определять большее значение конкретной нозологии, а не терапии ингибиторами ФНО для развития лимфопролиферативных осложнений. В этом отношении представляют интерес данные объединенных шведских регистров с суммарным количеством больных РА более 70 тыс.. Пациенты были разделены на две группы. Первая группа получала различные варианты ГИБП, вторая — только синтетические БПВП. Риск развития лимфом не отличался между группами и возрастал на 50% при сравнении каждой группы с общей популяцией. Риск лимфом не менялся в зависимости от пола, возраста или же длительности терапии ГИБП. Некоторое нарастание частоты развития лимфом в первые годы терапии ГИБП нивелировалось значительным снижением после 5 лет терапии. При сравнении пациентов, получающих инфликсимаб, адалимумаб или этанерцепт, риск ЛПЗ также существенно не менялся. Крайне низким он был у пациентов, получавших цертолизумаба пэгол или голимумаб, а минимальным — у больных, получавших терапию ритуксимабом. Ритуксимаб является одним из основных препаратов для лечения В-клеточных лимфом. Отсутствие нарастания риска лимфом на фоне его применения отмечено также при анализе общеевропейского регистра.
Таким образом, риск лимфом при БШ наиболее высокий среди всех ревматических заболеваний и достигает 1000-кратного увеличения, в то же время при изолированном РА он повышен не так значительно. Если при изолированном РА терапия ингибиторами ФНО-α его увеличивает несущественно, есть большой риск, что при сочетании РА с БШ, имеющей иной патогенез, связанный с В-клеточной гиперактивностью, назначение ингибиторов ФНО-α будет потенцировать развитие лимфопролиферации. Кроме того, традиционное для терапии РА сочетание метотрексата и ингибиторов ФНО-α, даже купирующее активность РА, не сдерживает прогрессию БШ и не препятствует развитию лимфопролиферативных осложнений. На фоне приема метотрексата и ингибиторов ФНО-α мы неоднократно наблюдали развитие лимфом у пациентов с РА и БШ. Существует также риск трансформации относительно доброкачественно протекающей MALT-лимфомы маргинальной зоны в B-крупноклеточную лимфому, имеющую существенно более неблагоприятный прогноз.
Развитие у пациентов с сочетанием ревматоидного артрита с болезнью Шегрена стойкого увеличения больших слюнных желез, лимфаденопатии, спленомегалии, нейтропении, моноклональной секреции требует тщательного дообследования для исключения ЛПЗ. Стоит отметить, что при БШ с РА несколько чаще поражаются поднижнечелюстные железы, тогда как при изолированной БШ — околоушные. Проведение пункционных биопсий не позволяет достоверно исключить развитие лимфомы слюнных желез и не рекомендуется у таких пациентов.
Таким образом, наличие сопутствующей БШ при РА вносит дополнительные риски неблагоприятного течения заболевания с высокой частотой развития тяжелого поражения глаз, системных проявлений и лимфопролиферативных осложнений. Общепринятая в течение многих лет «вторичность» БШ в таких случаях ведет к недооценке этих рисков. В последние годы понятие «вторичный синдром Шегрена» подвергается критике ученых. Внесение в номенклатуру диагноза формулировки «РА в сочетании с БШ» подчеркивает равные позиции этих заболеваний и необходимость учитывать БШ при назначении терапии. Учитывая патогенетическую обоснованность анти-В-клеточной терапии при БШ и ее высокую эффективность при РА, при сочетании данных заболеваний своевременное назначение анти-В-клеточной терапии не только замедлит прогрессирование дисфункции желез, но и позволит избежать развития тяжелых системных и лимфопролиферативных осложнений.
24.02.2023 | 12:26:48