Беременность и сахарный диабет. Влияние беременности на течение сахарного диабета. Диабетическая нефропатия, диабетическая ретинопатия при беременности.
Раздел: Статьи
/
Общая врачебная практика.
/
Эндокринология.
/
Беременность и сахарный диабет. Влияние беременности на течение сахарного диабета. Диабетическая нефропатия, диабетическая ретинопатия при беременности.
Содержание
- Введение
- Диабетическая нефропатия при беременности
- Диабетическая ретинопатия при беременности
- Заключение

Вероятность гипогликемических состояний значительно увеличивается в период физиологического снижения потребности в инсулине. С другой стороны, развитие раннего токсикоза и связанное с ним уменьшение потребления пищи также увеличивают риск гипогликемии. Во время беременности чаще фиксируются бессимптомные гипогликемические состояния, профилактика которых сводится к более частому измерению уровня глюкозы в крови (не менее 7–8 раз в сутки), постоянному мониторированию глюкозы в межклеточной жидкости, особенно в периоды изменения инсулинопотребности с целью своевременной коррекции инсулинотерапии. Постоянная подкожная инфузия инсулина (ППИИ) также помогает снизить частоту и выраженность гипогликемических состояний во время беременности в связи с гибким режимом дозирования инсулина. Во время беременности у пациенток с СД 1-го типа возрастает риск ДКА вследствие феномена «ускоренного голодания», возрастающего липолиза и неадекватной коррекции доз инсулина в периоды резкого изменения инсулинопотребности. Во время беременности ДКА может развиться стремительно в течение нескольких часов на фоне относительно невысокой гипергликемии (при гликемии 10,0 ммоль/л и выше) и стать причиной антенатальной гибели плода. Беременные с СД 2-го ти¬па имеют невысокий риск развития ДКА. «Голодный кетоз», сопровождающий «жесткие» рестриктивные диеты с резким ограничением медленноусваиваемых углеводов, может привести к поражению мозга плода и развитию у ребенка психомоторных нарушений в будущем.
Во время беременности происходят значительные гемодинамические изменения, приводящие к увеличению частоты сердечных сокращений (ЧСС), минутного объема и сердечного выброса, увеличению объема циркулирующей крови и скорости клубочковой фильтрации (СКФ) на 40–60%, возрастанию диастолического артериального давления (ДАД). Наиболее частым осложнением беременности у больных СД является преэклампсия, в патогенезе которой важную роль играют нарушения микроциркуляции. Все это может способствовать прогрессированию мик¬рососудистых диабетических осложнений — диабетической нефропатии (ДН) и диабетической ретинопатии (ДР). Кроме того, дислипидемия и гипертензивные нарушения, часто присоединяющиеся во второй половине беременности, ухудшают функцию почек и состояние глазного дна.
Диабетическая нефропатия — один из основных факторов, препятствующих наступлению и успешному течению беременности при СД, как за счет рисков для здоровья матери, так и плода. Диабетическая нефропатия (ДН) встречается у 5,9–26% беременных с ГСД. В Дании распространенность ДН в стадии протеинурии среди беременных с СД 1-го типа составила 2,5%, микроальбуминурия была выявлена у 3,4%. В крупном британском исследовании (более 750 участников) микроальбуминурия встречалась у 4,5%, протеинурия — у 1,9% беременных с СД 1-го типа. P. Ekbom и соавт. зафиксировали ДН у 16% беременных с СД 1-го типа, из них микроальбуминурия была выявлена в 11% случаев, протеинурия — в 5% случаев. В России распространенность ДН среди женщин репродуктивного возраста составила 26,1%, из них у 14,9% имела место микроальбуминурия и у 11,2% — протеинурия. В исследовании M.M. Klemetti и соавт. частота выявления протеинурии среди беременных снизилась с 14,7% в 1988–1999 гг. до 6,5% в 2000–2011 гг.. Вероятно, снижение частоты ДН среди беременных объясняется более «жестким» контролем гликемии и артериальной гипертензии (АГ) до наступления беременности, а также своевременным назначением препаратов, блокирующих ренин-ангиотензин-альдостероновую систему (РААС). Данные о влиянии беременности на течение ДН ограничены. Беременность, вероятно, не повышает риск развития ДН у женщин без патологии почек. Однако в ретроспективном исследовании G. Biesenbach и соавт. было выявлено, что у женщин с СД 1-го типа без патологии почек, но c развившейся преэклампсией, чаще формировалась ДН в течение 11 лет наблюдения, чем у женщин с неосложненным течением беременности.
Большинство исследователей отмечают временное ухудшение почечной функции во время беременности у женщин с начальными проявлениями ДН, однако после родоразрешения уровень креатинина в крови и протеинурии возвращался к исходным значениям. В исследовании DCCT (Исследование по борьбе с диабетическими осложнениями, Diabetes Complications Control Tria) более 90% беременных имели суточную потерю альбумина в пределах нормальных значений, при этом максимальный уровень альбуминурии в группе интенсивной терапии инсулином был достигнут к III триместру беременности (ОР 1,59; p = 0,02), а через год после родов уже практически не отличался от исходного (ОР 1,18; p = 0,02). Н.В. Боровик и соавт. отмечали увеличение суточной протеинурии у 20% женщин с СД 1-го типа в III триместре беременности. Усиление выраженности протеинурии наблюдалось преимущественно у больных с исходной ДН (у 50% больных с микроальбуминурией и у 53,3% больных с протеинурией до беременности). При обследовании функции почек через 6 мес после родов различий в динамике микроальбуминурии, суточной протеинурии, уровня креатинина в крови и СКФ выявлено не было (p >0,05). В отдаленной перспективе при оценке функции почек также не было различий у женщин с микроальбуминурией, имевших и не имевших беременности в анамнезе.
У женщин с выраженной диабетической нефропатией прогноз менее благоприятный. Протеинурия прогрессирует в течение беременности и к концу III триместра более 70% женщин с ДН в стадии протеинурии достигают потери белка более 3 г/сут. В исследовании М. Gordon и соавт. у женщин с СД 1-го типа и ДН (СКФ менее 90 мл/мин и/или протеинурия более 1 г/сут) в I триместре беременности отмечалось прогрессирование ДН после родов. В работе М.М. Klemetti и соавт. суточная протеинурия у женщин с ДН до беременности составляла 0,80 (0,34–4,03), прогрессивно нарастала со сроком беременности и достигала к III триместру высоких значений — 4,22 г/сут (0,45–19,80). Предполагается, что ДН имеет более неблагоприятное течение на фоне беременности в сравнении с другими формами нефропатии, при которых ухудшение почечной функции после родов ассоциировано со снижением СКФ <40 мл/мин и протеинурией более 1 г/сут.
Данных о влиянии беременности на развитие терминальной почечной недостаточности в литературе крайне мало. Большинство исследований проводилось в 1980–1990-х годах на небольшой выборке пациентов и в условиях других подходов к терапии СД и технических возможностей контроля гликемии. В работах G. Biesenbach и соавт. и L.P. Purdy и соавт. были получены неутешительные результаты о быстром прогрессировании ХБП у женщин с выраженной ДН во время беременности. При наблюдении за пятью пациентками с ДН (за 3 мес до зачатия СКФ 37–75 мл/мин, протеинурия 2,1–4,0 г/сут), у всех женщин потребовалось проведение диализа в течение 42 мес после родов. Согласно результатам другого исследования из США, в которое вошли 11 пациенток с уровнем креатинина >124 мкмоль/л в начале беременности, семи потребовалось начать терапию диализом в течение 27±16,4 мес наблюдения после родов, при этом у двух из них функция почек во время беременности оставалась стабильной. Другие исследователи получили более благоприятные результаты. A.D. Mackie и соавт. разделили 22 беременных с СД 1-го типа и ДН на две группы. В первую группу вошло 10 пациенток с уровнем креатинина в крови >125 мкмоль/л, во вторую — 12 пациенток с протеинурией, но сохранной функцией почек. Должная компенсация углеводного обмена в обеих группах отсутствовала: уровень гликированного гемоглобина (HbA1C) составлял 12,6% (8–16%) и 10,6% (7,4–16,4%) соответственно). Беременность была прервана при сроке до 20 нед у четырех женщин из первой группы (три самопроизвольных выкидыша и одно искусственное прерывание беременности в связи с множественными пороками развития) и у одной женщины из второй группы (искусственное прерывание беременности в связи с множественными пороками развития). Среди оставшихся шести женщин из первой группы трем потребовалась терапия гемодиализом в течение 0,5–8 лет наблюдения после родов, тогда как во второй группе гемодиализ был применен только к одной пациентке. По данным М. Gordon и соавт. у семи женщин с уровнем СКФ 60–90 мл/мин (76±8 мл/мин) и у четырех женщин с уровнем СКФ <60 мл/мин (35±12 мл/мин) в первой половине беременности, после ее завершения уровень СКФ составил 68±27 и 14±8 мл/мин. Трем пациенткам с изначальным уровнем СКФ <60 мл/мин потребовалась терапия диализом и пересадка почки через 8, 15 и 41 мес после родов. Компенсация гликемии на прегравидарном этапе и во время беременности в данном исследовании не оценивалась. В Дании не было получено различий в отдаленных исходах (наблюдение в течение 3–28 лет) у женщин с СД 1-го типа и ДН, имевших и не имевших в анамнезе беременность. Все пациентки получали антигипертензивную терапию, целевыми значениями считались цифры АД <140/90 мм рт.ст. В течение наблюдения 35% женщин, имевших беременность, умерли, а 19% достигли терминальной стадии почечной недостаточности, по сравнению с 34 и 24% соответственно во второй группе (р >0,05). В более позднем исследовании G.B. PiccolI и соавт. из 12 беременных с СД и ДН в I триместре беременности СКФ <60 мл/мин наблюдалась у трех, а в III триместре — у пяти женщин. Терминальная почечная недостаточность развилась у двух пациенток через 1 и через 3 года соответственно.
Женщины с СД 1-го типа и тяжелой ДН имеют значительный риск заболеваемости и смертности в отдаленной перспективе, что также необходимо иметь в виду и обсуждать в контексте возможного материнства. По данным двух различных исследований, 35% (9/25) и 16% (12/108) женщин с СД 1-го типа и ДН в стадии протеинурии умерли в течение 16 и 25 лет наблюдения соответственно.
Известно, что блокаторы РААС положительно влияют на клубочковую фильтрацию благодаря снижению внутриклубочкового давления за счет расширения выносящей артериолы. Однако терапия блокаторами РААС во время беременности сопряжена с тератогенными эффектами. В исследовании W.O. Cooper и соавт. были обследованы 29 507 детей от матерей без СД: 209 женщин получали терапию ингибиторами ангиотензин-превращающего фермента (иАПФ) в I триместре, 202 женщины принимали другие антигипертензивные препараты, группа контроля составила 29 096 человек. При терапии иАПФ в I триместре у новорожденных был больший риск врожденных пороков развития (ВПР) в сравнении с отсутствием антигипертензивной терапии [ОР 2,71; 95% доверительный интервал (ДИ) 1,72–4,27]. Применение других антигипертензивных препаратов, по данным исследователей, риск ВПР плода не увеличивало. В то же время D.K. Li и соавт. показали, что риск развития пороков сердечно-сосудистой системы плода при использовании иАПФ в I триместре беременности не превышает такой риск в случае использования других антигипертензивных препаратов в сравнении с группой контроля, ОШ 1,54 (95% ДИ 0,90–2,62) и ОШ 1,52 (95% ДИ 1,04–2,21) соответственно или же просто наличия нелеченной АГ у матери. Лечение иАПФ во II и III триместрах беременности ассоциировано с большим риском маловодия и патологии почек у новорожденных. По мнению Американской диабетологической ассоциации, иАПФ и антагонисты рецепторов ангиотензина II (АРА II) не должны применяться у сексуально активных женщин репродуктивного возраста, учитывая высокую частоту незапланированных беременностей. Национальный институт здравоохранения и совершенствования медицинской помощи Великобритании (National Institute for Health and Care Excellence — NICE) рекомендует продолжать терапию блокаторами РААС вплоть до зачатия, чтобы минимизировать длительность периода отсутствия лечения. В таком случае женщинам с нерегулярным менструальным циклом, получающим иАПФ, целесообразно рекомендовать периодически выполнять тест на беременность, чтобы своевременно отменить потенциально тератогенную терапию. Согласно принятым в России рекомендациям, терапия иАПФ или АРА II должна быть отменена до наступления беременности, а в случае возобновления лечения после родов необходимо прервать лактацию.
Достижение целевого уровня АД с помощью своевременного назначения антигипертензивных препаратов является залогом успешного течения беременности у женщин с ДН. По данным M.M. Klemetti и соавт., более чем у 90% женщин с ДН в стадии протеинурии регистрируется повышенное АД к III триместру беременности. D.B. Carr и соавт. продемонстрировали, что при недостаточном контроле АД (среднее АД ≥100 мм рт.ст.) уровень протеинурии (4,69±1,08 и 1,65±0,43 г/сут; p = 0,007) и креатинина в крови (1,23±0,17 и 0,85±0,06 мг/дл; p = 0,02) во второй половине беременности был выше, а преждевременные роды на сроке до 32-й недели — чаще (38,1 и 4,6%; p = 0,007) в сравнении с группой женщин, достигших целевого уровня АД (среднее АД <100 мм рт.ст.). Риск преждевременных родов оставался статистически значимо выше при учете длительности СД и уровня HbA1C. Рекомендуемый Американской диабетологической ассоциацией уровень АД для беременных с хронической АГ составляет 120–160/80–105 мм рт.ст., что позиционируется как оптимальные значения для предотвращения синдрома задержки роста плода.
Однако для пациентов с ДН рекомендованное АД <140/90 мм рт.ст., а в случае наличия факторов риска прогрессии ХБП, в частности, альбуминурии можно рассматривать АД <130/80 мм рт.ст. в качестве целевого. В частности, группа ученых из Дании пришла к выводу, что инициация антигипертензивной терапии при АД >135/85 мм рт.ст. или суточной альбуминурии ≥300 мг блокаторами РААС на прегравидарном этапе или разрешенными препаратами во время беременности позволяет снизить риск преждевременных родов и преэклампсии у женщин с ДН. Большинство экспертов сходятся во мнении, что АД ниже 130/80 мм рт.ст. является целевым во время беременности у женщин с ДН.
Для терапии АГ во время беременности разрешены к использованию метилдопа и нифедипин, допустимо применение β-адреноблокаторов, но с осторожностью, учитывая возможность маскирования симптомов гипогликемии.
Достижение и поддержание целевых значений гликемии позволяют замедлить или остановить прогрессирование ДН. В метаанализе B. Fullerton и соавт., включающем пять исследований и 1475 пациентов соответственно, было получено, что интенсивный контроль гликемии статистически значимо снижает риск развития микроальбуминурии (ОР 0,56; 95% ДИ 0,46–0,68; p <0,00001), однако данных в пользу замедления прогрессирования до протеинурии получено не было (ОР 0,79; 95% ДИ 0,37–1,70). В исследовании S. Shurraw и соавт. принимали участие 23 296 человек с СД и расчетной СКФ менее 60 мл/мин/1,73 м2. При наблюдении в течение 46 мес было выявлено, что среди пациентов со СКФ 30–59,9 мл/мин/1,72 м2 риск развития терминальной стадии ХБП был выше на 22 и 152% при HbA1C >7 и более 9% соответственно по сравнению с теми, у кого HbA1C был менее 7% (p <0,001). В исследовании DCCT 1441 человек были рандомизированы на группы интенсивного и обычного контроля гликемии (HbA1C 7,3 и 9,1% соответственно). Через 6,5 лет интенсивный подход к терапии был ассоциирован с меньшим уровнем микроальбуминурии (10,2 и 17,7% соответственно, p <0,01) и протеинурии (1,4 и 3,2 соответственно, p <0,05). В исследовании Г.Р. Газизовой было показано, что недостаточная компенсация углеводного обмена (HbA1C >6,0%) у беременных с СД 1-го типа сопровождается повышением экскреции с мочой ранних маркеров развития ДН, провоспалительных цитокинов (интерлейкина-1β и моноцитарного хемоаттрактантного протеина-1) и трансформирующего фактора роста β1, во II и III триместрах беременности. Не вызывает сомнений необходимость достижения целевых значений гликемии, начиная с этапа планирования беременности и на всем ее протяжении как для стабилизации течения ДН, так и для достижения лучших исходов беременности.
Диабетическая ретинопатия выявляется у 34–72% беременных с СД 1-го типа и у 14% женщин с СД 2-го типа. Беременность относится к факторам риска прогрессирования диабетической ретинопатии (ДР), также к ним относятся: неудовлетворительный контроль гликемии, продолжительность СД, выраженность ДР до наступления беременности, преэклампсия и наличие хронической АГ. По данным ряда исследований, риск ухудшения ДР во время беременности минимален при продолжительности СД менее 10 лет и возрастает при стаже CД более 10 лет — у 10% женщин наблюдается прогрессирование ДР при продолжительности СД от 10–19 лет. При наличии пролиферативной диабетической ретинопатии и продолжительности СД менее 15 лет отмечено прогрессирование ДР у 18% беременных, при стаже СД более 15 лет — у 38%. Хорошая компенсация сахарного диабета, достижение целевой гликемии и уровня HbA1C менее 6,6% с этапа прегравидарной подготовки и на протяжении всего периода гестации у женщин с пролиферативной ретинопатией и продолжительностью СД более 20 лет позволяет сохранить стабильное состояние глазного дна во время беременности. Быстрая оптимизация гликемического контроля, резкое снижение гликемии и уровня HbА1С у женщин, вступивших в беременность с неудовлетворительной компенсацией СД, способствуют ухудшению ДР — развитию транзиторной макулопатии, микроаневризм и геморрагий на глазном дне. Риск прогрессирования ДР в зависимости от резкого улучшения состояния углеводного обмена показан в нескольких работах.
M. Vestgaard и соавт. выявили, что риск ухудшения ДР имеют 82% женщин с исходно высоким уровнем HbA1C при его резком снижении на 3% и более во время беременности. По нашим данным, у большинства (90%) больных СД 1-го типа беременность не вызывает развития или прогрессирования диабетической ретинопатии. Ухудшение ДР во время беременности происходит у 10% женщин с имеющимися до наступления беременности патологическими изменениями на глазном дне и проявляется увеличением количества микроаневризм и ретинальных геморрагий, развитием экссудативной формы макулопатии. Имеется прямая корреляция ухудшения ДР с частотой гипогликемических эпизодов во время беременности (табл. 1.1).
Таблица 1.1. Ухудшение диабетической ретинопатии в зависимости от частоты гипогликемических эпизодов (M±m)
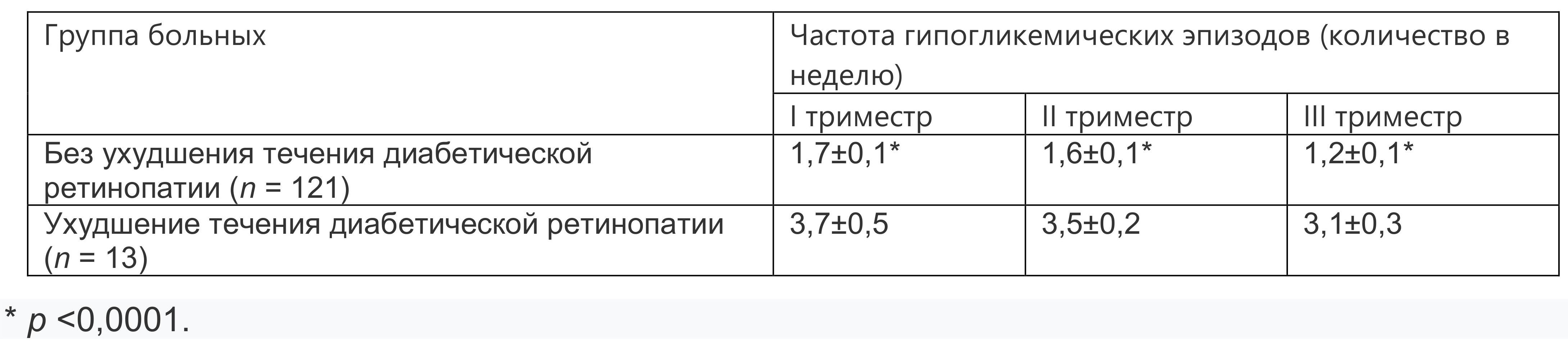
M. Vestgaard и соавт. в когортном исследовании 499 беременных с СД 1-го типа показали, что скорость прогрессирования ДР во время беременности составила 21,8%, в том числе ДР развилась у 24,4% женщин без патологических изменений на глазном дне до беременности. Ухудшение ДР произошло у 15,9% женщин с исходной ДР.
В нескольких исследованиях было показано, что развитие преэклампсии способствует ухудшению ДР в III триместре беременности и после родов. Женщины с предшествующей преэклампсией (ПЭ) (26% против 6%, p = 0,003) или хронической АГ (24% против 6%, p = 0,008) имели большую частоту лазерной коагуляции сетчатки в связи с прогрессированием ДР во время последующего наблюдения по сравнению с пациентками, у которых беременность протекала на фоне нормотензии. Отношения рисков оставались связанными с прогрессированием ДР после корректировки на продолжительность СД и ДН в регрессионном анализе Кокса — для ПЭ 3,5 (95% ДИ 1,1–10,9); р = 0,03 и для хронической АГ 3,2 (1,1–9,8); р = 0,04.
Давно не вызывает сомнений возможность благоприятного исхода беременности при сахарном диабете. При этом риски запланированной беременности у женщин с прегестационным сахарным диабетом приближаются к популяционным. Достижение целевых значений гликемии может потребовать времени и навыков контроля сахарного диабета, но выполнимо при достаточном уровне мотивации. Стабилизация диабетической ретинопатии также возможна как при планировании, так и во время беременности благодаря доступности лазерной коагуляции сетчатки. Длительная терапия блокаторами РААС (не менее 6 мес до зачатия) на этапе прегравидарной подготовки, достижение целевого уровня гликемии, HbA1C и АД с этапа планирования и во время беременности способствуют улучшению течения и исходов беременности у больных СД 1-го типа и диабетической нефропатией. Несмотря на это, тяжелая диабетическая нефропатия остается практически единственным плохо корригируемым фактором, препятствующим благополучному течению беременности при сахарном диабете. Тем важнее информировать молодых пациенток с СД о необходимости контроля гликемии и планирования беременности, в том числе в контексте развития и прогрессирования ДН и ее влияния на репродуктивную функцию. Достижение целевых значений гликемии, регулярное обследование функции почек и контроль АД позволит не допустить развития или прогрессирования ДН, а также своевременно поставить диагноз и начать лечение, тем самым увеличивая шансы на благоприятный исход беременности.
12.04.2023 | 20:58:36